
患者,女性,13岁,主因左卵巢幼年型颗粒细胞瘤ⅠC期术后及化疗后2年余,发现右附件区单房囊性包块入院。
患儿腹膨隆,无自觉不适。
经腹超声示右附件区巨大单房无回声区,21.3 cm×18.1 cm×9.9 cm,形态规则,边界清,内透声好,彩超未见明确血流信号;其周围可见多发散在小卵泡样无回声结构,直径约0.5~1 cm。血雌二醇水平增高。此次发病与初次左卵巢病变超声图像迥异,原发灶表现为低回声为主的实性包块,部分区域呈蜂窝状改变。
行剖腹探查及右附件切除术,病理示右卵巢幼年型颗粒细胞瘤,单囊型。
术后规律随访2年未见复发。
超声科;妇产科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
幼年型卵巢颗粒细胞瘤(juvenile granulosa cell tumor,JGCT)是一种罕见的恶性卵巢间质肿瘤,发病率约占卵巢肿瘤的0.1%~0.25%,多见于月经来潮前及30岁以下年轻女性[1,2,3,4]。JGCT多为单侧发病,以囊实性及实性包块为主,多由超声首诊发现。本例为具有特殊影像学表现的病例,初次发病表现为卵巢巨大实性包块,复发表现为罕见的单房囊性包块,易被误诊为卵巢良性囊肿。本例旨在强调JGCT术后随诊的重要性,了解JGCT不同的超声表现,减少对本病的漏误诊。
患儿,女性,13岁,主因左卵巢JGCT ⅠC期术后并化疗后2年余,发现右附件区囊性包块入院。患儿9岁月经来潮。
患儿10岁时因下腹持续性坠痛就诊,经腹超声检查显示腹盆腔内巨大低回声,范围约23.0 cm×16.4 cm×7.2 cm,边界清,内可见多处散在小无回声区,部分区域呈蜂窝状(实性区域>80%),CDFI:内部及周边可见中度丰富的动静脉血流(图1)。左卵巢未显示,右卵巢大小约2.6 cm×2.9 cm,形态结构未见异常,子宫大小形态未见异常。考虑左附件来源实性包块。盆腔常规+增强MRI:盆腔实性为主肿物,增强扫描见显著强化。实验室检查:孕酮>40.00 ng/ml↑(0.38~2.28 ng/ml),雌二醇514.00 pg/ml↑(27~122 pg/ml),血LDH 335 U/L↑(0~300 U/L),神经元特异性烯醇化酶(NSE) 26.8 ng/ml↑(0~16.3 ng/ml)。
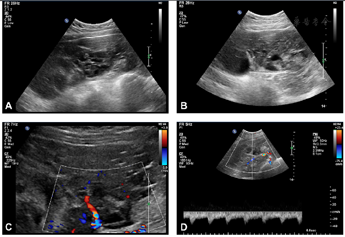

行开腹探查术+左附件切除术,术中见卵巢巨大肿物23 cm×13 cm×13cm,肿物后壁与腹壁粘连,表面有小破口,病理回报左卵巢幼年型颗粒细胞瘤。诊断"卵巢幼年型颗粒细胞瘤ⅠC期",术后行1程PEB(博莱霉素+依托泊苷+顺铂)及2程PVB(博来霉素+长春新碱+顺铂)化疗,术后规律超声随诊。
术后2年经腹超声发现右卵巢无回声区,大小4.8 cm×3.5 cm×3.5 cm,形态规则,边界清,内透声好。患儿雌孕激素水平正常,考虑不能排除生理性囊肿,随访观察半年,右附件区囊性包块逐渐增大至21.3 cm×18.1 cm×9.9 cm,形态规则,边界清,内透声好,其周边可见多发小卵泡样无回声结构,直径约0.5~1 cm(图2),CDFI:包块内未见明确血流信号。CT示腹盆腔内巨大囊性占位病变,增强扫描无强化。实验室检查:雌二醇171 pg/ml↑(27~122 pg/ml),孕酮、血LDH、NSE均正常。
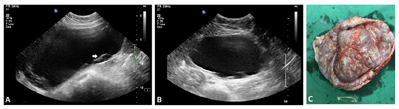

行剖腹探查及右附件切除术,术中见右卵巢巨大单房囊肿,囊壁较厚,未见实性突起(图2)。病理示右卵巢幼年型颗粒细胞瘤,单囊型。
术后规律随访2年未见复发。
卵巢JGCT患者多于年轻时发病,约90%的患者诊断时小于30岁,50%的患者小于10岁,平均诊断年龄13岁[3,4,5]。JGCT多为单侧性,肿瘤体积大,平均直径约12 cm,有包膜,内含囊实性或实性成分[3,6]。
JGCT的首选筛查方式为超声检查,其超声声像图特点与成人型卵巢颗粒细胞瘤相似,主要分为囊实性、实性及多房囊性三种类型[7,8,9,10]。绝大部分JGCT表现为囊实性包块,直径多>5 cm,以实性低回声为主,内可见散在分布的多发小无回声区,呈"瑞士奶酪征",形态相对规则,边界清,CDFI示实性成分内血流信号较丰富。实性JGCT直径多<5 cm,实性低回声为主,内部回声不均,边界清,CDFI示肿瘤内无或有少量血流信号。囊性JGCT少见,主要表现为多房囊性包块,边界清,囊壁及分隔较厚,部分房内透声差,CDFI:部分囊壁及分隔上可见少量点状或条状血流信号。极少表现为单房囊性包块,目前国内外文献仅查阅到2例单房囊性JGCT的报道[3,9,11]。
JGCT超声表现多样,无明显特征性表现,囊实性JGCT需与卵巢囊腺癌、囊腺瘤、畸胎瘤等相鉴别;实性者需与卵泡膜细胞瘤等相鉴别;囊性JGCT需与卵巢单纯囊肿、畸胎瘤、内膜异位囊肿等其他卵巢良性病变相鉴别。单纯影像学较难鉴别,血清抑制素、抗苗勒氏管激素、雌激素水平升高对于预测早期卵巢颗粒细胞瘤有帮助[12,13]。必要时需剖腹探查。
手术是治疗卵巢JGCT最重要的手段,临床分期是影响预后最重要的因素。约90%的JGCT患者就诊时诊断为Ⅰ期,且常为单侧局限于卵巢的病变,对于儿童及有生育要求的年轻女性,优先考虑保留生育功能的手术方式。手术切除后较少复发,预后良好。Ⅱ~Ⅳ期患者预后差,具有早期复发和进展迅速的特点[14,15]。
本例患者2年前第一次发病,左附件区JGCT表现为巨大实性为主包块(ⅠC期),术中探查右卵巢外观正常,遂行左侧附件切除术。2年后发现右附件区单房囊性包块,随访半年后体积明显增大,后病理证实为JGCT复发。本例特点为双侧病变影像学特点表现明显不一致,复发表现为极其少见的单房囊性JGCT,易被误诊为卵巢良性囊性包块。
综上,JGCT多见于年轻女性,尤其是青春期前女性,这些患者对于卵巢功能保留的要求高,因而若患者发现术后对侧卵巢囊性包块,往往会以随访观察为主。本例提示我们JGCT术后密切随诊的重要性,对于长期存在的囊肿样病变,必要时仍需行剖腹探查避免漏误诊的发生。
张莉,蔡胜,李建初,等.单房囊性复发性幼年型卵巢颗粒细胞瘤1例[DB/OL].中国临床案例成果数据库,2023(2023-06-08).http://journal.yiigle.com/LinkIn.do?linkin_type=cma&DOI=10.3760/cma.j.cmcr.2023.e01639.
所有作者均声明本研究不存在利益冲突



























