
患者,女性,72岁,因"间断心慌、胸痛、颈部发紧20 d"入院。既往身体健康。否认高血压、糖尿病等病史。
活动时出现心慌、胸痛、颈部发紧,休息后缓解。入院时血压130/70 mmHg(1 mmHg=0.133 kPa),心率81次/min,体格检查无异常。
冠脉造影示三支血管病变、前降支动脉瘤形成。
冠脉造影后进行介入治疗,前降支近段病变预处理进行球囊扩张时出现左主干夹层,其后出现三度房室传导阻滞并心室停搏(无房室交界区性逸搏及室性逸搏出现),迅速进行心脏按压,并先后于前降支、左主干及回旋支植入药物洗脱支架,仍为间断三度房室传导阻滞并心室停搏,其后植入临时起搏器。
患者术后出现心衰和低血压状态,经积极药物治疗后恢复正常。患者术后第3天恢复窦性心律,拔除临时起搏器。术后第14天患者症状明显改善,一般情况良好,出院并定期随访中。
心血管内科;心脏外科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
本文报道1例冠脉介入治疗并发左主干血管夹层导致心脏骤停的病例。临床上冠脉介入治疗导致冠脉血管夹层比较常见,但本例患者左主干夹层的发生除了医源性因素外,可能还和患者的自身因素(前降支动脉瘤形成)相关。其次,左主干夹层导致三度房室传导阻滞比较罕见,且三度房室传导阻滞时无房室交界区性逸搏及室性逸搏心律出现导致心室停搏也比较少见。心室停搏时迅速植入药物洗脱支架并植入临时起搏器是本例患者抢救成功的关键。
患者,女性,72岁,因"间断心慌、胸痛、颈部发紧20 d"入院。患者近20 d活动时出现心慌、胸痛、颈部发紧,休息后缓解。自服药物不详,效果不佳,为进一步求治而入院。既往身体健康。否认高血压、糖尿病等病史。无家族性遗传性疾病史,无传染性疾病史,无烟酒嗜好。入院时查体:血压130/70 mmHg(1 mmHg=0.133kPa),心率81次/min,律齐,心肺听诊无异常。其余各项体格检查无异常。
入院后完善相关辅助检查,血常规、空腹血糖、肝肾功能、电解质、心肌酶、肌钙蛋白均正常。总胆固醇6.56 mmol/L,高密度脂蛋白胆固醇1.77 mmol/L,低密度脂蛋白胆固醇4.25 mmol/L,甘油三酯1.83 mmol/L,C反应蛋白17.4 mg/L,N端利钠肽前体1850 pg/ml。胸片未见异常。心脏超声:左室舒张末期前后径41 mm,射血分数54%,心脏结构及血流未见异常。心电图:窦性心律,心率81次/min,Ⅱ、Ⅲ、aVF、V1~V6导联T波倒置。入院后第2天进行冠脉造影示左主干可见散在斑块形成,未见明显狭窄及阻塞性病变。前降支近段弥漫性狭窄,最重处约95%,前降支中远段可见巨大动脉瘤形成,长度约10 mm,最宽处约8 mm,其内可见涡流形成。第一对角支较粗大,开口及近段可见节段性狭窄,最重处约70%。回旋支中段可见节段性狭窄,最重处约90%;右冠近中段弥漫性狭窄,最重处约50%(图1)。
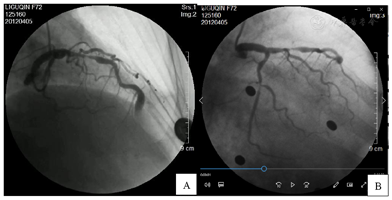

根据患者临床症状、心电图及冠脉造影检查结果诊断为冠心病、三支血管病变、前降支动脉瘤形成。临床诊断明确,无需鉴别诊断。
患者Syntax积分为14分,与患者及家属沟通后,计划于前降支近段及回旋支中段进行介入治疗。使用6F EBU 3.5导引导管,Runthrough NS导引导丝进入前降支远段血管,2.0 mm×15.0 mm顺应性球囊(sprinter)10个大气压(1个大气压=101.325kPa)扩张前降支近中段狭窄处。其后患者突发胸闷、胸痛、气短,继之出现三度房室传导阻滞,且无房室交界区性逸搏心律及室性逸搏心律出现而导致心室停搏。迅速进行心脏按压,静推阿托品后恢复窦性心律。造影复查,发现自左主干近段至回旋支开口处血管夹层形成,前降支及回旋支远段血管前向血流TIMI 2级(图2)。
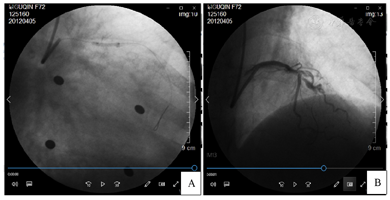

立即于前降支近段狭窄处植入火鸟3.5 mm×23.0 mm药物洗脱支架1枚,其后自前降支近段贯穿左主干开口植入火鸟4.0 mm×23.0 mm药物洗脱支架1枚,两支架重叠约3 mm。造影复查,左主干血管夹层消失,前降支近段未见明显狭窄,前降支及回旋支远段血管前向血流TIMI 3级,但回旋支开口处出现局限性狭窄,最重处约90%。
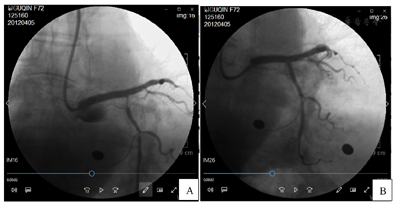
考虑回旋支开口处出现壁内血肿可能性大。其后使用第2条Runthough NS导引导丝进入回旋支远段血管,2.0 mm×15.0 mm顺应性球囊(sprinter)10个大气压先后扩张回旋支中段狭窄处和回旋支开口支架网眼处。其后自回旋支中段至开口狭窄处由远及近先后精确定位植入2枚火鸟2.5 mm×18.0 mm药物洗脱支架,两支架重叠约3 mm。其后于左主干及前降支近段支架内使用4.0 mm×12.0 mm非顺应性球囊(sprinter)18个大气压扩张。造影复查,左主干、前降支及回旋支支架内未见明显残余狭窄,前向血流TIMI 3级(图3)。手术期间患者每3~5分钟出现1次三度房室传导阻滞并心室停搏,每次均进行心脏按压、静推阿托品后恢复窦性心律,至冠脉介入治疗结束时共发生6次。其后植入临时起搏器,起搏频率60次/min(图4)。

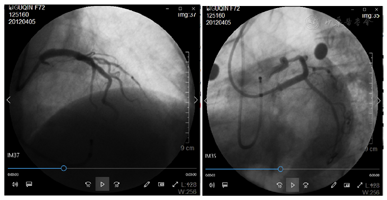

临时起搏器植入后观察20 min,患者起搏心律和窦性心律交替出现,血压稳定(120/65 mmHg左右),返回病房。急查电解质正常,肌钙蛋白T 0.5 ng/ml。术后12 h内患者反复恶心、呕吐,不能进食,术后第2天出现血压下降(80/45 mmHg左右),但神志清醒,两肺呼吸音粗糙,无啰音,四肢温度偏低,尿量减少(30~50 ml/h)。急查床旁超声未见心包积液,N端利钠肽前体3960 pg/ml。考虑心力衰竭合并低血压状态。立即快速补液(3000~5000 ml/d),并持续泵入多巴胺,最大剂量为15 μg/(kg·min),血压维持在100~130/60~80 mmHg,随后多巴胺及液体逐渐减量。患者术后第3天完全恢复窦性心律,心电图较术前无明显变化,拔除临时起搏电极。术后第8天复查肌钙蛋白T 0.06 ng/ml,N端利钠肽前体880 pg/ml。心脏超声示左室舒张末期前后径42 mm,射血分数56%。停用多巴胺。术后第14天患者连续步行2 km,无胸痛、心慌发作。其后出院。
患者术后症状明显改善,未再发作心慌、胸痛,一般情况良好。定期随访无异常。
本例患者冠脉介入治疗术中突发自左主干近段至回旋支开口处血管夹层形成,考虑可能原因如下:(1)患者的自身因素。有文献报告动脉瘤分为先天性和后天性两类[1,2]。其中冠状动脉粥样硬化是导致冠状动脉瘤形成的最常见原因,约占52%,多发生在50岁以上的患者。冠状动脉瘤的发生率为0.3%~1.9%[3,4]。主要发生机制是由于脂质代谢紊乱(高脂血症)特别是低密度脂蛋白胆固醇异常增高,过高的低密度脂蛋白胆固醇首先沉积于血管壁的内皮层,引起内皮细胞破坏及纤维化,进而累及中层弹力纤维以及血管壁全层,导致血管营养障碍,结果造成管壁内膜撕裂,管壁变性,局部萎缩、脆弱而形成动脉瘤[5]。我们认为本例患者冠状动脉瘤形成的主要原因可能是高脂血症导致的冠状动脉粥样硬化,而患者冠状动脉的非动脉瘤部位如左主干血管也可能存在不同程度的动脉粥样硬化和类似的病理改变,导致血管壁结构异常而易于发生血管夹层。(2)术者的操作因素。首先考虑可能与前降支近段狭窄处进行球囊扩张有关。因左主干存在散在斑块,当球囊扩张前降支近段狭窄时发生"跷跷板"样效应,从而引起左主干血管夹层形成。其次,指引导管对左主干血管壁抵压过紧,未能与左主干应保持良好的同轴性。再次,推注造影剂力量过大。这些因素可能都是此患者血管夹层形成的主要原因。综上所述,我们认为对于冠状动脉狭窄合并动脉瘤形成的患者,可首先推荐患者进行冠状动脉旁路移植术。若进行介入治疗,必须谨慎小心,避免暴力操作。介入手术过程中应注意以下几点:(1)选择预扩张球囊的直径不宜过大。(2)选择指引导管的型号不宜过大。应根据主动脉根部内径、冠脉的直径和操作的需要选择合适的指引导管型号。合适的指引导管应能提供良好同轴性,不会导致嵌顿。避免指引导管深插造成血管内膜损伤、撕裂。(3)推注造影剂应逐渐加压。避免用力过大冲击远端血管亦会导致内膜撕裂形成夹层。(4)出现血管急性夹层后要尽快开通闭塞血管,减少心肌缺血时间。首先,最重要的是保证导引导丝始终在真腔内。其次,血管夹层形成后避免反复扩张及反复造影,防止夹层扩展。再次,尽快植入支架以封闭血管夹层,且夹层远端支架选择不应保守,此支架远端落脚点要超过夹层远端5 mm,保证支架能完全覆盖夹层,以免因支架植入导致血管远端(支架以远)继发血肿形成[6]。有文献报告冠脉介入治疗导致血管急性夹层形成,首选治疗方法为支架植入术[7,8]。其成功率超过80%,病死率小于10%。如果不成功,则需行冠脉旁路移植术。其病死率上升至50%。
有文献报告房室结动脉发自右冠者占87.5%,发自回旋支者占12.5%[9]。本例患者房室结动脉可能发自回旋支,发生左主干及回旋支开口处血管夹层时累及房室结动脉的血液供应,可能是导致此患者发生三度房室传导阻滞的主要原因。我们原以为成功处理左主干血管夹层形成所引起的回旋支开口血肿后,三度房室传导阻滞可能迅速恢复。其实不然,我们不得不植入临时起搏器,间断起搏3 d后才恢复窦性心律。这说明即使持续时间不长的急性严重缺血也可能引起较长时间的房室结功能障碍。对于此类患者,应尽早植入临时起搏器。
缺血性心肌病患者中冠状动脉三支血管病变占71%,双支血管病变占27%,单支血管病变占2%。本例患者为冠状动脉三支血管病变,且术前N端利钠肽前体为1850 pg/ml,说明患者术前已经因缺血性心肌病导致心功能不全(慢性代偿期)。在此基础上,患者PCI术后肌钙蛋白T 0.5 ng/ml,N端利钠肽前体高达3960 pg/ml,提示左主干血管夹层形成引起围手术期心肌梗死,导致急性心肌缺血,进一步加重了心肌损伤和心功能不全,故本例患者心排血量的进一步急剧下降可能是引起PCI术后血压下降的主要原因。其次,患者术后12 h内反复恶心、呕吐,不能进食,可能会引起血容量不足,继而引起血压下降。因此,在积极治疗10 d后,随着冠状动脉血流的改善,冬眠心肌和顿抑心肌的活性逐渐恢复正常,心排血量增加,心功能不全逐渐改善,出院前N端利钠肽前体880 pg/ml下降,加之有效循环血容量的补充,从而使血压恢复正常。
总之,各类冠脉介入手术并发症的预防比救治更为重要,尤其在围手术期要努力规避各类严重并发症。术中一旦出现左主干血管夹层形成,切记要保持冷静,果断封闭血管夹层,迅速恢复冠状动脉的血供,积极处理其他相关并发症,维持生命体征稳定,并切实加强患者术后的各项管理工作,才可能使患者转危为安。
张领,李满生,李新峰,等.冠脉介入治疗并发左主干血管夹层致心脏骤停1例[DB/OL].中国临床案例成果数据库,2023(2023-06-13).http://journal.yiigle.com/LinkIn.do?linkin_type=cma&DOI=10.3760/cma.j.cmcr.2023.e01680.
所有作者均声明本研究不存在利益冲突



























