
患者,女性,31岁,因"言语不清4个月"就诊。患者2022年12月19日新冠感染,12月29日开始出现言语不清,步行不稳,饮水偶有呛咳,曾先后外院就诊,予抗抑郁、抗焦虑、改善睡眠治疗3个月。后自觉言语不清及步行不稳症状较前加重,出现下颌及舌肌震颤,至外院继续就诊,诊断为"构音障碍"。
舌肌运动下降,最长发音时间6 s,言语过程中音量低,有费力表现,存在不适宜停顿,有发音延长现象,喉部发音紧,音调变化小,构音动作无明显异常,存在口-面部动作,且发音启动迟于口-面部构音动作。
Frenchay构音评定量表:12a/28a,构音障碍类型为功能性构音障碍,严重度为重度障碍。
药物治疗:草酸艾司西酞普兰片。康复治疗:发音训练、构音器官运动训练、心肺训练、重复经颅磁刺激治疗等。
治疗10 d后症状改善,与家属日常交流质量提高。
神经科;康复科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
SARS-CoV-2由2019年开始席卷全球,并造成数千人死亡。2020年3月12日,世界卫生组织宣布新型冠状病毒肺炎(coronavirus disease 2019, COVID-19)为流行病。感染者因所谓"细胞炎症风暴"而表现出急性呼吸窘迫综合征,且病情变化可急转直下,患者可死于多器官衰竭[1]。COVID-19临床症状多变,以呼吸系统症状多为常见,目前研究发现COVID-19感染后可出现晚期的并发症[2]。长新冠(Long Covid)的概念是由美国卫生与公众服务部(HHS)与疾病预防控制中心和其他合作伙伴合作提出的[3],用以描述从COVID-19中康复但仍存在因感染而持续影响健康或出现常见症状的时间远远超过预期的情形[4]。我们报道1例因感染新冠肺炎引起构音障碍的康复方案,旨在提供潜在的康复诊疗思路,提高治疗效果。
患者,女性,31岁,本科学历,因"言语不清4个月"就诊。患者于2022年12月19日新冠感染,1周后逐渐出现四肢乏力,失眠,12月29日开始出现言语不清,步行不稳,饮水偶有呛咳,曾先后于多家外院就诊,查头颈MRI+MRA未见明显病灶,脑电图、心脏彩超、甲状腺激素、基因检测、腰穿脑脊液检查、抗核抗体检查等未见明显阳性结果。诊断为"焦虑抑郁状态",予抗抑郁、抗焦虑、改善睡眠治疗3个月,后自觉言语不清及步行不稳症状较前加重,出现下颌及舌肌震颤。后患者至北京协和医院就诊,查抗神经抗原抗体检测无明显异常,诊断为"构音障碍"。现患者停用抗抑郁药一个月,自觉下肢无力症状及下颌肌肉震颤较前缓解,仍遗留构音障碍、步行欠稳,为求改善言语清晰度及步行稳定性,于2023年4月18日门诊拟"构音障碍"收住入科。
既往史及传染病史:平素体健,患者于2022年12月19日新冠病毒感染史。否认其他传染病史。
入院体格检查:神志清,精神可,情绪平稳,营养中等,步入病房,查体合作。定向力、记忆力等无明显减退。双侧额纹对称存在,双侧瞳孔等大等圆,直径3 mm,对光反射存在,无明显眼震。四肢深浅感觉无明显异常。四肢关节活动活动度无明显异常。四肢肌力及肌张力无明显异常。双侧腱反射对称存在。双侧指鼻试验、轮替试验、跟膝胫试验均稳准。闭目难立征(-),Berg平衡:53/56分。双侧病理征(-)。
康复评定:自发言语可,声音低,语速慢,言语流畅性差,鼓腮、示齿等动作完成可,听理解可,复述命名可。吞咽反射存在,伸舌居中,无明显舌肌萎缩及舌肌震颤,改良饮水试验5级。坐位平衡3级,站立平衡2级。双下肢单腿支撑均为7秒。躯干和下肢运动年龄评估表:66/72分。ADL评分(BI):90分(上下楼梯-10分)。言语认知相关检查见表1。Frenchay构音评定检查结果为12a/28a,构音障碍类型为功能性构音障碍(重度障碍),结果图见表2。肺功能检查提示患者存在重度混合性通气功能障碍,见表3。心肺运动试验示:症状限制性心肺运动试验阴性,Weber心功能分级B级。患者最长发音时间为6 s,/s/音及/z/音发音时长为5 s,s/z比值为1。言语过程中有费力表现,存在不适宜停顿,有发音延长现象,喉部发音紧,音调变化小,构音动作无明显异常,存在口-面部动作,且发音启动迟于口-面部构音动作。
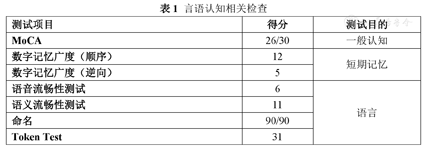
言语认知相关检查
言语认知相关检查
| 测试项目 | 得分 | 测试目的 |
|---|---|---|
| MoCA | 26/30 | 一般认知 |
| 数字记忆广度(顺序) | 12 | 短期记忆 |
| 数字记忆广度(逆向) | 5 | |
| 语音流畅性测试 | 6 | 语言 |
| 语义流畅性测试 | 11 | |
| 命名 | 90/90 | |
| Token Test | 31 |
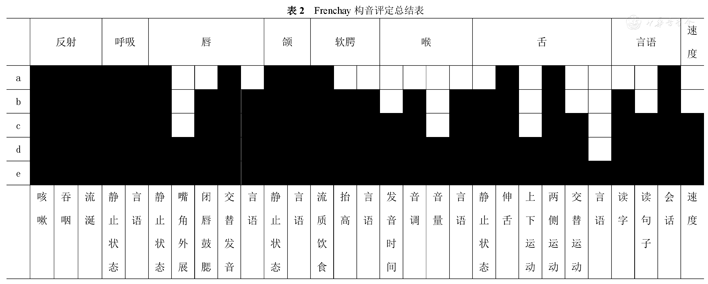
Frenchay构音评定总结表
Frenchay构音评定总结表
| 反射 | 呼吸 | 唇 | 颌 | 软腭 | 喉 | 舌 | 言语 | 速度 | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| a | |||||||||||||||||||||||||||||
| b | |||||||||||||||||||||||||||||
| c | |||||||||||||||||||||||||||||
| d | |||||||||||||||||||||||||||||
| e | |||||||||||||||||||||||||||||
| 咳嗽 | 吞咽 | 流涎 | 静止状态 | 言语 | 静止状态 | 嘴角外展 | 闭唇鼓腮 | 交替发音 | 言语 | 静止状态 | 言语 | 流质饮食 | 抬高 | 言语 | 发音时间 | 音调 | 音量 | 言语 | 静止状态 | 伸舌 | 上下运动 | 两侧运动 | 交替运动 | 言语 | 读字 | 读句子 | 会话 | 速度 | |
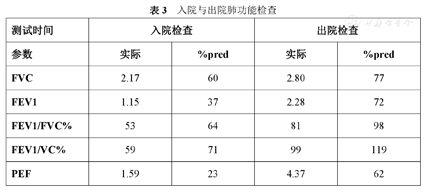
入院与出院肺功能检查
入院与出院肺功能检查
| 测试时间 | 入院检查 | 出院检查 | ||
|---|---|---|---|---|
| 参数 | 实际 | %pred | 实际 | %pred |
| FVC | 2.17 | 60 | 2.80 | 77 |
| FEV1 | 1.15 | 37 | 2.28 | 72 |
| FEV1/FVC% | 53 | 64 | 81 | 98 |
| FEV1/VC% | 59 | 71 | 99 | 119 |
| PEF | 1.59 | 23 | 4.37 | 62 |
1.头颅MRI+MRA(2023年1月25日,东南大学附属中大医院,0101100435):头颅MR平扫+头颈MRA未见明显异常;请结合临床随诊。颈椎MRI(2023年2月17日,南京脑科医院,MR507027):颈椎退变。胸部CT(2023年2月16日,南京脑科医院,CT331245):1.右肺中叶小结节,随诊;2.右肺下叶局限性肺气肿。
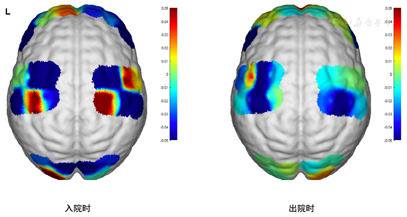
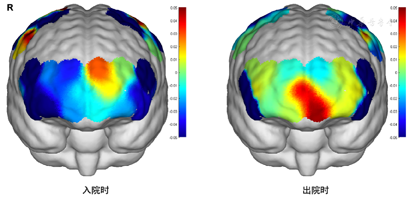
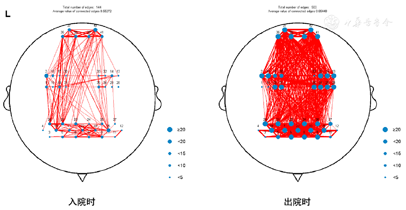
2.近红外静息态脑功能检查提示全脑氧合血红蛋白含量低,全脑功能连接下降,左侧前额叶功能连接显著下降,见图1,图2,图3。



诊断:(1)构音障碍;(2)焦虑抑郁状态
鉴别诊断:该病主要与失语症、嗓音障碍等疾病相鉴别。
入院后予草酸艾司西酞普兰片调节情绪。康复治疗:放松训练;呼吸训练;发音训练(鼻音哼鸣(Nasal Glide Stimulation)、轻声气流疗法(confidential flow therapy)、张口发音训练、哈欠-叹息练习);喉部肌肉放松;唇力量与运动范围训练;舌肌力量与运动范围训练;语音流畅性及词汇流畅性训练;心肺功能训练;重复经颅磁刺激治疗(刺激部位左侧前额叶背外侧,刺激频率为10 Hz,刺激强度为100%RMT,脉冲总数为1500次,治疗时间为12 min)。
治疗10d后,患者自觉发音流畅性改善明显,最长发音时间达15 s,言语过程中费力表现改善,未见明显口-面部动作。舌肌力量较入院增加。与家属日常交流质量改善。出院后指导继续家庭康复训练,主要包括呼吸训练、发音训练、唇力量与运动范围训练、舌肌力量与运动范围训练、心肺运动运动。
此病例为患者是因新型冠状病毒肺炎(COVID-19)感染而引起的构音障碍。COVID-19感染后长期存在的并发症可涉及多个系统,如神经心理方面出现"脑雾"("Brain Fog")、焦虑/抑郁、创伤后应激综合征(PTSD)等;心血管系统出现心肌炎、心力衰竭、心律失常等;骨骼肌肉系统出现肌痛、关节痛、体能下降;皮肤出现皮疹、脱发、荨麻疹;肺功能方面出现呼吸困难、氧气依赖、肺功能检查异常;血管系统可因感染出现静脉栓塞;胃肠道系统出现腹泻、恶心/呕吐、腹痛;肾功能出现损伤;及糖尿病的内分泌系统受损等症状[2]。
脑雾常表现为反应下降、难以集中注意力、健忘、无法全神贯注等,研究报道300例SARSCoV-2实时PCR检测(RT-PCR)阳性的患者中,采用9项伍德精神疲劳量表(Wood’s mental fatigue inventory)进行评估,发现34%的患者有脑雾症状[5]。本例患者在问诊过程曾诉感染病毒以后自觉反应力下降,加之合并构音障碍,且在外院诊断为焦虑抑郁状态,认知检查方面存在轻微认知功能下降,MoCA检查中延迟回忆得分为1和词汇流畅性检查不得分,均影响其回归职业生活。国外已有报道指出感染COVID-19患者出现不同的言语障碍,Furlanis等报道了两例患者感染COVID-19后出现口吃样不流畅言语,且两位患者均有不同程度的认知功能下降[6]。针对本例患者神经心理方面的异常表现,治疗方案选择非侵入性脑刺激技术联合相应的词汇流畅性训练,以及相应药物对症治疗。在选择刺激靶点前进行静息态近红外脑功能检测。目前功能性近红外光谱(functional near-infrared spectroscopy,fNIRS)已经从相对简单的血氧变化测量发展到可以记录大脑对认知任务实时反应[7]。fNRIS在临床中的应用涉及语言功能、脑损伤后对预后的预测、癫痫的管理、自主神经功能评估、偏头痛及轻度认知障碍生物标记物探查[8]。患者fNIRS入院检查结果提示全脑氧合血红蛋白含量低,全脑功能连接下降,左侧前额叶功能连接显著下降。据此治疗靶点为左侧额叶背外侧(采用10-20系统)。治疗后患者全脑功能连接均有明显改善,见图3(右侧),患者词汇流畅性任务也有改善(语音流畅性达10词/分钟,语义流畅性达16词/分钟)。本例也证实近红外检测可为非侵入性脑刺激技术提供治疗靶点。
COVID-19感染可引起自主神经功能紊乱[9]。Lechien等报道了一位28岁的女性因COVID-19感染而出现声带运动障碍,患者在视频喉镜检查中发现声带在吸气和呼气过程中存在反向运动(paradoxical movement)。作者认为声带的反向运动可能与病毒侵袭,声带存在ACE2表达有关,病毒通过声带ACE2侵入组织,进而影响喉神经末梢[10]。Nayana Narayanan报道了1例52岁的男性在感染COVID-19后出现构音障碍,详细评估后,作者提出患者出现构音障碍的原因是感染病毒及感染后出现的高血压。作者指出大多数与语言有关的肌肉非常容易受到高血压的不利影响。血压升高,这些肌肉长时间收缩可引起全身酸痛,导致全身疲劳并伴有轻微的言语困难。另外一个原因可能是COVID-19病毒与位于内皮中的血管紧张素转换酶和血管紧张素受体相互作用,从而改变调节血压的肾素-血管紧张素系统(RAS)的病理生理功能。RAS系统神经化学变化的改变导致肌肉萎缩和无力,由于语言系统的运动特性,肌肉生理方面的改变也会反映在语言子系统功能的减弱上[11]。本文患者虽音量低,但喉镜检查未见明显异常,且平素血压正常,感染病毒后也未出现血压增高。患者Frenchay构音结果提示构音器官运动力量及范围减弱,主要涉及唇与舌,且患者语速慢。患者心肺运动试验结果提示运动耐力下降,且患者存在步行不稳。因此患者运动耐力下降同时影响步行和言语构音运动。对此,康复治疗包含唇与舌的力量及运动范围训练,心肺耐力训练,及出院后的心肺耐力训练家庭指导。出院前患者构音器官运动范围及力量较入院好转。
目前临床上根据构音障碍的病因分为器质性构音障碍、运动性构音障碍和功能性构音障碍。患者神经影像学检查未见明显异常,且无构音器官的改变,因此不属于器质性构音障碍和运动性构音障碍。功能性构音障碍多见于儿童,又称发育性发音障碍,指构音器官无形态及功能异常且语言发育达4岁,而存在构音错误并呈固定状态[12]。徐丽娜等分析了37例成年功能性构音障碍患者的构音特点,发现此类患者构音错误类型为置换、歪曲,其次为脱落[13]。本例患者在言语过程中存在辅音脱落,碎片化发音现象。患者除构音运动运动不足外,还存在呼吸系统对言语的支持不足,患者最长发音时间仅为6s,/s/音和/z/音发音时长均不及正常范围,且Frenchay检查中音调与音量均变化不显著。患者言语过程中还表现出喉部发音紧,而患者外院喉镜检查未见明显异常。患者入院肺功能检查提示异常。因此治疗方案包括放松训练,呼吸训练,喉部肌肉放松手法,此外由于平静呼吸与言语运动中呼气相与吸气相比值不同,还需配合发音训练同时进行。治疗后患者音量稍有增加,家属诉言语流畅度改善,且碎片化发音及费力现象较入院改善。Regan等调查了爱尔兰第一波新冠疫情期间,感染COVID-19住院患者发生吞咽困难、嗓音障碍和构音障碍的现状、程度、预测因素和发展轨迹,结果显示在315位患者中,84%的患者需要改良经口进食的食物,31%的患者需要管饲,42%的患者出现了嗓音障碍,而23%的患者存在构音障碍。作者提出需促进言语治疗师的评估以减轻并发症[14]。
从笔者所查文献来看,因COVID-19感染所致的构音障碍大致可有以下几种原因:①神经系统损伤,如病毒感染引发脑卒中或脑炎[15,16];②运动障碍,可因肌力下降造成构音器官运动不足;③自主神经系统功能异常,Leonardi等回顾了感染COVID-19后神经系统表现,提出部分患者出现构音障碍、吞咽障碍等异常,可能与迷走神经受损有关,或者与膈肌麻痹或心动过速有关[17]。就本例患者而言,该患者存在构音器官运动范围及力量不足表现,且患者心肺功能及步行稳定性均较差,提示患者因感染病毒引起运动障碍,主要影响构音器官及下肢运动能力。与其他两种原因引起的构音障碍相鉴别之处是,首先,该患者未有中枢神经系统受损征象,头颅MR检查也未见明显异常,据此排除神经系统损伤引起构音障碍。其次,患者喉镜检查未有明显异常,声带运动良好。且在感染COVID-19感染前后均未有血压异常表现,排除因COVID-19感染引起RAS系统变化。患者虽在入院检查中表现出肺功能下降,但不存在膈肌麻痹和心动过速的临床表现,因此也不能归结为因自主神经功能受损造成构音障碍。尽管患者存在心境障碍,考虑到患者因音量低,言语模糊影响回归职业生活,两者相互影响,降低了患者的生活质量。综上,考虑造成该例患者构音障碍的病因为COVID-19引起的运动障碍。
本例患者因感染COVID-19而出现构音障碍,本文报道了患者的病例特点及评估方法,分析患者可能的病因,并提供了可行的治疗方案。尽管患者表现以言语方面为主,也需考虑患者可能存在认知功能下降,需通过多方面综合评估与治疗,改善患者功能。
高婧,张芹,江钟立,等.新冠后构音障碍康复治疗1例[DB/OL].中国临床案例成果数据库,2023(2023-07-26).http://journal.yiigle.com/LinkIn.do?linkin_type=cma&DOI=10.3760/cma.j.cmcr.2023.e01992.
所有作者均声明本研究不存在利益冲突



























