
患者,男性,16岁,发现右肩肿物5个月余,右肩肿物切除术后4个月余。
5个月前患者无意间触及右肩肿物,质稍硬无触痛,予以中药外敷消炎处理,未见好转。右肩肿物切除术后可见手术瘢痕,浅表淋巴结未及肿大。
基于院外病理,根据MICM诊断体系诊断为外周T细胞淋巴瘤,非特指型(ECOG 0分,Ann Arbor Ⅳ期A组,IPI 2分,PIT 0分)。后病理会诊结合免疫组化标记及TCR重排结果,符合ALK阳性间变性大细胞淋巴瘤,结合全身检查,更正诊断为ALK阳性大细胞淋巴瘤(ALCL)。
给予BV(维布妥昔单抗)+CHP(环磷酰胺,表柔比星,泼尼松),化疗后完成造血干细胞采集。
6个周期治疗评估疗效为完全缓解(CR),定期随访,疾病稳定。
血液科;淋巴瘤

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
间变性大细胞淋巴瘤(ALCL)是一种独特的非霍奇金淋巴瘤,其发病率占儿童淋巴瘤的10%~15%,主要特征为多形性肿瘤细胞和CD30高表达,>95%的ALCL儿童间变性大细胞淋巴瘤激酶(ALK)呈阳性。此疾病通常为晚期,结外受累常见。儿童ALCL复发率约为30%,其中化疗期间发生疾病进展的患儿预后差,生存率仅25%~41%。因此,尽早干预以避免治疗过程中发生疾病进展已成为改善ALCL患儿生存的关键[1]。本文报道1例ALK+ALCL儿童病例,旨在提高对本病和治疗的认识。
患者,男性,16岁,于2020年5月初无意间触及右肩肿物,质稍硬无触痛,予以中药外敷消炎处理,未见好转。
2020年6月16日于外院行右肩肿物切除术,术后病理示(右肩部)外周T细胞淋巴瘤,非特指。免疫组化结果:CD20(−),Ki-67(局灶30%+),CD35(−),CD21(−),CD23(−),CD138(−),Mum-1(−),CD2(+),CD4(+),CD5(+),CD7(−),CD8(−),CD56(−),CD43(+),CD10(−),PD-1(−),TIA-1(+),GanzymeB(+),Perforin(少数+),TDT(−),CD30(少数+),CD15(−),CD79a(−),PAX-5(−),MPO(−),CD34(−),CD117(−),ALK(少数+),Bcl-6(−),EMA(−),CD68(−),EBER(ISH)(−)。后病理送我院会诊,"右肩肿物"结合免疫组化标记及TCR重排结果,符合ALK阳性间变性大细胞淋巴瘤,建议临床行全身检查:I2020-09354:瘤细胞CD3(+),CD5(大部分+),CD7(−),CD8(−),CD4(+),CD30(+),ALK-1(+),EMA(散在+),TIA-1(+),GranzymeB(+),Perforin(散在+),CD56(部分+),CD21(−),CD23(−),CD117(−),TdT(−),MPO(−),CD123(−),CD20(−),CD79α(−),Ki67(约35%+);EB病毒原位杂交:EBER(−)。T淋巴瘤克隆性基因重排检测结果为阳性。荧光原位杂交:TP53探针缺失检测:阴性,DUSP22分离探针检测:阴性,TP63分离探针检测:阴性,ALK分离探针检测:阳性。二代测序:未见突变。为进一步诊治收住我院。
体格检查:右侧肩部可见直径约2 cm圆形伤口,浅表淋巴结未及肿大,肝脾肋下未及,美国东部肿瘤协作组(ECOG)评分0分。
实验室检查:乳酸脱氢酶(LDH)186 IU/L。
2020年7月3日行PET-CT(图1)提示:(1)右侧肩锁关节区皮下片絮状高代谢软组织影,首先考虑术后改变可能,肿瘤浸润不除外,请结合病理学检查结果。(2)右侧腋下高代谢淋巴结(较大者1.7 cm×1.0 cm,SUVmax 7.9),左侧耻骨上支溶骨性病变伴代谢增高(SUVmax 10.1),首先考虑肿瘤浸润。(3)右肺中叶内侧段条索影,代谢不高,随访。(4)胃窦部局部代谢增高,建议结合胃镜。(5)口咽、喉咽及双侧舌下腺区对称性代谢增高,胸腺区代谢增高,双侧附睾对称性代谢增高,考虑生理性摄取;肛管局部代谢增高,考虑炎症或生理性摄取。2020年7月4日行骨髓穿刺+活检未见淋巴瘤累及。
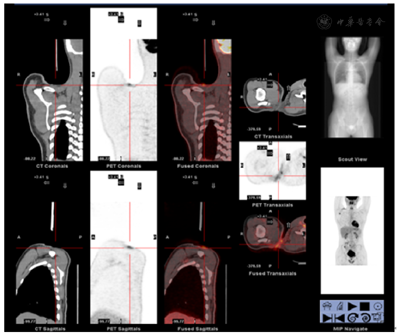

患者,男性,16岁,右肩肿物起病,本院病理会诊结果更正诊断为ALK阳性ALCL,瘤细胞CD3(+),CD30(+),ALK-1(+),EMA(散在+),Ki67(约35%+),EBER(−)。
(1)经典型霍奇金淋巴瘤多以淋巴结肿大为首发症状,多起始于一组受累的淋巴结,以颈部和纵隔淋巴结最常见,免疫组化通常为CD30(+)、CD15(+)或(−)、PAX-5弱(+)、CD3(−),病理上有特征性的镜影细胞,可进行鉴别。此例患者病理不符合,故鉴别。
(2)外周T细胞淋巴瘤,非特指型:多表现为浅表淋巴结肿大,半数伴有B症状;结外常累及皮肤及皮下组织、肝脾、消化道、甲状腺及骨髓等,临床分期较晚。病理上无特殊形态表现,CD30表达不恒定。本例患者病理不符合,故可鉴别。
2020年7月30日起予第1周期BV+CHP方案治疗,具体如下:维布妥昔单抗100 mg d1,环磷酰胺1324 mg d1,表柔比星130 mg d1,醋酸泼尼松片50 mg、每日2次d1~d5。每21天为1个疗程,共计完成6个疗程。
2020年9月29日中期评估为部分缓解(PR)。PET-CT(图2A)检查示:(1)左耻骨局部骨质破坏代谢轻度增高(SUVmax 4.5),与2020年7月3日治疗前我院PET-CT结果比较,代谢降低,Deauville 4分;(2)右肩部皮肤代谢增高,考虑术后改变可能,随诊。纵隔血池SUVmax 3.0;肝血池SUVmax 4.3。
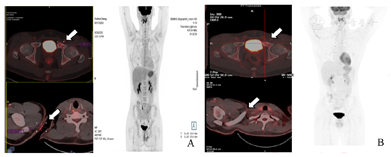

2021年1月11日末期评估为CR。PET-CT(图2B)检查示:(1)左耻骨局部骨质缺损,代谢增高(SUVmax 3.5),与2020年7月3日治疗前我院PET-CT结果比较,代谢明显降低,考虑淋巴瘤治疗后改变,Deauville 3分;(2)鼻咽顶后壁黏膜弥漫性增厚,局灶性代谢增高,建议五官科检查,除外恶性病变。纵隔血池SUVmax 2.4;肝血池SUVmax 3.6。
2021年2月8日完成自体干细胞采集。定期随访,末次2023年5月疾病稳定。
与成年人类似,尽管多次尝试改善前线治疗,但患有系统性ALCL的儿童/青少年的结果并不理想,失败率为25%~30%,靶向治疗成为新的重要治疗选择[2]。
CD30是一种跨膜糖蛋白受体,广泛表达于ALCL儿童各个系统,是一种理想的治疗靶点[1,2]。维布妥昔单抗(BV)是一种针对CD30的抗体-药物偶联物,其单药治疗在复发性ALCL儿童(>12岁)中显示出良好的抗肿瘤活性,儿童肿瘤协作组(COG)ANHL12P1研究亦显示在新诊断的非局限性ALK+/CD30+ ALCL患儿中的疗效与耐受性良好,BV为基础的化疗方案6个周期时CR率为97%,仅1例患儿在治疗过程中复发,从诊断至复发中位时间为7.5个月,2年无事件生存(EFS)率和OS率分别为79.1%和97.0%[1]。本例患者一线给予6个周期BV+CHP方案化疗后,疗效评价为CR,在有效缓解病情的基础上为后续自体造血干细胞移植巩固治疗创造了条件。因此,将BV纳入新诊断的ALCL儿童和青少年的前线治疗,与单独使用常规药物相比具有临床优势。
霍雨佳,许彭鹏,赵维莅.维布妥昔单抗联合化疗治疗儿童ALK阳性间变性大细胞淋巴瘤1例[DB/OL].中国临床案例成果数据库,2023(2023-10-10).http://journal.yiigle.com/LinkIn.do?linkin_type=cma&DOI=10.3760/cma.j.cmcr.2023.e02415.
所有作者均声明本研究不存在利益冲突



























