
了解非上呼吸消化道原发NK/T细胞淋巴瘤(NUAT-NKTCL)患者的临床特征及生存情况。
收集44例NUAT-NKTCL患者的临床资料,对其临床特征、疗效及生存进行相关性分析。
44例患者中男31例,女13例,中位年龄39(15~82)岁,Ⅲ/Ⅳ期者27例(61.4%)。就诊时主要症状为皮肤肿物(21/44)、腹痛(11/44)、睾丸肿大(3/44)及间断咳嗽(2/44)等。存在B症状者28例(63.6%),ECOG评分≥2分者12例(27.3%),IPI评分≥3分者18例(40.9%),LDH升高者占48.8% (21/43)。全组患者均接受化疗为主的治疗,中位随访13.5 (0.3~121.0)个月,共有32例患者死亡,中位生存时间为16个月,1年总生存率为54.1%。按照一线治疗方案分组:CHOP或CHOPE方案治疗组26例,完全缓解(CR)5例(19.2%),其中有19例患者接受左旋门冬酰胺酶(L-ASP)为主的挽救化疗,9例(47.7%)获CR,中位随访时间为11个月,中位生存时间为13个月;L-ASP为主的方案一线治疗组18例,CR 10例(55.6%),中位随访时间为15个月,中位生存时间为16个月。后者较前者CR率提高(P= 0.015),但两组患者总生存时间差异无统计学意义(P=0.774)。
NUAT-NKTCL侵袭性强,患者起病时分期晚。与传统方案比较采用L-ASP为主的方案可提高NUAT-NKTCL患者的疗效,但其长期生存与上呼吸消化道原发患者相比仍不理想,需要探索更为有效的治疗策略。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结外NK/T细胞淋巴瘤(Extranodal NK/T cell lymphoma, NKTCL)是一种高侵袭性淋巴瘤,根据原发病灶不同的解剖部位,分为上呼吸消化道原发NKTCL(Upper aerodigestive tract, UAT-NKTCL)和非上呼吸消化道原发NKTCL (Non- upper aerodigestive tract,NUAT-NKTCL)两种亚型[1]。前者临床常见,占NKTCL的80%以上,好发于面部中线部位,如鼻腔及鼻咽、口腔及口咽等;NUAT-NKTCL仅占NKTCL的10%~20%,常侵犯皮肤、胃肠道、睾丸、肺脏和肝脏等,恶性程度更高,晚期患者比例高,对化疗反应更差,中位生存时间不足1年[1、2、3]。由于NUAT-NKTCL发病率低,因此相关报道少见。我们在本研究中回顾性分析了44例NUAT-NKTCL患者的临床特征、疗效及生存情况,旨在提高对该病的认识。
1999年1月至2013年12月间我院共收治NKTCL患者244例,其中44例(18.0%)为NUAT-NKTCL患者。全部患者均由我院病理科医师依据WHO 2001年或WHO 2008年淋巴瘤病理分型标准作出诊断。1999年至2000年间的病例亦重新经病理科医师会诊证实诊断。NUAT-NKTCL定义为肿瘤原发于上呼吸消化道之外,例如皮肤、胃肠道、肺脏、肝脏等,发病时上呼吸消化道未见侵犯[1]。
采用Ann Arbor分期标准进行分期;胃肠道原发者,则采用Lugano分期。所有患者进行分期检查,包括血常规、生化、感染筛查、凝血指标、PET-CT(或颈部、胸部CT,或腹盆腔CT、超声,或淋巴结超声)、骨髓活检+骨髓穿刺和腰椎穿刺脑脊液筛查。
全组患者均接受化疗。在2008年5月之前,一线方案选择CHOP(环磷酰胺、长春新碱、阿霉素、泼尼松)或CHOPE(环磷酰胺、长春新碱、阿霉素、泼尼松、依托泊苷)方案;如果一线方案治疗不能达到完全缓解(CR)或复发进展,则采用左旋门冬酰胺酶(L-ASP)为主的挽救化疗(L-OP)方案[5]。在2008年5月之后,一线方案选择含有L-ASP的方案,如CHOP-L[4],L-OP[5];如果失败,则采用DICE(地塞米松、异环磷酰胺、顺铂、依托泊苷)、ICE(异环磷酰胺、卡铂、依托泊苷)或GEMOX(吉西他滨、草酸铂)挽救治疗。
按照淋巴瘤疗效评价Cheson标准进行疗效评价[6]。总生存(OS)时间定义为从诊断之日起至任何原因死亡或随访终点的间隔时间。随访截止时间为2014年6月。随访方式为电话联系、门诊和住院随诊及病历查阅。
采用SPSS 20.0软件进行统计学分析。采用Kaplan-Meier法进行生存分析,组间生存率的单因素分析采用Log-rank检验,采用COX回归风险模型进行多因素分析,组间率的比较采用χ2检验,P<0.05为差异有统计学意义。
44例患者中男31例,女13例,中位年龄为39(15~82)岁;进展期(Ⅲ/Ⅳ)者27例(61.4%);存在B症状(发热、盗汗、体重减轻)者28例(63.6%),ECOG评分≥2分者12例(27.3%),IPI评分≥3分者18例(40.9%),NK/T细胞淋巴瘤预后指数(NKPI)评分≥2分者26例(59.1%)[2];结外侵犯>1处者20例(45.6%);LDH升高者占48.8%(21/43)(表1)。乙型肝炎(乙肝)病毒既往感染(核心抗体阳性)者8例(18.2%),慢性乙肝者3例,其中2例患者合并乙肝后肝硬化。
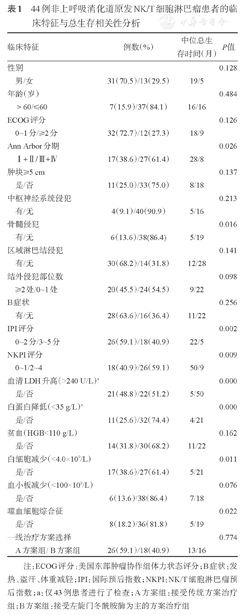
44例非上呼吸消化道原发NK/T细胞淋巴瘤患者的临床特征与总生存相关性分析
44例非上呼吸消化道原发NK/T细胞淋巴瘤患者的临床特征与总生存相关性分析
| 临床特征 | 例数(%) | 中位总生存时间(月) | P值 | |
|---|---|---|---|---|
| 性别 | 0.128 | |||
| 男/女 | 31(70.5)/13(29.5) | 19/5 | ||
| 年龄(岁) | 0.484 | |||
| >60/≤60 | 7(15.9)/37(84.1) | 16/16 | ||
| ECOG评分 | 0.126 | |||
| 0~1分/≥2分 | 32(72.7)/12(27.3) | 18/9 | ||
| Ann Arbor分期 | 0.026 | |||
| Ⅰ+Ⅱ/Ⅲ+Ⅳ | 17(38.6)/27(61.4) | 28/8 | ||
| 肿块≥5 cm | 0.137 | |||
| 是/否 | 11(25.0)/33(75.0) | 8/18 | ||
| 中枢神经系统侵犯 | 0.213 | |||
| 有/无 | 4(9.1)/40(90.9) | 5/16 | ||
| 骨髓侵犯 | 0.016 | |||
| 有/无 | 6(13.6)/38(86.4) | 5/19 | ||
| 区域淋巴结侵犯 | 0.141 | |||
| 有/无 | 30(68.2)/14(31.8) | 12/28 | ||
| 结外侵犯部位数 | 0.098 | |||
| ≥2处/0~1处 | 20(45.5)/24(54.5) | 9/22 | ||
| B症状 | 0.256 | |||
| 有/无 | 28(63.6)/16(36.4) | 11/22 | ||
| IPI评分 | 0.002 | |||
| 0~2分/3~5分 | 26(59.1)/18(40.9) | 22/5 | ||
| NKPI评分 | 0.009 | |||
| 0~1/2~4 | 18(40.9)/26(59.1) | 50/9 | ||
| 血清LDH升高(>240 U/L)a | 0.000 | |||
| 是/否 | 21(48.8)/22(51.2) | 5/50 | ||
| 白蛋白降低(<35 g/L)a | 0.000 | |||
| 是/否 | 11(25.6)/32(74.4) | 4/21 | ||
| 贫血(HGB<110 g/L) | 0.162 | |||
| 是/否 | 14(31.8)/30(68.2) | 11/22 | ||
| 白细胞减少(<4.0×109/L) | 0.011 | |||
| 是/否 | 17(38.6)/27(61.4) | 5/21 | ||
| 血小板减少(<100×109/L) | 0.076 | |||
| 是/否 | 6(13.6)/38(86.4) | 7/18 | ||
| 噬血细胞综合征 | 0.022 | |||
| 是/否 | 8(18.2)/36(81.8) | 5/19 | ||
| 一线治疗方案选择 | 0.774 | |||
| A方案组/B方案组 | 26(59.1)/18(40.9) | 13/16 | ||
注:ECOG评分:美国东部肿瘤协作组体力状态评分;B症状:发热、盗汗、体重减轻;IPI:国际预后指数;NKPI:NK/T细胞淋巴瘤预后指数;a:仅43例患者进行了检查;A方案组:接受传统方案治疗组;B方案组:接受左旋门冬酰胺酶为主的方案治疗组
就诊时临床表现依次为:皮肤肿物21例(47.2%),腹痛及肠道肿物11例(25.0%),睾丸和淋巴结肿大各3例(6.8%),间断咳嗽2例(4.5%)等。常见的结外侵犯部位包括皮肤(56.8%)、肠道(25.0%)、肺脏(20.5%)、肝脏(18.2%)、骨髓(13.6%)、中枢神经系统(9.1%)和睾丸(6.8%)等。11例肠道侵犯者中,以肠穿孔起病者3例,以肠梗阻起病者2例,均接受急诊手术;因腹痛就诊,经影像学或肠镜检查发现肠道占位者6例,其中1例在化疗中并发肠穿孔而接受急诊手术。
全组患者一线治疗均接受化疗,根据一线治疗方案的不同进行分组:
A组(CHOP或CHOPE传统方案治疗组):26例患者中,5例(19.2%)获得CR,2例(7.7%)获得部分缓解(PR),总有效率(ORR)为26.9%。5例CR者随后均复发。7例因一般情况差未能接受挽救治疗,其余19例患者均接受L-OP方案,挽救治疗后9例(47.7%)获得CR,1例挽救治疗达到CR后行自体造血干细胞移植(auto-HSCT)巩固,但在移植后3个月复发;2例挽救治疗达到PR后行异基因造血干细胞移植(allo-HSCT)治疗,维持缓解至今。
B组(L-ASP为主的方案治疗组):18例患者中,10例(55.6%)获得CR,2例(11.1%)获得PR,ORR为66.7%;CR率明显高于CHOP或CHOPE方案治疗组(P=0.015)。2例CR者随后行auto-HSCT,其中1例在移植后2个月复发,另1例持续缓解至今。10例CR者中有6例复发,在一线治疗未达CR或复发治疗进展的14例患者中,5例因一般情况差仅接受姑息支持治疗,其余9例均接受挽救化疗(包括DICE、ICE或GEMOX方案等),可评价疗效者8例,其中CR者2例,PR者1例,ORR为37.5%;其中1例挽救后PR者行auto-HSCT,但在移植后5个月复发;1例挽救后CR者行allo-HSCT,维持缓解至今。
全组患者共有7例接受HSCT治疗,其中一线治疗获得CR后行移植巩固2例,挽救治疗有效后行移植巩固5例;auto-HSCT 4例,allo-HSCT 3例。
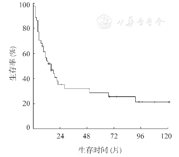
中位随访时间为13.5(0.3~121.0)个月,中位OS时间为16.0(95% CI 7.7~24.3)个月,1年OS率为54.1%(图1)。共计32例患者死亡,其中28例死于肿瘤进展,1例肠道侵犯者化疗后肠道穿孔伴发弥漫性腹膜炎行急诊手术,术后1周死于急性呼吸窘迫综合征,2例死于严重感染,1例死于急性心肌梗塞。8例患者并发噬血细胞综合征(HPS),其中7例患者在病情进展中出现,1例在起病时并发,挽救治疗均失败、死亡,诊断HPS后中位OS时间仅为1个月。

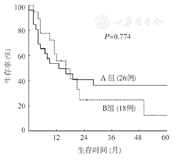
A组为一线接受传统方案治疗者,B组为一线接受含左旋门冬酰胺酶方案治疗者
A组26例患者中,19例死亡,7例无病存活至今,中位OS时间为13个月;B组18例患者中,死亡13例,5例持续缓解至今,中位OS时间为16个月。两组OS时间差异无统计学意义(P=0.774)(图2)。

单因素分析结果显示:疾病分期、骨髓侵犯、IPI评分≥3分、NKPI评分≥2分、LDH升高(>240 U/L)、白蛋白减低(<35 g/L)、起病时白细胞减少(<4.0×109/L)及并发HPS与患者OS时间明显相关(P值均<0.05);而年龄、性别、肿块≥5 cm、中枢神经系统侵犯、区域淋巴结侵犯、B症状、ECOG评分、贫血及血小板减少、一线方案的选择与OS时间无关(表1)。多因素分析结果显示只有LDH升高(P=0.004)、白蛋白降低(P=0.001)及并发HPS(P=0.022)是影响患者OS时间的独立预后因素。
NKTCL患者临床恶性程度高,尽管UAT-NKTCL和NUAT-NKTCL患者在性别、年龄、病理特征及免疫表型方面没有区别,但是后者的临床过程侵袭性更强,中位生存时间仅4.3个月(而UAT-NKTCL为1.6年)[3]。近年来,L-ASP显著改善了晚期NKTCL或复发/难治患者的生存[5, 7、8],多个前瞻性研究表明L-ASP在一线治疗中的疗效显著,患者生存期明显延长[4, 9、10、11]。但是由于NUAT-NKTCL发病率更低,相关报道少见,对其临床特征了解不足,L-ASP在NUAT-NKTCL患者中的疗效亦不明确。
在本研究中我们发现进展期患者高达61.4%,区域淋巴结侵犯者占68.2%,ECOG评分≥2分者占27.3%,IPI评分≥3分者占40.9%,NKPI评分≥2分者占59.1%,48.8%的患者伴LDH升高,远高于我中心曾报道的36例UAT-NKTCL患者[4],与各中心报道相近[2、3, 12],提示NUAT-NKTCL更具侵袭性。NUAT-NKTCL患者常见的起病部位为皮肤(21/44)和胃肠道(12/44),皮肤侵犯表现为单发或多发皮肤红斑、结节或肿物。胃肠道侵犯以小肠为主(8/12),与B细胞淋巴瘤不同,后者更倾向累及胃、末段回肠和结肠,Kim等[13]的研究亦显示相似的特点。
联合放、化疗已成为局限期上呼吸消化道原发的NK/T细胞淋巴瘤的标准治疗模式[14、15],L-ASP显著改善了NKTCL患者的疗效[4、5, 7、8、9、10、11],已成为NCCN指南推荐的一线化疗方案。但是,NUAT-NKTCL患者的预后极差,中位生存不足1年,甚至不如进展期UAT- NKTCL。由于前述的研究主要针对UAT-NKTCL,有关NUAT-NKTCL的报道非常有限,仅集中于少数中心的一些回顾性分析。Jiang等[16]报道47例原发于胃肠道的NKTCL患者中位OS时间仅有2.83个月;乔红梅等[17]荟萃分析了18例原发于睾丸的NKTCL患者的中位OS时间为4.6个月;Jo等[12]报道28例NUAT-NKTCL患者的中位OS时间为8.6个月,明显低于同期的89例UAT-NKTCL患者(86.5个月);Kim等[13]回顾性分析81例侵犯胃肠道的NKTCL患者资料,其中位OS时间仅为7.8个月。
本研究中44例患者全部接受化疗,中位生存时间为16个月,1和2年生存率分别为54.1%和35.1%。一线采用CHOP或CHOPE方案的26例患者的CR率仅为19.2%(5/26),随后采用含L-ASP的方案挽救治疗后CR率高达47.7%(9/19),中位OS时间为13个月,1年OS率为57.7%,挽救疗效与AspaMetDex方案[7]和SMILE方案[8]治疗复发/难治NKTCL相似;一线采用L-ASP治疗的18例患者的CR率为55.6% (10/18),中位OS时间为16个月。L-ASP用于一线治疗显著改善了患者的CR率(P= 0.015),但对其OS时间影响不明显(P=0.774),可能与前一组患者仍采用了L-ASP挽救治疗有关。Au等[3]报道35例NUAT-NKTCL患者均采用蒽环类为基础的化疗,中位OS时间为4.3个月,与前述报道相近。而本组患者由于采用了含L-ASP的化疗方案,因此CR率提高,中位OS时间延长至16个月。但是,由于本病的临床过程异质性强,对于本病的最佳治疗并未达成一致意见,因此需要多中心的前瞻性研究进一步探讨L-ASP治疗的疗效及本病的最佳治疗模式。
尽管与传统方案比较采用L- ASP可提高NUAT-NKTCL患者的疗效,但是与UAT-NKTCL患者相比疗效并不理想,我中心采用CHOP-L方案治疗36例初治UAT-NKTCL,局限期和进展期患者的2年OS率分别为88.3%和50.0%[4]。因此需要探索其他更为有效的治疗策略。
本组患者中有7例接受HSCT治疗,其中一线获得CR后行auto-HSCT巩固2例,挽救治疗达到PR或CR后行移植巩固5例(2例为auto-HSCT,3例为allo-HSCT)。接受auto-HSCT的4例患者中,3例在移植后半年内复发,死于肿瘤进展;而3例行allo-HSCT患者均维持缓解至今,分析原因可能与allo-HSCT诱发的移植物抗淋巴瘤效应相关。Suzuki等[18]报道120例NKTCL患者接受HSCT的结果,60例接受auto- HSCT,74例接受allo- HSCT(其中14例为auto-HSCT后复发),auto-HSCT组患者的2年OS率为69%,allo-HSCT组为41%,但是后者Ⅳ期、IPI评分中高危、移植前疾病进展状态患者更多,平衡上述3个因素后,两组患者的生存率差异无统计学意义。考虑到auto- HSCT相对安全,allo- HSCT费用及治疗相关死亡率较高,而NUAT-NKTCL侵袭性更强,即使采用L-ASP对患者生存的改善作用亦有限,因此对于能达到CR者,auto-HSCT不失为较好的选择,对于不能达到CR者,应尽早考虑行allo-HSCT。
总之,NUAT-NKTCL发病率低,侵袭性强,起病时分期晚,患者临床预后极差。虽然L-ASP可明显改善患者的疗效,但是依然不尽如意,因此需要进一步探索更为有效的治疗策略。



























