
评价重组人血小板生成素(rhTPO)治疗成人重型原发免疫性血小板减少症(ITP)的疗效及安全性。
对2012年5月至2014年5月期间收治的92例成人重型ITP患者的临床资料进行回顾性分析。其中新诊断ITP 7例、持续性ITP 29例、慢性ITP 56例,男35例、女57例,中位年龄34 (18~65)岁。全部患者接受rhTPO 300 U·kg-1·d-1×14 d治疗,停药后观察7 d。
全部92例患者rhTPO治疗的总反应率为60.9%(56/92),新诊断ITP、持续性ITP、慢性ITP患者总反应率分别为71.4%、62.1%、58.9%。所有患者治疗第4、7、14天与停药第7天中位PLT分别为27(5~49)、65(16~138)、133 (28~208)、67(15~134)×109/L。获完全反应的患者PLT达到100×109/L的中位时间为6(5~7)d, PLT达峰值中位时间为11(5~17)d,中位PLT峰值为194(132~274)×109/L。患者性别、年龄、疾病分期、血小板膜糖蛋白特异性抗体表达及外周血CD19+B、CD3+CD4+T、CD3+CD8+T淋巴细胞数量均与疗效无相关性(P>0.05)。少数患者出现低热、肌肉酸痛、乏力、头晕,均自行恢复。
rhTPO治疗成人重型ITP具有较好的疗效和安全性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
原发免疫性血小板减少症(ITP)的传统治疗方法是通过免疫抑制和免疫调节降低抗血小板自身抗体的产生和减少血小板破坏,包括糖皮质激素、静脉丙种球蛋白(IVIG)、达那唑、利妥昔单抗、脾切除、环磷酰胺等[1]。近年来多项研究表明,抗血小板自身抗体同样识别巨核细胞和前体巨核细胞的靶抗原,阻碍巨核细胞的分化与成熟,使血小板的产生减少[1]。同时,临床应用促血小板生成药物治疗ITP取得显著疗效,反映出ITP发病机制中存在血小板生成不足的因素[2]。重组人血小板生成素(rhTPO)、艾曲泊帕(eltrombopag)、罗米司亭(romiplostim)等促血小板生成药物已被推荐用于ITP的二线治疗[3]。2012年5月至2014年5月,我们应用rhTPO治疗92例成人重型ITP患者,报告如下。
我院血栓止血诊疗中心2012年5月至2014年5月住院治疗的重型ITP患者92例。男35例、女57例,中位年龄34(18~65)岁。疾病分期:新诊断ITP 7例,持续性ITP 29例,慢性ITP 56例。诊断与分期标准符合文献[3-4]。中位病程13(2~60)个月,治疗前中位PLT为5(2~9)×109/L。出血表现:皮肤出血52例(56.5%),口腔血疱14例(15.2%),鼻出血9例(9.8%),齿龈出血17例(18.5%)。
符合以下3项的ITP患者纳入研究:①符合重型ITP诊断标准[3](PLT<10×109/L且有需要治疗的出血症状);②既往药物治疗(包括糖皮质激素、IVIG、利妥昔单抗、达那唑、长春地辛/长春新碱、环孢素、环磷酰胺)无效或复发;③不适合或不接受脾切除治疗。
排除标准:①需要联合其他升血小板药物治疗的危重出血患者;②存在血栓性疾病病史者;③有先天性易栓症家族史的患者;④妊娠或哺乳期妇女;⑤骨髓活检提示网状纤维染色(MF≥Ⅱ级);⑥ HIV感染者;⑦病毒性肝炎活动期及有病毒性肝炎病史的患者;⑧丙氨酸转氨酶、天冬氨酸转氨酶、总胆红素、碱性磷酸酶、肌酐检测结果高于正常值上限20%。
rhTPO(沈阳三生制药有限责任公司产品)300 U·kg-1·d-1×14 d,停药后观察1周。避免使用糖皮质激素、IVIG、达那唑、利妥昔单抗、长春地辛/长春新碱等ITP治疗药物。需要紧急治疗的患者可接受血小板悬液输注治疗。
参照文献[3-4]判定疗效:①完全反应(CR):治疗后PLT≥100×109/L、无出血症状。②有效(R):治疗后PLT≥30×109/L、比基础血小板计数增加至少2倍、无出血症状。③无效(NR):治疗后PLT<30×109/L者血小板计数增加不到基础值的2倍或者有出血症状。总反应(OR)率为完全反应率与有效率之和。
取新鲜肝素抗凝外周血50 μl,加入CD3/CD16+56/CD45/CD19试剂(美国BD公司产品)20 μl,振荡混匀,避光,室温孵育20 min。加入1∶10稀释溶血素(美国BD公司产品)450 μl,避光、室温孵育10 min,上机(美国BD公司FACSCanto Ⅱ流式细胞仪)测定CD19+ B、CD3+CD4+ T、CD3+CD8+ T淋巴细胞相对数量。
采用商业化试剂盒(PAKAUTO,美国GTI公司产品),检测方法参照文献[5]。
应用SPSS 19.0软件进行统计学分析。不同分期患者治疗反应率的比较采用χ2检验。采用单因素Logistic回归分析对影响疗效的相关因素进行分析。P <0.05为差异有统计学意义。
全部92例患者中37例(40.2%)获CR,19例(20.7%)获R, 36例(39.1%)疗效判定为NR,OR率为60.9%。在新诊断ITP、持续性ITP、慢性ITP患者CR率分别为42.8%、34.5%、42.8%,OR率分别为71.4%、62.1%、58.9%。不同分期患者CR率与OR率差异无统计学意义(P>0.05)(表1)。
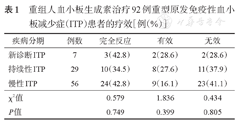
重组人血小板生成素治疗92例重型原发免疫性血小板减少症(ITP)患者的疗效[例(%)]
重组人血小板生成素治疗92例重型原发免疫性血小板减少症(ITP)患者的疗效[例(%)]
| 疾病分期 | 例数 | 完全反应 | 有效 | 无效 |
|---|---|---|---|---|
| 新诊断ITP | 7 | 3(42.8) | 2(28.6) | 2(28.6) |
| 持续性ITP | 29 | 10(34.5) | 8(27.6) | 11(37.9) |
| 慢性ITP | 56 | 24(42.8) | 9(16.1) | 23(41.1) |
| χ2值 | 0.579 | 1.836 | 0.434 | |
| P值 | 0.749 | 0.399 | 0.805 |
所有患者应用rhTPO治疗第4、7、14天与停药第7天,中位PLT分别为27(5~49)、65(16~138)、133 (28~208)、67(15~134)×109/L。37例CR患者PLT升至100×109/L的中位时间为6(5~7)d,达PLT峰值中位时间为11 (5~17)d,PLT峰值中位数为194 (132~274)×109/L。
92例患者初次用药时,有1例(1.1%)出现低热(体温37.3 ℃),2例(2.2%)出现轻度四肢肌肉酸痛,1例(1.1%)出现乏力,1例(1.1%)出现轻度头晕,1~4 h后上述症状自行消失。未发现与治疗相关的肝功能、肾功能损害,无血红蛋白升高。
37例CR患者rhTPO治疗前CD19+ B淋巴细胞中位数为17.05% (9.33%~39.40%) (正常参考值5.00%~22.00%)、CD3+CD4+ T淋巴细胞中位数为33.60% (23.20%~51.60%)(正常参考值33.00%~ 58.00%)、CD3+CD8+ T淋巴细胞中位数为36.90% (31.70%~42.28%)(正常参考值13.00%~39.00%)。
37例抗-GPⅡb/Ⅲa、抗-GPⅠb/Ⅸ、抗-GPⅠa/Ⅱa抗体的阳性率分别为29.73%(11/37)、2.70%(1/37)、8.10%(3/37)。
单因素Logistic回归分析显示,患者的性别、年龄、疾病分期与疗效均无相关性(P>0.05)。血小板膜糖蛋白特异性抗- GPⅡb/Ⅲa、抗-GPⅠb/Ⅸ、抗-GPIa/Ⅱa抗体表达与疗效无相关性(P>0.05)。外周血CD19+ B、CD3+ CD4+ T、CD3+CD8+ T淋巴细胞百分比与疗效无相关性(P>0.05)。详见表2。
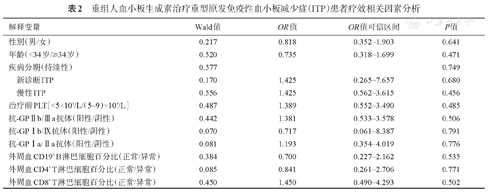
重组人血小板生成素治疗重型原发免疫性血小板减少症(ITP)患者疗效相关因素分析
重组人血小板生成素治疗重型原发免疫性血小板减少症(ITP)患者疗效相关因素分析
| 解释变量 | Wald值 | OR值 | OR值可信区间 | P值 | |
|---|---|---|---|---|---|
| 性别(男/女) | 0.217 | 0.818 | 0.352~1.903 | 0.641 | |
| 年龄(<34岁/≥34岁) | 0.520 | 0.735 | 0.318~1.699 | 0.471 | |
| 疾病分期(持续性) | 0.577 | 0.749 | |||
| 新诊断ITP | 0.170 | 1.425 | 0.265~7.657 | 0.680 | |
| 慢性ITP | 0.556 | 1.425 | 0.562~3.615 | 0.456 | |
| 治疗前PLT[<5×109/L/(5~9)×109/L] | 0.487 | 1.389 | 0.552~3.490 | 0.485 | |
| 抗-GPⅡb/Ⅲa抗体(阳性/阴性) | 0.442 | 1.381 | 0.533~3.578 | 0.506 | |
| 抗-GPⅠb/Ⅸ抗体(阳性/阴性) | 0.070 | 0.717 | 0.061~8.387 | 0.791 | |
| 抗-GP Ⅰa/Ⅱa抗体(阳性/阴性) | 0.081 | 1.193 | 0.354~4.019 | 0.776 | |
| 外周血CD19+B淋巴细胞百分比(正常/异常) | 0.384 | 0.700 | 0.227~2.162 | 0.535 | |
| 外周血CD4+T淋巴细胞百分比(正常/异常) | 0.085 | 0.841 | 0.261~2.706 | 0.771 | |
| 外周血CD8+T淋巴细胞百分比(正常/异常) | 0.450 | 1.450 | 0.490~4.293 | 0.502 | |
ITP患者巨核细胞血小板生成减少的假说最早于1915年由Frank提出[6]。早期通过光学显微镜发现大量异常的"年轻"巨核细胞的生成(胞质颗粒减少和血小板形成不良)[6];电镜观察发现细胞膜膨胀、细胞质空泡、线粒体肿胀、边缘区破坏和caspase3阳性等巨核细胞凋亡的表现[7, 8]。动物实验表明:输注抗-GPⅡb/Ⅲa、抗-GP Ⅰb/Ⅸ的抗体或含有抗血小板抗体血浆可导致巨核细胞生存期缩短[9]。应用111铟标记的血小板动力学研究表明,2/3慢性ITP患者的血小板寿命缩短[6]。Kashiwagi等[10]应用流式细胞术研究发现,与健康受试者比较,慢性ITP患者网织血小板的比例(血小板的转换率)增加,而网织血小板的绝对值降低。综上所述,目前认为巨核细胞成熟障碍是ITP发病机制的重要部分。
TPO是调控巨核细胞发育和血小板生成最重要的细胞因子,其特异性受体(TPO-R)称为人血小板生成素受体(C-MPL),表达于多能干细胞、巨核细胞、巨核细胞的前体细胞和血小板表面。TPO与C-MPL结合,通过JAK/STAT、RAS和活化蛋白酶等途径促进巨核细胞的分化和血小板的产生[11]。TPO在肝脏持续合成和分泌,血浆中的TPO通过与巨核细胞或血小板表面的TPO受体结合消耗性清除[12]。研究表明,ITP患者血浆TPO水平不增高或轻度增高,是由于血小板破坏增多,使TPO的清除加速,而内源性TPO的产生无相应增加[11]。内源性TPO产生相对不足[13]是血小板生成障碍的原因之一,为TPO及其受体激动剂治疗ITP提供了依据。
早期研制的重组人非全长型TPO (PEG- rHuMGDF)在一些健康受试者中产生抗PEG- rHuMGDF抗体,并且与内源性TPO产生交叉反应而引起严重的血小板减少[14]。2006年在中国上市的rhTPO为中国仓鼠卵巢(CHO)细胞表达的全长糖基化重组人TPO,其糖基化分子结构不同于PEG- rHuMGDF,免疫原性下降,被推荐用于ITP的二线治疗[5]。
赵永强等[15]应用rhTPO治疗82例慢性难治性ITP的近期有效率为85.3%(其中CR 48例,R 22例),给药第5、7、15天中位PLT分别为27.5 (16.0~ 47.0)×109/L、35.0 (20.5~78.5)×109/L、77.0 (41.8~ 119.5)×109/L. Wang等[16]应用rhTPO治疗糖皮质激素无效的ITP患者,随机对照临床试验结果显示:rhTPO治疗后PLT峰值和OR率均高于对照组,停药14 d时PLT仍维持在50×109/L。本组成人重型ITP患者rhTPO治疗的CR率与OR率分别为40.2%、60.9%。新诊断ITP、持续性ITP、慢性ITP患者CR率分别为42.8%、34.5%、42.8%,OR率分别为71.4%、62.1%、58.9%。不同分期患者CR率与OR率差异无统计学意义(P>0.05)。rhTPO治疗第4、7、14天及停药第7天PLT中位数分别为27(5~49)、65 (16~138)、133(28~208)、67(15~134)×109/L。获得CR的患者PLT达到100×109/L中位时间为6(5~7) d,达峰值中位时间为11(5~17)d,中位PLT峰值为194(132~274)×109/L。影响疗效的相关因素分析显示:患者的性别、年龄、疾病分期、血小板膜糖蛋白特异性抗体表达与疗效无相关性(P>0.05),外周血CD19+B、CD3+CD4+T、CD3+CD8+T淋巴细胞相对数量与疗效亦无相关性(P>0.05)。
本研究结果初步表明,rhTPO对于成人重症ITP具有较好的疗效,能够提高患者的血小板数量,减少出血风险,无严重不良反应发生。



























