
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性髓系白血病(AML)是一种基因型、表型、临床特征及预后都表现出异质性的疾病。目前,核型是评估AML预后的重要指标。采用传统的染色体条带分析方法,40%~49%的患者表现为正常核型(CN-AML)[1],这部分患者在预后方面仍然表现出异质性。促成这种异质性的主要因素是多种基因异常,这些基因异常影响疾病预后及治疗方案的选择。fms样酪氨酸激酶-3内部串联重复(FLT3-ITD)和核磷朊素1(NPM1)基因突变是CN-AML中常见的基因突变,FLT3-ITD是预后不良因素,而NPM1突变则提示预后良好,这两种基因异常检测在临床工作中已得到广泛开展,成为AML患者发病时的常规检测项目。我们分析了124例CN-AML患者的临床特征、FLT3-ITD及NPM1突变情况,并对预后影响因素进行了分析。
124例均为2008年7月至2014年6月就诊于我院的初治CN-AML患者。男79例(63.7%),女45例(36.3%)。中位年龄42(17~74)岁,>60岁者15例。诊断均符合FAB标准,其中M1 1例,M2 32例,M4 23例,M5 62例,M6 6例。选取同期接受DA、IA、MA方案诱导治疗的129例非正常核型AML患者进行疗效对比。129例非正常核型患者中男77例(59.7%),女52例(40.3%)。中位年龄39(15~73)岁。诊断均符合FAB标准,其中M2 58例,M4 30例,M5 38例,M6 3例。所有患者均进行了免疫表型、细胞遗传学检测,以及FLT3-ITD和NPM1突变检测。免疫表型分析采用间接免疫荧光标记法和流式细胞术分析。染色体分析采用常规G显带法。FLT3-ITD突变检测参照文献[2]方法,NPM1基因突变检测参照文献[3]方法。随访截止至2014年8月,中位随访时间12(1~63)个月。
诱导治疗采用含标准剂量阿糖胞苷的方案,包括:DA、IA、MA [D:柔红霉素,45 mg·m-2·d-1×3 d;I:去甲氧柔红霉素,10~12 mg·m-2·d-1×3 d, M:米托蒽醌,8~12 mg·m-2·d-1×3 d;A:阿糖胞苷,100~200 mg·m-2·d-1×7 d)。部分老年患者或低增生性白血病患者采用CAG(阿糖胞苷、阿克拉霉素、G-CSF)方案进行诱导治疗。缓解后治疗包括标准剂量的DA、IA、MA、HA(H:高三尖杉酯碱,3 mg×7 d)方案,含中剂量阿糖胞苷(1.0~1.5 g·m-2·12 h-1×3 d)的DA、MA、HA方案,以及CAG方案。
完全缓解及复发的定义参考2003年Cheson等报道的国际协作组AML疗效判定标准[4]。自确诊至死亡或随访结束的时间定义为总体生存(OS)时间,自达到完全缓解(CR)至复发或随访结束的时间定义为无复发生存(RFS)时间。
采用SPSS 13.0软件进行统计学分析,采用Kaplan-Meier法对OS及RFS进行分析。诱导缓解率的比较采用Fisher’s检验,OS及RFS的比较采用Log-rank法。预后的多因素分析采用COX回归模型分析。
124例CN-AML患者发病时有贫血症状者92例,占74.6%;有发热症状者17例,占13.7%;有出血症状者7例,占5.6%;胸骨压痛阳性者47例,占37.9%;脾大(肋缘下可触及)者37例,占29.8%;淋巴结肿大者14例,占11.3%。发病时中位WBC为15.0 (0.8~443.0)×109/L,WBC>50×109/L者28例。骨髓幼稚细胞比例中位数为0.680(0.215~0.970)。CD13阳性121例(97.6%),CD33阳性113例(91.1 %),CD34阳性74例(59.6%),CD56阳性27例(21.8%),CD117阳性98例(79.0%),CD7阳性32例(25.8%),CD38阳性100例(80.6%),HLA-DR阳性81例(65.3%)。124例患者FLT3-ITD突变阳性30例(24.2%),NPM1突变阳性32例(25.8%)。
124例CN-AML患者均完成诱导化疗,其中75例(60.5%)首次诱导治疗后达CR, 18例经2个疗程诱导治疗后达CR,1~2个疗程诱导CR率为75.0%,总CR率为87.9%。15例患者未达CR,其中8例骨髓持续不缓解,7例发病时WBC过高,虽然已给予预治疗,仍死于肿瘤溶解综合征、弥散性血管内凝血或白细胞瘀滞。109例达CR的患者中1例缓解后接受了自体造血干细胞移植,6例接受了异基因造血干细胞移植,缓解后接受造血干细胞移植的患者占6.4%,至随访结束时7例接受造血干细胞移植的患者仍无病生存。109例达CR的患者中有13例患者未坚持治疗。89例仅接受巩固治疗,其中29例接受了2个及2个以上疗程中剂量阿糖胞苷巩固治疗,9例(31.0%)复发;60例接受了0~1个疗程中剂量阿糖胞苷巩固治疗,其中25例(41.7%)复发。124例患者的中位OS时间为12(1~63)个月,中位RFS时间为9.5(0~ 62)个月。
去除接受CAG方案诱导治疗的患者(18例)后对诱导缓解率的影响因素进行分析,结果显示,女性患者1~2个疗程诱导CR率(84.2%)与男性(76.5%)相比差异无统计学意义(P=0.247);发病时外周血WBC>50×109/L患者的1~2个疗程诱导CR率(60.7%)较WBC≤50×109/L(85.9%)的患者低(P= 0.007);NPM1突变阳性患者的1~2个疗程诱导CR率(89.3%)与NPM1突变阴性患者(75.6%)相比差异无统计学意义(P=0.101);FLT3-ITD突变阳性患者的1~2个疗程诱导CR率(63.0%)低于FLT3-ITD突变阴性患者(84.8%)(P= 0.019)。
与同期接受DA、IA、MA方案诱导治疗的非正常核型患者相比,CN-AML患者的1~2个疗程诱导CR率高于复杂核型患者(46.1%)(P=0.001),与t(8; 21)/inv(16)(80.7%)、+8患者(66.2%)相比差异无统计学意义(P值均>0.05)。
对89例达到CR并接受巩固治疗的CN-AML患者进行生存分析,结果显示,发病时外周血WBC>50×109/L对RFS及OS时间均无影响。FLT3-ITD突变阳性患者RFS时间较FLT3-ITD突变阴性患者短,FLT3-ITD突变阳性患者OS时间虽然短于FLT3-ITD突变阴性患者,但差异无统计学意义。NPM1突变阳性患者的RFS及OS时间虽然较NPM1突变阴性患者长,但差异无统计学意义;即使根据FLT3-ITD突变情况将患者分层,NPM1突变阳性患者也并未表现出预后更好的趋势。诱导治疗疗程数与预后相关,经1~2个疗程诱导达CR患者的RFS及OS时间均长于经2个以上疗程诱导达CR的患者。缓解后治疗包含2个以上疗程中剂量阿糖胞苷的患者RFS及OS时间均长于缓解后治疗中仅采用0~1个疗程中剂量阿糖胞苷方案的患者(表1)。
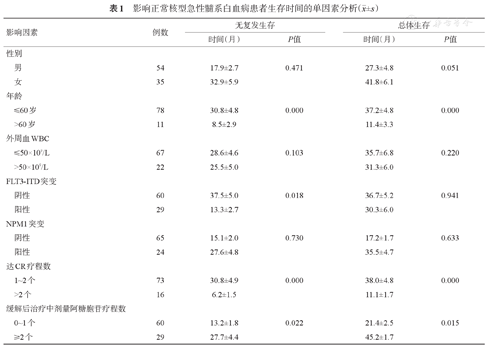
影响正常核型急性髓系白血病患者生存时间的单因素分析( ±s)
±s)
影响正常核型急性髓系白血病患者生存时间的单因素分析( ±s)
±s)
| 影响因素 | 例数 | 无复发生存 | 总体生存 | |||
|---|---|---|---|---|---|---|
| 时间(月) | P值 | 时间(月) | P值 | |||
| 性别 | ||||||
| 男 | 54 | 17.9±2.7 | 0.471 | 27.3±4.8 | 0.051 | |
| 女 | 35 | 32.9±5.9 | 41.8±6.1 | |||
| 年龄 | ||||||
| ≤60岁 | 78 | 30.8±4.8 | 0.000 | 37.2±4.8 | 0.000 | |
| >60岁 | 11 | 8.5±2.9 | 11.4±3.3 | |||
| 外周血WBC | ||||||
| ≤ 50×109/L | 67 | 28.6±4.6 | 0.103 | 35.7±6.8 | 0.220 | |
| >50×l09/L | 22 | 25.5±5.0 | 31.3±6.0 | |||
| FLT3-ITD突变 | ||||||
| 阴性 | 60 | 37.5±5.0 | 0.018 | 36.7±5.2 | 0.941 | |
| 阳性 | 29 | 13.3±2.7 | 30.3±6.0 | |||
| NPM1突变 | ||||||
| 阴性 | 65 | 15.1±2.0 | 0.730 | 17.2±1.7 | 0.633 | |
| 阳性 | 24 | 27.6±4.8 | 35.5±4.7 | |||
| 达CR疗程数 | ||||||
| 1~2个 | 73 | 30.8±4.9 | 0.000 | 38.0±4.8 | 0.000 | |
| >2个 | 16 | 6.2±1.5 | 11.1±1.7 | |||
| 缓解后治疗中剂量阿糖胞苷疗程数 | ||||||
| 0~1个 | 60 | 13.2±1.8 | 0.022 | 21.4±2.5 | 0.015 | |
| ≥2个 | 29 | 27.7±4.4 | 45.2±1.7 | |||
将年龄、性别、发病时外周血WBC、FLT3-ITD、NPM1突变、达到缓解的诱导治疗疗程数、缓解后治疗中的中剂量阿糖胞苷疗程数6项与生存相关的指标纳入COX回归模型进行多因素分析,仅诱导治疗疗程数与OS有关(表2)。
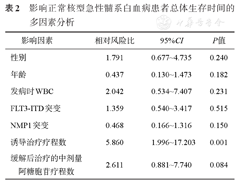
影响正常核型急性髓系白血病患者总体生存时间的多因素分析
影响正常核型急性髓系白血病患者总体生存时间的多因素分析
| 影响因素 | 相对风险比 | 95%CI | P值 |
|---|---|---|---|
| 性别 | 1.791 | 0.677~4.735 | 0.240 |
| 年龄 | 0.437 | 0.130~1.473 | 0.182 |
| 发病时WBC | 2.042 | 0.534~7.407 | 0.231 |
| FLT3-ITD突变 | 1.359 | 0.540~3.417 | 0.515 |
| NMP1突变 | 0.468 | 0.166~1.316 | 0.150 |
| 诱导治疗疗程数 | 5.860 | 1.996~17.203 | 0.001 |
| 缓解后治疗的中剂量阿糖胞苷疗程数 | 2.611 | 0.881~7.740 | 0.084 |
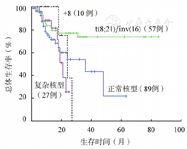
将89例达到CR并接受巩固治疗的CN-AML患者及94例达到CR并接受巩固治疗的非正常核型患者的RFS及OS时间进行比较,结果显示CN-AML患者的RFS(P=0.012)及OS时间(P=0.024)均短于t(8;21)/inv(16)患者;与+8患者相比,差异无统计学意义(P>0.05);与复杂核型患者相比,RFS时间较长(P=0.028),OS时间差异无统计学意义(P>0.05) (表3、图1、图2)。
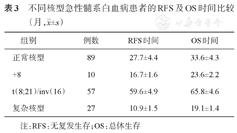
不同核型急性髓系白血病患者的RFS及OS时间比较(月, ±s)
±s)
不同核型急性髓系白血病患者的RFS及OS时间比较(月, ±s)
±s)
| 组别 | 例数 | RFS时间 | OS时间 |
|---|---|---|---|
| 正常核型 | 89 | 27.7±4.4 | 33.6±4.3 |
| +8 | 10 | 16.7±1.6 | 23.6±2.2 |
| t(8;21)/inv(16) | 57 | 59.6±4.9 | 65.8±4.6 |
| 复杂核型 | 27 | 10.9±1.5 | 19.1±1.4 |
注:RFS:无复发生存;OS:总体生存


在AML的预后分组中,CN-AML被归为预后中等组,但这一类型AML在预后方面仍表现出异质性。FLT3-ITD及NPM1突变对CN-AML的预后有重要影响。在CN-AML中,FLT3-ITD突变检出率约为30%[5],是CN-AML最重要的不良预后因素之一,文献报道FLT3-ITD突变阳性对CR率[6]、缓解持续时间、无病生存(DFS)、无事件生存(EFS)及OS等预后指标都具有不良影响[5,7]。本研究结果显示FLT3-ITD突变阳性对接受标准剂量DA、IA、MA方案诱导治疗CN-AML患者的CR率和RFS具有不良影响;但FLT3-ITD突变阴性患者的OS与FLT3-ITD突变阳性患者相比并不具有优势,这可能与缓解后治疗阿糖胞苷剂量不足有关。NPM1突变是CN-AML常见的基因突变。据我国学者报道,CN-AML中NPM1突变率为35%~40%[8,9],而本组患者NPM1突变率较低,可能与正常核型的判定标准有关,本研究对正常核型的判定标准为至少10个有丝分裂象显示为正常核型,如果判定标准为至少20个有丝分裂象均为正常核型,则CN-AML患者NPM1突变率可能会更高。NPM1突变对CN-AML预后的影响已被很多研究证实:NPM1突变阳性且FLT3-ITD阴性是CR率[10]、DFS[11]、RFS[12]、EFS[11]及OS[9,12]的良好影响因素。在本研究中,NPM1突变阳性患者的RFS及OS虽然优于NPM1突变阴性患者,但差异并不具有统计学意义,即使根据FLT3-ITD突变情况将患者分层,NPM1突变阳性患者也并未表现出预后更好的趋势。主鸿鹄等[13]报道,NPM1突变阳性且FLT3-ITD阴性患者与其他患者相比,RFS较长,但是差异同样不具有统计学意义。这与国外NPM1突变阳性患者预后较好的报道不同。可能是由于NPM1突变阳性患者在缓解后未能接受足量的中大剂量阿糖胞苷治疗,而影响了疗效。
本研究结果显示+8患者1~2个疗程诱导CR率、RFS及OS时间与CN-AML患者差异无统计学意义,但+8患者病例数较少,结论有待于进一步证实。复杂核型患者被归为预后较差组,本次研究中,复杂核型患者的1~2个疗程诱导CR率及RFS时间明显差于CN-AML患者,但OS时间与CN-AML患者的差异不具有统计学意义,这可能与部分患者随访时间较短有关。
CN-AML患者被归为预后中等组,但这一组患者具有较强的异质性,不同的基因突变可进一步将CN-AML归为不同的预后组。随着基因突变检测的普及,其对临床治疗的指导作用逐步显现,而充分的缓解后治疗对于提高疗效、延长生存至关重要。


























