
探讨伴单克隆免疫球蛋白(McIg)边缘带淋巴瘤(MZL)患者的临床特征和治疗方法。
收集2007年1月至2014年12月3例伴McIg的MZL患者资料,结合文献报道的36例患者资料进行回顾性分析。
39例患者中男女比例为1.05∶1,平均年龄(65.1±12.3)岁。黏膜相关淋巴组织淋巴瘤(MALTL)28例(71.8%),结内MZL 9例(23.1%),脾MZL 2例(5.1%)。早期患者9例(23.1%),晚期患者30例(76.9%)。首发症状以皮肤紫癜、周围神经病等非占位性表现常见(65.5%,19/29)。13例(33.3%,13/39)伴自身免疫现象,以干燥综合征最多见。MALTL以非胃肠道型为主(60.7%,17/28)。伴有的McIg以IgM型最多见(82.0%,32/39),余依次为IgA、κ-轻链、IgG和双克隆型。血浆McIgM水平为(25.55±21.31) g/L,晚期患者明显高于早期患者[(29.85±20.60)g/L对(3.23± 2.95)g/L,P=0.008]。30例患者接受2~8个疗程化疗,完全缓解(CR)率56.0%,总反应率92.0%;中位随访10个月,3年无疾病进展生存率和总生存率分别为44.7%和76.5%。含和不含利妥昔单抗化疗组患者的总反应率为100.0%和78.6%,CR率为63.6%和50.0%,但差异均无统计学意义(P值均>0.05)。McIgM型患者CR率明显高于非McIgM型者(P=0.026);治疗后血浆McIgM水平较治疗前明显下降(P=0.002)。
伴McIg的MZL好发于60岁以上老年人,诊断时分期较晚,易伴发自身免疫现象,可能是MZL的一种独特亚型。非胃肠道型MALTL更易伴发McIg,多见McIgM型,其他免疫球蛋白型少见。MZL患者接受含利妥昔单抗的治疗方案可能疗效会更好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
单克隆免疫球蛋白(monoclonal immunoglobu- lin, McIg)是由单克隆浆细胞或B淋巴细胞增殖产生的一种异常免疫球蛋白,临床上以血清或尿中出现大量McIg或其片段为特征,多见于恶性浆细胞与B淋巴细胞肿瘤患者。最近研究发现分泌McIg的B细胞淋巴瘤可能为一类特殊的亚型[1,2]。边缘带淋巴瘤(marginal zone lymphoma, MZL)属于B细胞非霍奇金淋巴瘤(B cell non- Hodgkin lymphoma, B-NHL),临床上伴McIg的MZL(McIg-MZL)并不常见,在本文中我们报道3例McIg-MZL患者资料,并结合文献对McIg-MZL患者的临床特征进行综合分析。
我院2007年1月至2014年12月收治McIg-MZL患者3例。男2例、女1例,年龄56~75岁,均经组织活检病理诊断。黏膜相关淋巴组织淋巴瘤(mucosa associated lymphoid tissue lymphoma, MALTL)1例、结内MZL(nodal MZL, NMZL)2例。根据Ann Arbor临床分期,Ⅲ期2例、Ⅳ期1例。血浆免疫固定电泳法证实存在McIg, IgM-κ型2例,IgM-λ型1例,血浆IgM 18.0~30.5 g/L。
以MZL、McIg中英文为关键词,检索PubMed. cn、Medline、万方数据库,2001至2014年McIg-MZL相关文献27篇,报道患者36例。
将上述39例患者的临床资料纳入分析。根据Ann Arbor临床分期,将患者分为早期(Ⅰ~Ⅱ期)、晚期(Ⅲ~Ⅳ期)。疗效评价:按照WHO淋巴瘤疗效评价标准进行疗效判断,总有效率(ORR)为完全缓解(CR)与部分缓解(PR)率之和。远期疗效以总生存(OS)率和无疾病进展生存(PFS)进行评价。
采用SPSS17.0软件进行统计学分析,计数资料采用Fisher's确切概率法,计量资料采用t检验,采用Kaplan-Meier法及Log-rank检验进行生存分析。P<0.05为差异有统计学意义。
我院收治的3例患者分别以右眼肿痛、咽喉肿痛、腹部包块为首发症状。除1例确诊后出院失访,另2例患者接受CHOP(环磷酰胺、多柔比星、长春新碱、泼尼松)方案化疗4~6个疗程,分别获得PR、CR;血浆McIg水平下降17.6%、65.6%;随访6个月、6年,McIg持续存在,其中1例患者淋巴瘤本病一直处于稳定期,持续伴原发免疫性血小板减少症(primary immune thrombocytopenia, ITP),小剂量激素治疗可维持较高血小板水平。以上3例患者及文献报道的36例患者资料见表1。
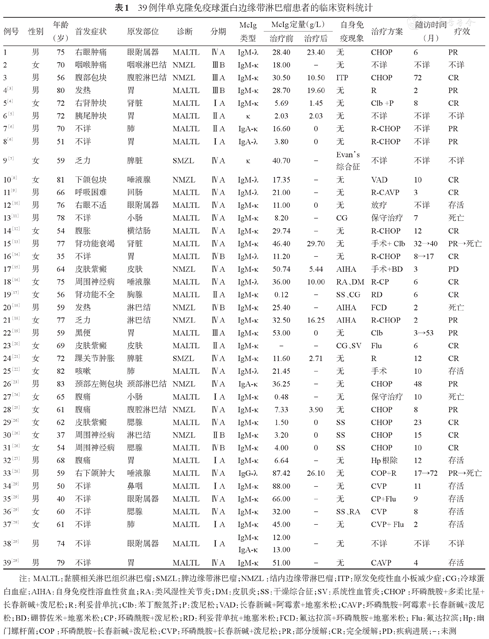
39例伴单克隆免疫球蛋白边缘带淋巴瘤患者的临床资料统计
39例伴单克隆免疫球蛋白边缘带淋巴瘤患者的临床资料统计
| 例号 | 性别 | 年龄(岁) | 首发症状 | 原发部位 | 诊断 | 分期 | McIg类型 | McIg定量(g/L) | 自身免疫现象 | 治疗方案 | 随访时间(月) | 疗效 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后 | ||||||||||||
| 1 | 男 | 75 | 右眼肿痛 | 眼附属器 | MALTL | ⅣA | IgM-λ | 28.40 | 23.40 | 无 | CHOP | 6 | PR |
| 2 | 女 | 70 | 咽喉肿痛 | 咽喉淋巴结 | NMZL | ⅢB | IgM-κ | 18.00 | - | 无 | 不详 | 不详 | 不详 |
| 3 | 男 | 56 | 腹部包块 | 腹腔淋巴结 | NMZL | ⅢA | IgM-κ | 30.50 | 10.50 | ITP | CHOP | 72 | CR |
| 4[3] | 男 | 80 | 发热 | 胃 | MALTL | ⅢB | IgM-κ | 28.70 | 19.60 | 无 | R | 2 | PR |
| 5[4] | 女 | 72 | 右肾肿块 | 肾脏 | MALTL | Ⅰ A | IgM-κ | 5.69 | 1.45 | 无 | Clb +P | 8 | CR |
| 6[5] | 男 | 72 | 胰尾肿块 | 胃 | MALTL | ⅡA | κ | 2.03 | 2.03 | 无 | 不详 | 不详 | 不详 |
| <7[6] | 男 | 70 | 不详 | 肺 | MALTL | ⅡA | IgA-κ | 16.60 | 0 | 无 | R-CHOP | 不详 | PR |
| 8[6] | 男 | 51 | 不详 | 胃 | MALTL | ⅠA | IgA-λ | 3.80 | 0 | 无 | R-CHOP | 不详 | PR |
| 9 [7] | 女 | 59 | 乏力 | 脾脏 | SMZL | ⅣA | κ | 40.70 | - | Evan's综合征 | 不详 | 不详 | 不详 |
| 10[8] | 女 | 81 | 下颌包块 | 唾液腺 | NMZL | ⅣA | IgM-λ | 17.35 | - | 无 | VAD | 10 | CR |
| 11[9] | 男 | 66 | 呼吸困难 | 回肠 | MALTL | ⅣA | IgM-λ | 21.00 | - | 无 | R-CAVP | 3 | CR |
| 12[10] | 男 | 76 | 右眼不适 | 眼附属器 | MALTL | ⅣA | IgM-κ | 11.00 | 0 | 无 | 放疗 | 不详 | 存活 |
| 13 [11] | 男 | 78 | 不详 | 小肠 | MALTL | ⅣA | IgM-κ | 8.20 | - | CG | 保守治疗 | 7 | 死亡 |
| 14 [12] | 女 | 54 | 腹胀 | 横结肠 | MALTL | ⅣA | IgM-κ | 29.74 | - | 无 | R-CHOP | 12 | CR |
| 15 [13] | 男 | 77 | 肾功能衰竭 | 肾脏 | MALTL | ⅣA | IgM-κ | 46.40 | 29.70 | 无 | 手术+ Clb | 32→40 | PR→死亡 |
| 16[14] | 女 | 35 | 不详 | 胃 | MALTL | ⅣB | IgM-λ | 11.20 | - | 无 | R-CHOP | 8→17 | CR |
| 17[15] | 男 | 64 | 皮肤紫癜 | 皮肤 | NMZL | ⅣA | IgM-κ | 50.74 | 5.44 | AIHA | 手术+BD | 3 | PD |
| 18[16] | 女 | 75 | 周围神经病 | 唾液腺 | MALTL | ⅣA | IgM-λ | 36.00 | 10.00 | RA、DM | R-CP | 6 | CR |
| 19 [17] | 女 | 56 | 肾功能不全 | 胸腺 | MALTL | ⅡA | IgM-κ | 0.12 | - | SS、CG | RD | 6 | CR |
| 20[18] | 男 | 59 | 发热 | 淋巴结 | NMZL | ⅣB | IgM-κ | 25.40 | - | AIHA | FCD | 2 | 死亡 |
| 21[18] | 女 | 77 | 乏力 | 淋巴结 | NMZL | ⅣA | IgM-κ | 32.50 | 16.25 | AIHA | R-CHOP | 2 | PR |
| 22[19] | 男 | 59 | 黑便 | 胃 | MALTL | ⅢA | IgM-κ | 53.00 | 0 | 无 | Clb | 3→53 | PR |
| 23[20] | 女 | 69 | 皮肤紫癜 | 皮肤 | MALTL | ⅡA | IgM-κ | - | - | CG、SV | Flu | 6 | CR |
| 24 [21] | 女 | 72 | 踝关节肿胀 | 脾脏 | SMZL | ⅣA | IgM-κ | 11.60 | 2.71 | 无 | R | 12 | CR |
| 25[22] | 女 | 82 | 咳嗽 | 肺 | MALTL | ⅣA | IgM-λ | 21.45 | - | 无 | 手术 | 10 | 存活 |
| 26[23] | 男 | 83 | 颈部左侧包块 | 颈部淋巴结 | NMZL | ⅣA | IgA-κ | 36.25 | - | 无 | CHOP | 48 | PR |
| 27[24] | 女 | 65 | 腹痛 | 小肠 | MALTL | Ⅰ A | IgM-κ | 0.48 | - | 无 | 保守治疗 | 10 | 死亡 |
| 28 [25] | 女 | 61 | 腹痛 | 腹腔淋巴结 | NMZL | ⅣA | IgM-κ | 7.33 | 3.90 | 无 | CHOP | 8 | PR |
| 29 [26] | 女 | 62 | 皮肤紫癜 | 腮腺 | MALTL | ⅣA | IgM-κ | 1.50 | 0 | SS | CHOP | 23 | CR |
| 30[26] | 女 | 37 | 周围神经病 | 淋巴结 | NMZL | ⅡB | IgM-κ | 3.20 | 0 | SS | CHOP | 15 | CR |
| 31[26] | 女 | 54 | 周围神经病 | 腮腺 | MALTL | ⅣB | IgM-κ | 4.00 | 0 | SS | CHOP | 10 | CR |
| 32[27] | 男 | 68 | 腹痛 | 胃 | MALTL | Ⅰ A | IgM-κ | 6.64 | - | 无 | Hp根除 | 12 | 存活 |
| 33[28] | 男 | 59 | 右下颌肿大 | 唾液腺 | MALTL | ⅣA | IgG-λ | 87.42 | 26.10 | 无 | COP+R | 17→72 | PR→死亡 |
| 34 [29] | 男 | 50 | 不详 | 鼻咽 | MALTL | Ⅰ A | IgM-κ | 88.00 | - | 无 | CVP | 11 | 存活 |
| 35[29] | 男 | 40 | 不详 | 眼附属器 | MALTL | ⅣA | IgM-κ | 66.00 | - | 无 | CP+Flu | 9 | 存活 |
| 36 [29] | 女 | 60 | 不详 | 腮腺 | MALTL | ⅣA | IgM-κ | 32.00 | - | SS、RA | CVP | 8 | 存活 |
| 37[29] | 女 | 61 | 不详 | 肺 | MALTL | ⅠA | IgM-κ | 45.00 | - | 无 | CVP+ Flu | 2 | 存活 |
| 38[29] | 男 | 74 | 不详 | 眼附属器 | MALTL | Ⅰ A | IgM-κ | 12.00 | - | 无 | 不详 | 不详 | 不详 |
| IgA-κ | 13.00 | ||||||||||||
| 39[29] | 男 | 79 | 不详 | 胃 | MALTL | ⅣA | IgM-κ | 51.00 | - | 无 | CAVP | 4 | 存活 |
注:MALTL:黏膜相关淋巴组织淋巴瘤;SMZL:脾边缘带淋巴瘤;NMZL:结内边缘带淋巴瘤;ITP:原发免疫性血小板减少症;CG:冷球蛋白血症;AIHA:自身免疫性溶血性贫血;RA:类风湿性关节炎;DM:皮肌炎;SS:干燥综合征;SV:系统性血管炎;CHOP:环磷酰胺+多柔比星+长春新碱+泼尼松;R:利妥昔单抗;Clb:苯丁酸氮芥;P:泼尼松;VAD:长春新碱+阿霉素+地塞米松;CAVP:环磷酰胺+阿霉素+长春新碱+泼尼松;BD:硼替佐米+地塞米松;CP:环磷酰胺+泼尼松;RD:利妥昔单抗+地塞米松;FCD:氟达拉滨+环磷酰胺+地塞米松;Flu:氟达拉滨;Hp:幽门螺杆菌;COP:环磷酰胺+长春新碱+泼尼松;CVP:环磷酰胺+长春新碱+泼尼松;PR:部分缓解;CR:完全缓解;PD:疾病进展;-:未测
39例患者中,男20例,女19例,中位年龄66(35~83)岁,其中>60岁者25例(64.1%)。NMZL 9例(23.1%),MALTL 28例(71.8%),脾MZL(splenic MZL, SMZL) 2例(5.1%);早期者9例(23.1%),晚期者30例(76.9%)。早、晚期患者性别、年龄差异均无统计学意义(P值均>0.05)。
39例患者中有29例有首发症状记录,其中10例(34.5%)表现为局部占位(眼附属器、唾液腺、结肠、胰腺、肾脏以及咽部、颈部、腹腔淋巴结)。19例(65.5%)表现为非占位性症状。
13例(33.3%)患者伴自身免疫现象,其中干燥综合征5例,自身免疫性溶血性贫血、冷球蛋白血症各3例,类风湿性关节炎2例,ITP、Evan's综合征、皮肌炎、系统性血管炎各1例;4例患者同时有2种自身免疫性疾病。自身免疫现象与M蛋白类型、McIg定量、临床分期、治疗有效率未发现相关性(P>0.05)。
9例NMZL患者中,原发淋巴结7例,唾液腺、皮肤各1例。28例MALTL患者中,11例(39.3%)原发于胃肠道,17例(60.7%)为非胃肠道。2例SMZL患者原发脾脏(表1)。
39例患者中,IgM型32例(82.0%),IgA型3例(7.7%),κ-轻链型2例(5.1%),IgM-κ和IgA-κ双克隆型、IgG-λ型各1例(2.6%)。McIgM型患者最多见,其血浆McIgM水平为0.12~ 88.00 g/L,平均(25.55±21.31)g/L;晚期患者血浆McIgM水平明显高于早期患者[(29.85±20.60)g/L对(3.23±2.95) g/L],差异有统计学意义(P=0.008)。
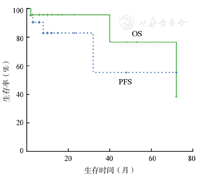
30例患者接受化疗,有明确疗效者25例。平均化疗4(2~8)个疗程,CR率56.0%(14/25),PR率36.0%(9/25),ORR 92.0%;中位随访10(2~72)个月,中位PFS、OS时间分别为32、72个月,3年PFS、OS率分别为44.7%、76.5%(图1)。其中含利妥昔单抗化疗组11例,ORR 100.0%(11/11),CR率63.6%(7/11);不含利妥昔单抗化疗组14例,ORR 78.6%(11/14),CR率50.0%(7/14);两组患者ORR、CR、PFS、OS率差异均无统计学意义(P值均>0.05)。此外幽门螺杆菌(helicobacter pylori, Hp)根除、手术、放疗各1例,至随访结束患者均存活;2例保守治疗随访7、10个月后死于淋巴瘤扩散。4例患者治疗不详。

有明确疗效的25例患者中21例为McIgM型,其ORR为95.2%(20/21),CR率为66.7%(14/21);4例非McIgM型患者中3例获PR;两组患者的CR率差异有统计学意义(P=0.026),ORR差异无统计学意义(P>0.05)。15例患者治疗后血浆McIgM水平较治疗前明显下降[(23.37±18.18) g/L对(8.20±9.76) g/L],差异有统计学意义(P=0.002)。
McIg(M蛋白)是淋巴细胞或浆细胞增殖性疾病的重要标志。临床上McIg- MZL极为少见。Economopoulos等[30]分析255例B-NHL患者资料,伴McIg分泌者比例为17.3%,以淋巴浆细胞淋巴瘤/华氏巨球蛋白血症(LPL/WM)、滤泡性淋巴瘤最常见,18例MZL患者均为阴性。Lin等[31]分析382例McIgM型淋巴瘤患者,MZL患者占7.1%。
本组资料表明,McIg-MZL好发于60岁以上老年人,男女无明显差异。MALTL最多见(71.8%),NMZL次之,SMZL少见。但McIg-MALTL,原发病灶以眼附属器、肺、唾液腺等非胃肠道更为多见(60.7%),胃肠道仅占39.3%,与不伴McIg的MALTL(胃肠道约占50.0%)略有不同。
研究发现伴McIg的B-NHL,IgG占50%,IgM占41%,IgA占9%;惰性淋巴瘤以IgM为主,侵袭性淋巴瘤则以IgG常见[30]。Wöhrer等[32]报道McIg- MALTL患者中IgM占63%,IgG占31%,IgA占5%。本组患者与Wöhrer报道类似,IgM最多见(82.0%),但略有差异,McIg类型更为丰富,IgA(7.7%)、κ-轻链型(5.1%),IgG和双克隆型(各2.6%)。
本组76.9%的患者诊断时处于晚期,且McIg水平较早期患者增高8.8倍,与Economopoulos等[30]和Asatiani等[33]报道一致,前者发现伴McIg的B-NHL患者诊断时77%达晚期,后者发现伴McIg的结外侵犯MZL患者均达Ⅳ期,而不伴McIg者仅42%达Ⅳ期,推测McIg水平高,疾病进展快、临床分期晚。
已有研究发现自身免疫疾病是淋巴瘤发生的危险因素,但伴自身免疫现象对淋巴瘤患者预后的影响研究较少,其对NHL分层和生存率的影响文献报道不一[34,35]。本组33.3%患者出现自身免疫现象,明显高于Wang等[36]报道的5.8%;但与McIg类型及疗效无关。Jacson等[37]报道248例唾液腺MALTL患者资料,自身免疫现象发生率高达41%。
最近有作者提出分泌McIg的淋巴瘤可能是淋巴瘤的一种特殊亚型。Cox等[1]研究分泌McIgM弥漫大B细胞淋巴瘤(DLBCL),发现其起源于分化成熟的活化B细胞,对R-CHOP方案治疗反应差,因而提出分泌McIgM为临床预后差的重要标志;与90%的LPL/WM患者、6.5%~17%非选择性DLBCL患者存在MYD88基因L265P突变不同,McIgM-DLBCL患者该突变为阴性,推测可能存在其他与McIgM相关的分子通路。Martinez-Lopez等[2]研究发现15%的SMZL患者存在MYD88基因L265P突变,并与McIgM分泌密切相关;但NMZL和MALTL患者均未发现该突变,因此MZL与MYD88基因L265P突变的相关性及其意义值得进一步研究。
分泌McIg对淋巴瘤治疗及预后的影响文献报告不一。Buske等[38]发现分泌McIgM与LPL患者的治疗反应无相关性;但在伴与不伴WM的LPL患者中,R- CHOP方案治疗者的ORR均明显优于CHOP方案治疗者。本组MZL患者多数应用CHOP±R方案,有较高的ORR(92.0%),含利妥昔单抗化疗组ORR及CR率优于不含利妥昔单抗化疗组(100.0%对78.6%,63.6%对50.0%),但差异无统计学意义。McIgM型MZL患者CR率明显高于非McIgM型,提示McIgM型患者对化疗反应较好;随着淋巴瘤的治疗McIg水平也随之下降。目前McIg-MZL多为个案报道,尚无针对其治疗的随机对照研究,多数仍然按照最新NCCN推荐的指南方案治疗,早期胃肠道MALTL患者的治疗,Hp阳性者首选根除Hp,阴性者首选放疗;非胃肠道者首选放疗或手术。晚期MALTL患者首选苯达莫司汀+ R/R-CHOP。SMZL患者选择切脾或利妥昔单抗治疗。对难治/复发患者,已有报道借鉴WM治疗,包含硼替佐米、氟达拉滨、来那度胺的方案能提高患者ORR、改善长期生存[39,40,41];年轻、早期复发、NMZL患者建议大剂量化疗+自体干细胞移植,部分患者能获得长期生存[42]。
综上,McIg-MZL在临床上并不常见,好发于老年人,以非胃肠道MALTL、McIgM型最多见,易伴发自身免疫现象,诊断时分期较晚,可能是MZL的一种独特亚型。患者接受含利妥昔单抗的治疗方案可能疗效会更好。相信随着分子生物学的深入研究及更多临床试验的开展,McIg-MZL的发病机制及有效的治疗手段也会获得进一步的发展。



























