
分析伴阵发性睡眠性血红蛋白尿症(PNH)克隆的再生障碍性贫血(AA)患者临床特点,以及PNH克隆大小演变对疗效和生存的影响。
回顾2011年1月至2014年9月间收治的316例诊断明确的AA患者临床资料,分析其临床特点及PNH克隆大小演变对疗效和生存的影响。
①316例AA患者中90例(28.5%)PNH克隆阳性,有随访资料的83例患者完全缓解(CR) 36例(43.4%),部分缓解(PR)28例(33.7%),有效率为77.1%。3年及5年总生存(OS)率分别为79.4%与76.1%。②24例免疫抑制治疗(IST)后PNH克隆转为阳性,PNH克隆持续阳性者22例,PNH克隆消失者10例,三组间有效率、OS率、网织红细胞(Ret)绝对值、总胆红素、间接胆红素、LDH差异均无统计学意义(P值均>0.05);共10例患者进展为AA-PNH综合征,中位进展时间15.6个月,有效率及OS率与其他46例患者比较差异无统计学意义(P值分别为0.896、0.688)。③单因素分析显示年龄≥55岁、合并感染、极重型AA(VSAA)、中性粒细胞绝对计数(ANC)<0.5×109/L、Ret绝对值<0.012×1012/L为影响患者OS的因素(P值分别为0.026、0.000、0.001、0.000及0.010);而多因素Cox回归模型分析显示年龄≥ 55岁[RR=2.871(95%CI 0.998~8.263),P=0.050]、合并感染[RR=2.165 (95%CI 0.064~0.712),P=0.012]及ANC <0.5×109/L [RR=4.902(95%CI 0.041~1.004),P=0.050]为影响患者OS的独立预后因素。单因素及多因素分析均未发现PNH克隆大小与疗效及长期生存的相关性。
PNH克隆的大小及其演变对患者疗效及长期生存无明显影响。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
再生障碍性贫血(AA)是以造血干细胞损伤、骨髓脂肪化、外周血全血细胞减少为特征,源于功能亢进的T淋巴细胞以造血系统为靶器官的自身免疫性疾病[1]。AA和阵发性睡眠性血红蛋白尿症(PNH)关系密切[2],有文献报道高达57%~70%的初诊AA患者伴发PNH克隆[3,4],AA患者免疫抑制治疗(IST)后亦常出现PNH克隆[5]。关于PNH克隆大小及演变对疗效及生存的影响目前尚无定论,我们回顾性分析90例伴PNH克隆的AA患者临床资料,探讨PNH克隆大小及其演变对IST疗效和生存的影响,现报告如下。
回顾性分析2011年1月至2014年9月我科收治的316例AA患者,AA诊断及严重程度分型参照文献[6]标准。
应用CellQuest软件,采用荧光标记的嗜水气单胞菌溶素变异体(Flaer),应用美国BD公司FACS Calibur流式细胞仪检测外周血红细胞、粒细胞。红细胞抗体包括:IgG1-FITC、IgG1-PE、CD235a-FITC、CD59-PE;粒细胞抗体包括:CD45-PerCP、CD33-APC、CD24-PE、Flaer。分析10 000个有核细胞,CD235a+CD59-细胞百分率为红细胞PNH克隆大小;分析5 000个有核细胞,Flaer-/CD24-细胞百分率为粒细胞PNH克隆大小。大于1%即为PNH克隆阳性,百分率越大表示PNH克隆越大。如起病时PNH克隆阳性,IST后出现酸溶血(Ham)试验阳性或临床及实验室相关的其他PNH溶血证据则诊断为AA-PNH综合征。
IST方案:兔抗人胸腺细胞球蛋白(r-ATG,法国Sangstat公司产品)3.55 mg·kg-1·d-1 × 5 d或猪抗人淋巴细胞球蛋白(p-ALG,武汉生物制品研究所产品)23.5 mg·kg-1·d-1 ×5 d联合环孢素(CsA) 3.0 mg·kg-1·d-1 ,根据CsA血药浓度调整用药。基础治疗:达那唑10.0 mg·kg-1·d-1或司坦唑醇0.2 mg·kg-1·d-1;叶酸0.25 mg·kg-1·d-1;维生素B12每次500 µg,每周1~3次。输注浓缩红细胞及单采血小板以维持患者HGB≥60 g/L及PLT≥10×109/L,存在感染或严重出血时维持PLT≥20×109/L。
随访终点为患者死亡或2015年3月30日,中位随访30(1~72)个月,随访方式包括电话随访、预约患者就诊等。90例患者中失访7例,余83例患者有完整随访资料。随访指标包括:血常规,骨髓形态学及相关检查(包括免疫分型、染色体核型、组织化学染色等),溶血相关检查:血浆游离血红蛋白(FHb)、结合珠蛋白(Hp)、Ham试验、尿Rous试验、总胆红素(TBIL)、间接胆红素(IBIL)、LDH、PNH克隆等,感染及血制品输注情况。总生存(OS)期定义为确诊至随访终点。3个月内死亡定义为早期死亡。
采用SPSS 16.0软件进行统计学分析,临床特点及疗效采用中位数(范围)表示,组间率或构成比的比较采用χ2检验,组间计数资料的比较采用非参数检验,生存分析采用Kaplan-Meier法及Log-rank检验,多因素分析采用Cox回归模型,P≤0.05为差异有统计学意义。
316例患者中,伴PNH克隆90例(28.5%),其中66例(73.3%)起病时即伴PNH克隆,24例(26.7%)IST后出现PNH克隆阳性。男47例,女43例,中位年龄28(3~74)岁,年龄≥18岁者65例(72.2%),<18岁者25例(27.8%)。85例行骨髓活检患者中,81例(95.3%)造血细胞面积<20%。非重型AA (NSAA)11例(12.2%),重型AA(SAA) 58例(64.5%),极重型AA(VSAA) 21例(23.3%)。51例(56.7%)以贫血症状起病,48例(53.3%)以出血症状起病。初诊伴发热及感染症状者21例(27.3%),其中肺感染11例,口腔感染4例,肛周感染、急性扁桃体炎各2例,皮肤感染、深部脏器感染各1例;合并蛛网膜囊肿、双侧股骨头坏死、脑梗死各1例;起病时伴尿色加深1例;既往合并法洛四联症1例。无一例患者出现血栓形成。
84例(93.3%)患者起病时表现为全血细胞减少,中位WBC 1.89(0.34~5.00)×109/L,中位中性粒细胞绝对计数(ANC)0.45 (0~2.79)× 109/L,中位HGB 61(33~123) g/L,中位PLT 10(1~101)×109/L,中位红细胞平均体积(MCV) 93.6(76.1~120.7) fl,中位网织红细胞(Ret)比例0.68%(0.03%~4.02%),中位Ret绝对值0.016 (0.001~0.217)× 1012/L;80例(88.9%)患者依赖血制品输注。
起病时所有患者FHb <50 mg/L、Hp >0.125 g/L,Ham试验均阴性,尿Rous试验亦均阴性。中位TBIL 13.0(5.7~92.0)µmol/L,中位IBIL 8.1(2.2~31.7)µmol/L,中位LDH 154(52~438) U/L。
随访期间,9例(10.0%)FHb>50 mg/L;6例(6.7%)Hp <0.125 g/L ;5例Ham试验(弱+),5例Ham试验(+);83例患者中位TBIL 9.6(7.7~87.9) µmol/L,中位IBIL 7.2(5.9~74.9)µmol/L,中位LDH 188(112~2 912) U/L;3例尿Rous试验(+)。
所有患者起病时均行染色体核型分析,除外2例患者未见分裂象,余可供分析的88例患者中,正常核型81例(92.0%),异常核型7例(8.0%):+X 2例(其中1例为+8+X),-Y 2例,-12、t (2;10)(q14;p15)、dup (1)(q11;q44)各1例。IST后,4例核型正常患者出现染色体核型异常,-7 2例,del(12)(p12)、inv(9)(p11q13)各1例。+8+X患者IST后改变为del(13)(q12;q14)。
可评价疗效的83例患者中,CR 36例(43.4%),PR 28例(33.7%),无效(NR)19例(22.9%)。有效率为77.1%。5例患者CR后复发,其中3例因感染复发,1例转为AA-PNH综合征,另1例进展为骨髓增生异常综合征(MDS)。83例患者3年OS率为79.4%,5年OS率为76.1%。16例患者死亡,其中脑出血3例、消化道出血5例、感染8例。早期死亡5例。
5例患者早期死亡,7例失访,22例未监测PNH克隆变化,其余56例患者监测PNH克隆变化:①IST后PNH克隆转为阳性者24例(42.9%),其中3例患者转阳后再次转阴,24例患者CR 14例、PR 8例、NR 2例,有效率为91.7%;6例患者于出现PNH克隆后起效。②PNH克隆持续阳性者22例(39.3%),CR 11例、PR 10例、NR 1例,有效率为95.5%;8例PNH克隆变大、4例变小、10例稳定。③IST后PNH克隆转阴者10例(17.9%),CR 8例、NR 2例,有效率为80.0%。三组患者Ret绝对值、TBIL、IBIL、LDH水平,有效率及OS率组间比较差异均无统计学意义(P值均>0.05)(表1)。
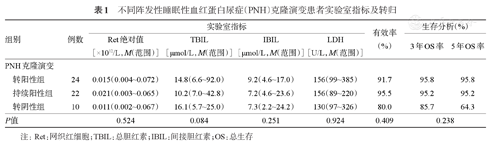
不同阵发性睡眠性血红蛋白尿症(PNH)克隆演变患者实验室指标及转归
不同阵发性睡眠性血红蛋白尿症(PNH)克隆演变患者实验室指标及转归
| 组别 | 例数 | 实验室指标 | 有效率(%) | 生存分析(%) | |||||
|---|---|---|---|---|---|---|---|---|---|
| Ret绝对值[×1012/L,M(范围)] | TBIL[μmol/L,M(范围)] | IBIL[μmol/L,M(范围)][ | LDHU/L,M(范围)] | 3年OS率 | 5年OS率 | ||||
| PNH克隆演变 | |||||||||
| 转阳性组 | 24 | 0.015(0.004~0.072) | 14.8(6.6~92.0) | 9.2(4.6~17.0) | 156(99~385) | 91.7 | 95.8 | 95.8 | |
| 持续阳性组 | 22 | 0.021(0.003~0.065) | 10.2(7.0~42.8) | 7.2(4.6~23.6) | 156(89~220) | 95.5 | 95.2 | 95.2 | |
| 转阴性组 | 10 | 0.011(0.002~0.067) | 16.1(5.7~25.0) | 7.3(2.2~24.2) | 130(97~326) | 80.0 | 85.7 | 64.3 | |
| P值 | 0.524 | 0.084 | 0.251 | 0.924 | 0.409 | 0.238 | |||
注:Ret:网织红细胞;TBIL:总胆红素;IBIL:间接胆红素;OS:总生存
共有10例(17.9%)患者转变为AA-PNH综合征,中位转变时间为15.6(3~36)个月,其中NSAA 2例,SAA 5例,VSAA 3例。起病时,10例患者Ham试验均阴性,无IBIL及LDH增高,4例PNH克隆阴性,6例PNH克隆阳性,其中2例粒细胞PNH克隆> 20%,其余4例红细胞、粒细胞PNH克隆均<10%;转为AA-PNH综合征后,10例患者Ham试验均阳性或弱阳性,所有患者均无血栓形成,2例患者伴间断酱油色尿,8例患者Ret绝对值>0.10×1012/L,2例胆红素水平增高,9例LDH增高,其中4例LDH大于1 000 U/L,9例粒细胞或红细胞PNH克隆>50% (表2)。10例转变为AA-PNH综合征患者IST有效率、OS率与46例未转变为AA-PNH综合征患者比较差异均无统计学意义(有效率:90.0%对91.3%,χ2=0.017,P=0.896; 3年OS率:90.0%对94.8%,5年OS率:90.0%对89.2%,P=0.688)。
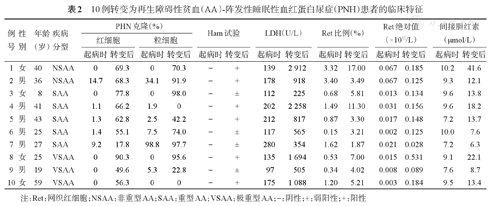
10例转变为再生障碍性贫血(AA)-阵发性睡眠性血红蛋白尿症(PNH)患者的临床特征
10例转变为再生障碍性贫血(AA)-阵发性睡眠性血红蛋白尿症(PNH)患者的临床特征
| 例号 | 性别 | 年龄(岁) | 疾病分型 | PHN克隆(%) | Ham试验 | LDH(U/L) | Ret比例(%) | Ret绝对值(×1012/L) | 间接胆红素(μmol/L) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 红细胞 | 粒细胞 | ||||||||||||||||
| 起病时 | 转变后 | 起病时 | 转变后 | 起病时 | 转变后 | 起病时 | 转变后 | 起病时 | 转变后 | 起病时 | 转变后 | 起病时 | 转变后 | ||||
| 1 | 女 | 40 | NSAA | 0 | 69.3 | 0 | 70.3 | - | + | 139 | 2 912 | 3.32 | 17.00 | 0.067 | 0.185 | 10.2 | 41.6 |
| 2 | 男 | 36 | NSAA | 14.7 | 68.3 | 34.1 | 91.9 | - | + | 178 | 918 | 3.40 | 3.49 | 0.067 | 0.125 | 9.3 | 12.1 |
| 3 | 女 | 8 | SAA | 0 | 77.8 | 0 | 98.0 | - | ± | 112 | 225 | 0.68 | 5.81 | 0.013 | 0.134 | 9.6 | 13.8 |
| 4 | 男 | 41 | SAA | 1.1 | 66.2 | 1.9 | 0 | - | + | 202 | 2 258 | 1.49 | 11.30 | 0.031 | 0.156 | 9.6 | 18.2 |
| 5 | 男 | 43 | SAA | 1.3 | 62.8 | 2.5 | 42.2 | - | + | 212 | 817 | 0.87 | 3.30 | 0.017 | 0.148 | 7.2 | 13.7 |
| 6 | 男 | 25 | SAA | 1.4 | 55.1 | 7.5 | 74.0 | - | ± | 117 | 565 | 0.15 | 3.21 | 0.002 | 0.125 | 10.0 | 7.6 |
| 7 | 男 | 27 | SAA | 9.2 | 17.8 | 98.8 | 97.7 | - | ± | 280 | 354 | 1.62 | 1.87 | 0.021 | 0.028 | 7.2 | 6.3 |
| 8 | 女 | 25 | VSAA | 0 | 90.3 | 0 | 95.6 | - | + | 135 | 1 694 | 0.53 | 7.00 | 0.015 | 0.531 | 9.1 | 22.1 |
| 9 | 男 | 19 | VSAA | 0 | 49.6 | 5.3 | 22.8 | - | ± | 97 | 505 | 0.34 | 4.02 | 0.008 | 0.089 | 7.6 | 8.7 |
| 10 | 女 | 59 | VSAA | 0 | 56.3 | 0 | 0 | - | + | 175 | 1 088 | 1.20 | 5.21 | 0.003 | 0.184 | 9.5 | 13.4 |
注:Ret:网织红细胞;NSAA:非重型AA;SAA:重型AA; VSAA:极重型AA;-:阴性;±:弱阳性;+:阳性
起病时PNH克隆阳性的66例患者中59例有完整随访资料,其中42例(71.2%)PNH克隆<10%,6例(10.2%)PNH克隆10%~<20%,6例(10.2%)PNH克隆20%~50%,5例(8.2%)PNH克隆>50%(均为粒细胞)。24例(40.7%)患者粒细胞及红细胞PNH克隆均阳性,其中19例(79.2%)粒细胞PNH克隆>红细胞。59例患者红细胞PNH克隆中位数为1.86% (0.22%~15.49%),粒细胞PNH克隆中位数为3.60%(0.22%~98.79%),组间比较差异有统计学意义(P=0.009)。
PNH克隆大小以20%为界,组间比较性别、年龄、Ret绝对值、TBIL、IBIL、LDH及CD4+细胞比例、CD8+细胞比例、CD4+/CD8+细胞比值、疗效等差异均无统计学意义(P值均>0.05)(表3)。
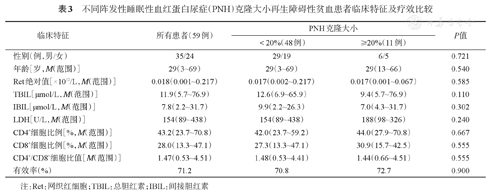
不同阵发性睡眠性血红蛋白尿症(PNH)克隆大小再生障碍性贫血患者临床特征及疗效比较
不同阵发性睡眠性血红蛋白尿症(PNH)克隆大小再生障碍性贫血患者临床特征及疗效比较
| 临床特征 | 所有患者(59例) | PNH克隆大小 | P值 | |
|---|---|---|---|---|
| <20%(48例) | ≥20%(11例) | |||
| 性别(例,男/女) | 35/24 | 29/19 | 6/5 | 0.721 |
| 年龄[岁,M(范围)] | 29(3~69) | 29(3~69) | 29(13~66) | 0.540 |
| Ret绝对值[×1012/L,M(范围)] | 0.018(0.001~0.217) | 0.017(0.002~0.217) | 0.017(0.001~0.067) | 0.585 |
| TBIL[μmol/L,M(范围)] | 11.9(5.7~76.9) | 12.6(6.9~65.9) | 9.4(5.7~76.9) | 0.110 |
| IBIL[μmol/L,M(范围)] | 7.8(2.2~31.7) | 9.9(2.2~26.3) | 7.0(4.3~31.7) | 0.302 |
| LDH[U/L,M(范围)] | 154(89~438) | 154(89~438) | 188(98~326) | 0.240 |
| CD4+细胞比例[%,M(范围)] | 43.2(23.7~70.8) | 42.0(23.7~59.2) | 44.0(27.9~70.8) | 0.667 |
| CD8+细胞比例[%,M(范围)] | 28.0(13.3~47.1) | 27.3(13.3~47.1) | 30.9(15.7~42.5) | 0.555 |
| CD4+/CD8+细胞比值[M(范围)] | 1.47(0.53~4.51) | 1.48(0.53~4.41) | 1.44(0.66~4.51) | 0.555 |
| 有效率(%) | 71.2 | 70.8 | 72.7 | 0.900 |
注:Ret:网织红细胞;TBIL:总胆红素;IBIL:间接胆红素
分别分析有随访资料的59例患者临床特征、实验室检查指标等16种因素对疗效及生存的影响,结果见表4,年龄≥55岁、合并感染、VSAA、ANC <0.5 × 10 9/L、Ret绝对计数< 0.012×1012/L、MCV <100 fl、诊断到治疗间隔时间≥ 6个月是影响疗效的危险因素( P值均<0.05);年龄≥55岁、合并感染、VSAA、ANC <0.5×109/L、Ret绝对计数<0.012×1012/L为影响患者生存的危险因素(P值均<0.05)。PNH克隆大小并非患者长期生存的影响因素(P=0.650)。进一步行Cox回归多因素分析,结果显示年龄≥55岁[RR=2.871 (95%CI 0.998~8.263),P=0.050]、合并感染[RR=2.165 (95% CI 0.064~0.712),P=0.012]及ANC <0.5×10 9/L [RR= 4.902 (95%CI 0.041~1.004),P=0.050]为影响OS的独立预后因素。
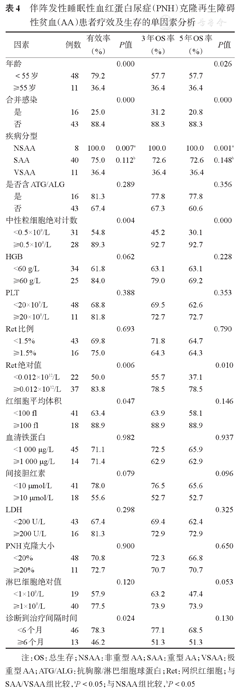
伴阵发性睡眠性血红蛋白尿症(PNH)克隆再生障碍性贫血(AA)患者疗效及生存的单因素分析
伴阵发性睡眠性血红蛋白尿症(PNH)克隆再生障碍性贫血(AA)患者疗效及生存的单因素分析
| 因素 | 例数 | 有效率(%) | P值 | 3年OS率(%) | 5年OS率(%) | P值 | |
|---|---|---|---|---|---|---|---|
| 年龄 | 0.000 | 0.026 | |||||
| <55岁 | 48 | 79.2 | 57.7 | 57.7 | |||
| ≥55岁 | 11 | 36.4 | 36.4 | 36.4 | |||
| 合并感染 | 0.000 | 0.000 | |||||
| 是 | 16 | 25.0 | 31.2 | 20.8 | |||
| 否 | 43 | 88.4 | 88.3 | 88.3 | |||
| 疾病分型 | |||||||
| NSAA | 8 | 100.0 | 0.007a | 100.0 | 100.0 | 0.001a | |
| SAA | 40 | 75.0 | 0.112b | 72.6 | 72.6 | 0.148b | |
| VSAA | 11 | 36.4 | 36.4 | 36.4 | |||
| 是否含ATG/ALG | 0.289 | 0.356 | |||||
| 是 | 16 | 81.3 | 77.8 | 77.8 | |||
| 否 | 43 | 67.4 | 67.3 | 60.6 | |||
| 中性粒细胞绝对计数 | 0.004 | 0.000 | |||||
| <0.5×109/L | 31 | 54.8 | 45.2 | 30.1 | |||
| ≥0.5×109/L | 28 | 89.3 | 92.7 | 92.7 | |||
| HGB | 0.062 | 0.228 | |||||
| <60 g/L | 34 | 61.8 | 63.1 | 63.1 | |||
| ≥60 g/L | 25 | 84.0 | 79.0 | 69.2 | |||
| PLT | 0.388 | 0.353 | |||||
| <20×109/L | 48 | 68.8 | 69.5 | 62.6 | |||
| ≥20×109/L | 11 | 81.8 | 72.7 | 72.7 | |||
| Ret比例 | 0.693 | 0.790 | |||||
| <1.5% | 43 | 69.8 | 71.8 | 64.7 | |||
| ≥1.5% | 16 | 75.0 | 64.3 | 64.3 | |||
| Ret绝对值 | 0.006 | 0.010 | |||||
| <0.012×1012/L | 22 | 50.0 | 55.7 | 37.1 | |||
| ≥0.012×1012/L | 37 | 83.8 | 78.5 | 78.5 | |||
| 红细胞平均体积 | 0.047 | 0.146 | |||||
| <100 fl | 41 | 63.4 | 63.9 | 58.1 | |||
| ≥100 fl | 18 | 88.9 | 88.9 | 88.9 | |||
| 血清铁蛋白 | 0.982 | 0.937 | |||||
| <1 000 μg/L | 45 | 71.1 | 72.5 | 65.9 | |||
| ≥1 000 μg/L | 14 | 71.4 | 62.9 | 62.9 | |||
| 间接胆红素 | 0.079 | 0.096 | |||||
| <10 μmol/L | 41 | 78.0 | 76.5 | 65.6 | |||
| ≥10 μmol/L | 18 | 55.6 | 52.7 | 52.7 | |||
| LDH | 0.298 | 0.325 | |||||
| <200 U/L | 43 | 67.4 | 69.4 | 62.4 | |||
| ≥200 U/L | 16 | 81.3 | 72.9 | 72.9 | |||
| PNH克隆大小 | 0.900 | 0.650 | |||||
| <20% | 48 | 70.8 | 72.3 | 66.8 | |||
| ≥20% | 11 | 72.7 | 70.7 | 70.7 | |||
| 淋巴细胞绝对值 | 0.120 | 0.053 | |||||
| <1×109/L | 19 | 57.9 | 63.2 | 47.4 | |||
| ≥1×109/L | 40 | 77.5 | 73.9 | 73.9 | |||
| 诊断到治疗间隔时间 | 0.024 | 0.130 | |||||
| <6个月 | 46 | 78.3 | 77.1 | 68.5 | |||
| ≥6个月 | 13 | 46.2 | 51.3 | 51.3 | |||
注:OS:总生存;NSAA:非重型AA;SAA:重型AA; VSAA:极重型AA;ATG/ALG:抗胸腺/淋巴细胞球蛋白;Ret:网织红细胞;与SAA/VSAA组比较,aP<0.05;与NSAA组比较,bP <0.05
PNH是一种后天获得性溶血性疾病,其源于造血干细胞X染色体上的PIG-A基因突变诱发一组糖基磷脂酰肌醇锚连膜蛋白(GPI-AP)缺失,导致细胞功能异常,临床上典型三联征为溶血性贫血、骨髓衰竭与血栓形成。目前发现多种疾患如AA、MDS、骨髓增殖性肿瘤及淋巴细胞增殖性疾病均可伴PNH克隆。PNH克隆可能是由于免疫系统的选择压力所致,但确切机制目前尚未完全明确[9]。
我们同期收治的316例AA患者中,90例(28.5%)伴PNH克隆,低于Raza等[10]报道的39.5%及Kulagin等[11]报道的59.2%。Maciejewski等[12]报道PNH克隆阳性的AA患者IST疗效较好,随后系列研究显示PNH克隆阳性的AA患者无论血液学反应率还是无病生存率均明显优于PNH克隆阴性者[11,13,14]。然而,日本学者Yoshida等[15]回顾性分析103例患儿,PNH克隆阳性与阴性组的血液学反应率分别为68.2%和53.1%,差异无统计学意义(P= 0.36),NIH的大系列回顾性分析亦显示PNH克隆阳性组与阴性组疗效相当(P>0.05)[16]。Timeus等[17]甚至得出相反的观点,PNH克隆阳性组与阴性组总体生存率差异无统计学意义,但PNH克隆阳性组的血液学反应率差于PNH克隆阴性组(P=0.02)。本研究结果显示,PNH克隆大小并不影响AA患者的有效率及OS率。
Timeus等[18]总结85例伴PNH克隆阳性的AA患者,未发现LDH与PNH克隆大小的关系。本组66例初诊PNH克隆阳性患者克隆大小与性别、年龄、Ret绝对值、TBIL、IBIL、LDH及CD4+细胞、CD8+细胞、CD4+/CD8+细胞比值、疗效等差异均无统计学意义(P值均>0.05)。Pu等[19]总结27例AA伴PNH克隆阳性的患者发现小克隆(PNH克隆≤10%)患者转变为PNH的可能性小,本组研究显示10例演变成AA-PNH前仅有1例患者红细胞PNH克隆大于10%,仅2例粒细胞PNH克隆大于10%,说明初诊患者转变为AA-PNH前PNH多为小克隆。同时我们分析发现起病时PNH克隆阴性的24例患者中,6例于出现PNH克隆后起效,提示PNH克隆的出现可能有助于患者血液学恢复,但尚需进一步扩大病例数明确。明确AA和PNH的关系可能有助于早期识别、诊断、治疗这些隐藏于AA中的PNH患者。目前越来越多的学者倾向于除了AA,其他包括MDS、原因不明的全血细胞减少、Coombs试验阴性的溶血性贫血,以及一些伴有特殊特征的血栓等均应行PNH克隆检查[20]。
本组患者PNH克隆演变过程结果与Timeus等[18]及我们既往报道[21]较为一致,无论治疗过程中PNH由阴性转为阳性或持续阳性以及PNH克隆消失者,三组间有效率及3年、5年OS率方面差异均无统计学意义,说明PNH克隆的稳定、消失或扩张等动态变化与疗效及生存无关。Chen等[22]总结102例AA患者,PNH克隆阳性者占7.8%,单因素及多因素分析均未发现PNH克隆大小对生存有明显影响。我们通过单因素分析有随访资料的59例初诊时PNH克隆阳性患者,发现年龄≥55岁、合并感染、VSAA、ANC <0.5×10 9/L、Ret绝对值<0.012×1012/L为影响患者长期生存的高危因素(P值分别为0.026、0.000、0.001、0.000及0.010);而多因素Cox回归模型分析发现年龄、感染及ANC为显著影响OS的独立预后因素(P值分别为0.050、0.012、0.050),亦未发现PNH克隆大小对生存的明显影响,与上述报道结果一致。
总之,AA患者常伴PNH克隆,但PNH克隆大小及演变对IST疗效及OS影响不大。



























