
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多发性骨髓瘤(multiple myeloma, MM)常伴溶骨性损害、高钙血症、贫血、肾脏损害等,其异质性很强,不同患者预后不同,生存期短至数月或长达数年[1,2]。资料显示有9.6%~19.6%的MM患者在初诊时即存在髓外浆细胞瘤(extramedullary plasmacytoma,EMP),病程中有6%~20%患者可发生EMP。近年来EMP的发生率明显增加,已经成为影响MM患者生存的重要不良预后因素[3,4]。循环浆细胞(circulating plasma cell, cPC)的检测及其预后意义在MM患者中已有报道[5,6],但在伴EMP的MM患者中的检测及其临床意义尚未见报道。伴有髓外病变的MM患者外周血是否可检测到cPC,无髓外病变的MM检测到cPC是否易进展为EMP?为了解决这个临床问题,我们建立了在MM患者中检测cPC的方法。
选取2014年10月至2015年4月就诊于北京大学第三医院和北京朝阳医院的MM患者21例,诊断参照文献[7]标准。患者在治疗前或发现EMP后取外周血和骨髓进行常规检查。
采集患者外周血8~10 ml和骨髓2~3 ml(EDTA抗凝),采用密度梯度法,2 700 r/min(离心半径9 cm)离心10 min,取白细胞层,常规溶解红细胞后用PBS洗涤1~2次,并过30 μm尼龙膜以获取MNC悬液。
磁珠分选仪及CD138阳性筛选磁珠均为德国美天旎公司产品。将MNC与CD138阳性筛选磁珠溶液以1×106个细胞加入1 μl的比例混匀,按照说明书进行操作,收集CD138-和CD138+细胞。
分别取每例患者骨髓及分选后的外周血MNC 1×106个细胞进行标记,所用抗体CD38-APC、CD138-PE、CD81-PE-Cy7、CD45-PacBlue、CD19-Percp-Cy5.5、CD56-mCherry-PE-ef610、CD117-AmCyan、CD3-FITC、Zombie-APC-Cy7和流式细胞仪均为美国BD公司产品。通过CD45/SSC、CD38/SSC联合设门圈定待检测细胞群,以患者初诊时肿瘤细胞的免疫表型判定外周血中的异常浆细胞(肿瘤细胞)(图1)。
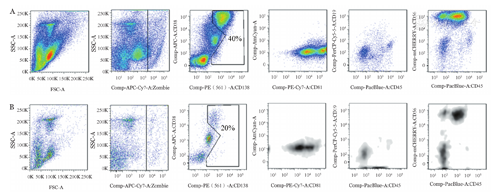

A:患者骨髓细胞;B:磁珠分选后的患者外周血细胞
应用SPSS18.0软件进行统计学分析,以χ2检验行独立性检验比较不同组检测结果的差异,结果均为双侧,P<0.05为差异有统计学意义。
21例患者中,男12例,女9例,男女比例为1.33∶1,其中IgG κ型11例,IgG λ型4例,IgA κ型3例,IgA λ型2例,λ轻链型1例。Durie-Salmon(DS)分期ⅢA期16例,ⅢB期5例。骨髓细胞形态学及流式细胞术检查均显示患者有MMC或异常浆细胞。
患者临床表现多种多样,包括贫血、高钙血症、红细胞沉降率增快(男性>15 mm/1 h,女性>20 mm/1 h)、β2微球蛋白(β2-MG)增高(>1.8 mg/L)、C反应蛋白(CRP)增高(>8 mg/L)、LDH增高(>245 U/L)和血浆白蛋白降低(<40 g/L)等。本组患者最常见的为β2-MG增高(90.4%,19/21)、贫血(80.9%,17/21)、红细胞沉降率增快(76.2%,16/21)和血浆白蛋白降低(66.7%,14/21)(表1)。
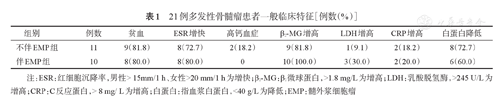
21例多发性骨髓瘤患者一般临床特征[例数(%)]
21例多发性骨髓瘤患者一般临床特征[例数(%)]
| 组别 | 例数 | 贫血 | ESR增快 | 高钙血症 | β2-MG增高 | LDH增高 | CRP增高 | 白蛋白降低 |
|---|---|---|---|---|---|---|---|---|
| 不伴EMP组 | 11 | 9(81.8) | 8(72.7) | 2(18.2) | 9(81.8) | 1(9.1) | 2(18.2) | 8(72.7) |
| 伴EMP组 | 10 | 8(80.0) | 8(80.0) | 0 | 10(100.0) | 3(30.0) | 2(20.0) | 6(60.0) |
注:ESR:红细胞沉降率,男性> 15mm/1 h、女性>20 mm/1 h为增快;β2-MG:β2微球蛋白,>1.8 mg/L为增高;LDH:乳酸脱氢酶,>245 U/L为增高;CRP:C反应蛋白,> 8 mg/L为增高;白蛋白:指血浆白蛋白,<40 g/L为降低;EMP:髓外浆细胞瘤
21例患者中10例伴EMP,其中2例患者首诊即发现EMP,其余8例患者在首诊后6个月至8年陆续发现EMP。EMP的发病部位包括头部、颌下、胸壁、肋旁、腰骶部软组织及椎体部位。除1例患者外,余均有骨侵犯。
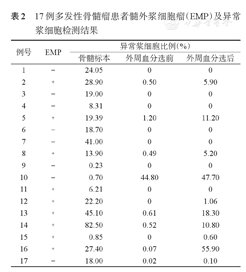
21例患者中17例患者的外周血及骨髓标本可进行MFC检测,其中EMP阴性者8例,EMP阳性者9例。17例患者的骨髓均检测到CD45- CD56+CD38+CD138+肿瘤细胞。对于CD138磁珠分选后的外周血,EMP阴性的8例患者中cPC阴性者6例(75.0%),cPC阳性者2例(25.0%);EMP阳性的9例患者中cPC阳性者8例(88.9%),cPC阴性者1例(11.1%)(表2),卡方分析显示,组间差异有统计学意义(χ2=7.137,P=0.008)。
17例多发性骨髓瘤患者髓外浆细胞瘤(EMP)及异常浆细胞检测结果
17例多发性骨髓瘤患者髓外浆细胞瘤(EMP)及异常浆细胞检测结果
| 例号 | EMP | 异常浆细胞比例(%) | ||
|---|---|---|---|---|
| 骨髓标本 | 外周血分选前 | 外周血分选后 | ||
| 1 | - | 24.05 | 0 | 0 |
| 2 | ﹢ | 28.90 | 0.50 | 5.90 |
| 3 | - | 19.00 | 0 | 0 |
| 4 | - | 8.31 | 0 | 0 |
| 5 | ﹢ | 19.39 | 1.20 | 11.20 |
| 6 | - | 18.70 | 0 | 0 |
| 7 | - | 41.00 | 0 | 0 |
| 8 | ﹢ | 13.90 | 0.49 | 5.20 |
| 9 | - | 0.23 | 0 | 0 |
| 10 | - | 0.70 | 44.80 | 47.70 |
| 11 | ﹢ | 6.21 | 0 | 0 |
| 12 | ﹢ | 22.20 | 0 | 1.06 |
| 13 | ﹢ | 45.10 | 0.61 | 18.30 |
| 14 | ﹢ | 82.50 | 0.52 | 10.80 |
| 15 | ﹢ | 0.85 | 0 | 0.60 |
| 16 | ﹢ | 27.40 | 0.07 | 55.90 |
| 17 | - | 18.00 | 0.02 | 0.10 |
在临床工作中,MFC已经广泛应用于MM的诊断和微小残留病监测,通过多种标记,MFC在意义未明的单克隆丙种球蛋白血症(MGUS)、MM和反应性增生的鉴别诊断,以及预后评估、治疗后微小残留病监测、疗效评估中均具有重要意义。目前六色流式细胞术(CD138/CD38/CD45/CD19/胞质Igκ/胞质Igλ)可以增加检出的敏感性,减少样本量。和正常浆细胞(N-PC)比较,MMC表达许多异常的标志,采用多种免疫标志将两者区分开来非常必要[8,9]。用来区分二者的标志包括CD19、CD56、CD20、CD117、CD28、CD33、CD27、CD81、CD31、CD39、CD40和CD44[10]。欧洲骨髓瘤网络(The European Myeloma Network, EMN)推荐的MMC鉴定标志为CD38、CD138、CD45、CD19和CD56,首先用CD38、CD138、CD45和SSC设门。与N-PC不同,MMC通常不表达CD19和CD27,低表达CD45,异常表达CD56、CD28、CD81和CD200,在少数患者中CD20和CD117也可表达增加。因为这些抗原并非浆细胞所特有,在数量较少时可能不能准确地鉴定出浆细胞,因此可以用浆细胞特有的免疫球蛋白来鉴定,如Igκ/Igλ。
CD138是浆细胞的特异性标志,表达于正常和恶性的浆细胞表面,另外一个比较重要的标志是CD38,这是一个非特异性标志,主要通过表达强度来区分浆细胞的良、恶性,N-PC较恶性浆细胞表达更强。恶性浆细胞的一个重要标志为CD45,除了这些抗原,还需要加入一些新的抗原来鉴定浆细胞的良、恶性。在外周血循环中也可以发现一些免疫表型与骨髓恶性浆细胞相同的循环恶性浆细胞(多数CD56-)。MMC和N-PC可以通过表达CD19、CD56、CD44剪切变异体、CD27、CD28、CD33和CD17来区分。最近的一项研究表明,缺乏CD19和CD27可以用来鉴别MMC和N-PC[11]。在本研究中我们选取了CD38、CD138、CD81、CD45、CD19、CD56、CD117、CD3和Zombie用于鉴定MM伴或不伴EMP患者骨髓和外周血中的恶性浆细胞,提示通过外周血MFC的检测,可以协助临床医师判断患者是否有髓外转移。
cPC是MM患者的一个重要预后评估因素。Vagnoni等[5]通过流式细胞术检测104例MM患者的CD38+CD45-cPC,结果提示cPC阳性在标危细胞遗传学组可以作为预后不良因素。Gonsalves等[6]采用MFC对647例治疗后MM患者进行外周血克隆性cPC检测,其中145例患者疾病处于活动期,502例患者疾病处于平台期(完全缓解者68例,疾病稳定者434例),前者的检出率明显高于后者(P< 0.001),获得完全缓解的患者均未检出。疾病处于平台期的患者中,克隆性cPC检出阳性者与阴性者比较生存期缩短(22个月对未达到,P=0.004)。但是目前并无资料分析MM伴EMP患者外周血cPC在髓外转移中的意义,因此我们对17例伴或不伴EMP的MM患者进行了外周血cPC检测。通过CD45/SSC、CD38/SSC联合设门圈定待检测细胞群,以患者初诊时肿瘤细胞的免疫表型判定外周血中的异常浆细胞(肿瘤细胞),结果显示伴EMP的MM患者组cPC阳性率明显高于不伴EMP组(88.9%对25.0%,P=0.008),对患者是否有髓外转移具有重要的提示作用。多个研究组均通过二代测序技术发现在MM患者的外周血中存在循环MMC,这些MMC可能是疾病由骨髓扩散至其他部位的起源[12,13],同时二代测序分析结果也显示,MM患者的肿瘤细胞存在异质性和克隆衍化[14,15,16],因此我们推测在MM患者出现髓外转移前,可能有部分亚克隆MMC会通过某些生物学性状的改变转移至外周血中,进一步归巢于某些器官和组织,形成髓外病变。这一假说需要进一步的基础及临床研究来证实。


























