
分析急性巨核细胞白血病(AMKL)患者实验室检查特点。
采集22例AMKL患者骨髓,分离有核细胞,一部分用于制备普通透射电镜标本,观察AMKL患者巨核细胞的形态结构;另一部分用于制备血小板过氧化物酶(PPO)细胞组化电镜标本,分析AMKL患者巨核细胞PPO阳性反应。同时结合分析患者骨髓细胞形态学、细胞化学和染色体核型等检查结果。
22例患者中,17例患者骨髓巨核细胞以Ⅰ期巨核细胞为主,核圆,胞质含少量微管、膜性囊腔及微小致密颗粒,无分界膜和表面连接管道系统等特征性结构,致密颗粒和α颗粒少;5例患者骨髓巨核细胞大小不等,除Ⅰ期巨核细胞外,同时含有大量Ⅱ、Ⅲ期巨核细胞。22例患者巨核细胞PPO阳性率0~80%。22例患者骨髓涂片中均可见原始和幼稚巨核细胞,CD41免疫组化染色呈阳性反应。复杂染色体核型异常多见。
大部分AMKL患者骨髓巨核细胞以Ⅰ期巨核细胞为主,少数患者除Ⅰ期巨核细胞外还伴有大量Ⅱ、Ⅲ期巨核细胞;PPO阳性反应差别明显;巨核细胞CD41免疫组化染色具有特异性;染色体核型复杂。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性巨核细胞白血病(acute megakaryoblastic leukemia, AMKL)于1931年首先由von Boros等[1]描述,但由于发病率低,部分患者骨髓白血病细胞少,光镜下白血病巨核细胞形态特征不典型,临床诊断存在一定困难。20世纪50~80年代随着透射电镜对巨核细胞超微结构的观察和血小板过氧化物酶(Platelet peroxidase,PPO)检测的应用,AMKL的临床诊断率有所提高;90年代以后随着CD41、CD42等血小板特异性抗体的运用,AMKL的诊断准确率得到进一步提高[2]。我们结合骨髓细胞形态学、细胞化学和细胞遗传学检查对22例AMKL患者的骨髓巨核细胞超微结构和PPO表达等实验室检查特点进行回顾性分析,以期提高对该病的认识。
2009年1月至2014年10月在本院就诊的22例AMKL患者纳入研究,其中男16例,女6例,男女比为2.67∶1;中位年龄2(1~65)岁;所有患者根据2008年WHO急性髓系白血病分型标准[3]确诊为AMKL。22例患者中20例为原发性巨核细胞白血病,1例继发于骨髓增生异常综合征,1例继发于骨髓纤维化(表1)。
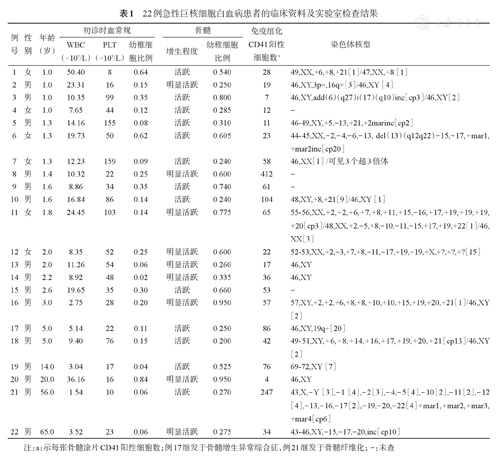
22例急性巨核细胞白血病患者的临床资料及实验室检查结果
22例急性巨核细胞白血病患者的临床资料及实验室检查结果
| 例号 | 性别 | 年龄(岁) | 初诊时血常规 | 骨髓 | 免疫组化CD41阳性细胞数a | 染色体核型 | |||
|---|---|---|---|---|---|---|---|---|---|
| WBC(×109/L) | PLT(×109/L) | 幼稚细胞比例 | 增生程度 | 幼稚细胞比例 | |||||
| 1 | 女 | 1.0 | 50.40 | 8 | 0.64 | 活跃 | 0.540 | 28 | 49,XX,+6,+8,+21[1]/47,XX,+8[1] |
| 2 | 男 | 1.0 | 23.31 | 16 | 0.15 | 明显活跃 | 0.250 | 19 | 46,XY,3p-,16q+[3]/46,XY[4] |
| 3 | 男 | 1.0 | 10.35 | 99 | 0.35 | 活跃 | 0.800 | 7 | 46,XY,add(6)(q27)i(17)(q10)inc[cp3]/46,XY[2] |
| 4 | 女 | 1.0 | 7.65 | 44 | 0.12 | 活跃 | 0.285 | 12 | - |
| 5 | 男 | 1.3 | 14.16 | 155 | 0.08 | 活跃 | 0.310 | 11 | 46-49,XY,+5,-13,+21,+2marinc[cp2] |
| 6 | 女 | 1.3 | 19.73 | 50 | 0.62 | 活跃 | 0.605 | 23 | 44-45,XX,-2,-4,-6,-13, del(13)(q12q22)-15,-17,+mar1,+mar2inc[cp20] |
| 7 | 女 | 1.3 | 12.23 | 159 | 0.09 | 活跃 | 0.240 | 58 | 46,XX[1]/可见3个超3倍体 |
| 8 | 男 | 1.4 | 10.32 | 22 | 0.25 | 明显活跃 | 0.600 | 412 | - |
| 9 | 男 | 1.6 | 8.86 | 34 | 0.35 | 活跃 | 0.740 | 61 | - |
| 10 | 男 | 1.6 | 16.84 | 86 | 0.14 | 活跃 | 0.240 | 104 | 48,XY,+8,+21[9]/46,XY[1] |
| 11 | 女 | 1.8 | 24.45 | 103 | 0.14 | 明显活跃 | 0.775 | 65 | 55-56,XX,+2,+2,+6,+7,+8,+11,+15,-16,+17,+19,+19,+19,+20[cp3]/48,XX,+2,-5,+8,-10,-11,-15,+17,+19,+22[1]/46,XX[3] |
| 12 | 女 | 2.0 | 8.35 | 52 | 0.25 | 明显活跃 | 0.600 | 22 | 52-53,XX,+2,-3,+7,+8,-11,-17,+19,+19,+X,+?,+?,+?[15] |
| 13 | 男 | 2.0 | 11.26 | 54 | 0.06 | 明显活跃 | 0.260 | 17 | 46,XY |
| 14 | 男 | 2.2 | 8.92 | 48 | 0.02 | 明显活跃 | 0.335 | 36 | 46,XY |
| 15 | 男 | 2.6 | 19.65 | 35 | 0.30 | 活跃 | 0.660 | 53 | - |
| 16 | 男 | 3.0 | 2.75 | 28 | 0.20 | 明显活跃 | 0.950 | 57 | 57,XY,+2,+2,+6,+8,+8,+10,+10,+15,+19,+20,+21[1]/46,XY [2] |
| 17 | 男 | 5.0 | 5.14 | 22 | 0.11 | 活跃 | 0.250 | 86 | 46,XY,19q+[20] |
| 18 | 男 | 5.0 | 9.40 | 76 | 0.15 | 活跃 | 0.200 | 42 | 49-51,XY,+6,+8,+14,+16,+17,+19,+20,+21[cp13]/46,XY [2] |
| 19 | 男 | 14.0 | 3.04 | 17 | 0.04 | 活跃 | 0.525 | 76 | 69-72,XY[7] |
| 20 | 男 | 20.0 | 36.16 | 16 | 0.84 | 明显活跃 | 0.950 | 4 | 46,XY |
| 21 | 男 | 56.0 | 1.54 | 10 | 0.06 | 活跃 | 0.270 | 247 | 43,X,-Y[3],-1[4],-2[3],-4,-5[4],-10[2],-11[2],-12[4],- 13,- 16,- 17[2],- 19,- 20,- 22[4]+ mar1, + mar2, + mar3,+mar4[cp6] |
| 22 | 男 | 65.0 | 3.52 | 23 | 0.06 | 明显活跃 | 0.275 | 34 | 43-46,XY,-15,-17,-20,inc[cp10] |
注:a:示每张骨髓涂片CD41阳性细胞数;例17继发于骨髓增生异常综合征,例21继发于骨髓纤维化;-:未查
取骨髓液3~5 ml,肝素抗凝,用细胞分离液分离有核细胞,部分细胞用25 g/L戊二醛固定以备制作普通透射电镜标本,剩余细胞按照电镜细胞化学方法行PPO染色;按电镜标本制备流程分别对两组标本进行锇酸后固定、脱水、浸透、包埋和切片,切片厚度60 nm。普通透射电镜超薄切片用醋酸铀溶液和铅染液染色,细胞化学切片不染色[4],日立H-600透射电镜观察。
先观察PPO染色标本,计数100个巨核细胞,计算PPO阳性细胞百分比,阳性率0为阴性,1%~20%为弱阳性,20%以上为强阳性。根据PPO阳性反应分析常规电镜标本中巨核细胞的形态结构。首先观察细胞外形,细胞大小用最大和最小直径表示,最大和最小直径相差大于5 μm为大小不均;细胞表面无伪足或突起用"-"表示,有伪足或突起细胞占1%~20%为"+" ,占21%~50%为"++" ,占50%以上为"+++" 。细胞核质比为细胞核与细胞直径的比值。半数以上细胞核呈圆形或切迹小于核直径的1/8,为核轻度不规则,用"+"表示;半数以上核切迹为核直径的1/8~1/4,为核中度不规则,用"++"表示;半数以上细胞核切迹大于核直径的1/4,或扭曲多极,为核极度不规则,用"+++"表示。分界膜(demarcation membrane system,DMS)、表面连接管道系统(surface-connected canalicular system,SCCS)、致密颗粒和α颗粒分别用"-"表示无,"+"表示1%~20%细胞阳性,"++"表示21%~50%细胞阳性,"+++"表示50%以上细胞阳性。根据巨核细胞大小、常染色质和异染色质比例、线粒体、粗面内质网、分泌囊泡和表面突起等细胞共同形态结构,以及DMS、SCCS、致密颗粒、α颗粒和胞内血小板等巨核细胞标志结构,我们将巨核细胞分为Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期4个发育阶段[5]。
所有患者均行血常规检测、细胞形态检测、骨髓涂片CD41免疫组化染色和染色体核型分析。染色体核型分析采用G显带,按照《人类细胞遗传学国际命名体制(ISCN2009)》进行核型描述。
22例AMKL患者骨髓内可见分化程度不同的原始和幼稚巨核细胞,成熟巨核细胞少见。22例患者中,17例患者骨髓巨核细胞以原始巨核细胞(Ⅰ期)为主(图1A),细胞直径小于20 μm,外形规则,表面突起和伪足少,核轻度或中度不规则,胞质含SCCS和致密颗粒,排列无规律;其中8例巨核细胞含细小DMS,3例巨核细胞含α颗粒。17例中7例细胞直径10~15 μm,核质比大,核仁小,异染色质多,形态结构似幼稚淋巴细胞;10例细胞直径20 μm左右,核为圆形或马蹄形,核仁明显,形态结构似幼稚单核细胞。另外5例患者骨髓巨核细胞大小不等,核质比大小不一,部分细胞形态结构与前述原始巨核细胞相似;部分细胞体积大,表面有不规则突起或伪足,核极度不规则,呈多极、多叶形态,异染色质丰富,核仁明显,胞质量多,部分细胞含大量DMS、SCCS,以及致密颗粒和α颗粒,为幼稚巨核细胞(Ⅱ~Ⅲ期)(图1B、C)。22例患者中有21例巨核细胞PPO呈阳性反应(图1D),阳性率5%~80%,其中小细胞阳性率高,大细胞阳性率低;1例阴性(表2)。
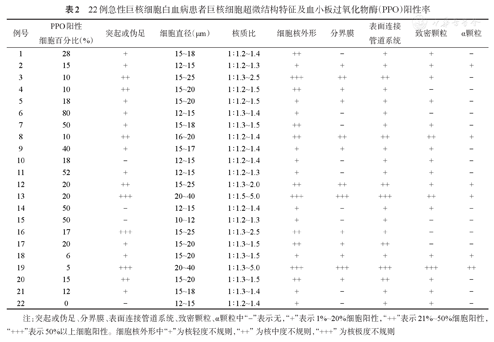
22例急性巨核细胞白血病患者巨核细胞超微结构特征及血小板过氧化物酶(PPO)阳性率
22例急性巨核细胞白血病患者巨核细胞超微结构特征及血小板过氧化物酶(PPO)阳性率
| 例号 | PPO阳性细胞百分比(%) | 突起或伪足 | 细胞直径(μm) | 核质比 | 细胞核外形 | 分界膜 | 表面连接管道系统 | 致密颗粒 | α颗粒 |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 28 | + | 15~18 | 1∶1.2~1.4 | ++ | - | + | + | - |
| 2 | 15 | + | 12~15 | 1∶1.2~1.3 | + | + | + | + | + |
| 3 | 10 | ++ | 15~25 | 1∶1.3~2.5 | +++ | ++ | ++ | + | - |
| 4 | 10 | ++ | 15~20 | 1∶1.2~1.5 | ++ | + | + | - | - |
| 5 | 18 | + | 15~20 | 1∶1.2~1.5 | + | + | + | + | - |
| 6 | 80 | + | 12~15 | 1∶1.3~1.4 | + | - | + | - | - |
| 7 | 50 | + | 15~18 | 1∶1.3~1.5 | ++ | - | + | + | - |
| 8 | 10 | ++ | 16~20 | 1∶1.2~1.4 | ++ | ++ | ++ | ++ | + |
| 9 | 40 | + | 15~17 | 1∶1.2~1.4 | + | + | + | + | - |
| 10 | 18 | - | 12~15 | 1∶1.2~1.4 | + | - | + | + | - |
| 11 | 52 | + | 12~15 | 1∶1.2~1.3 | + | - | + | + | - |
| 12 | 20 | ++ | 15~25 | 1∶1.3~2.0 | ++ | ++ | ++ | + | + |
| 13 | 20 | +++ | 20~40 | 1∶1.5~5.0 | +++ | +++ | +++ | ++ | + |
| 14 | 50 | - | 12~15 | 1∶1.2~1.4 | + | - | + | + | - |
| 15 | 50 | - | 10~12 | 1∶1.2~1.3 | + | - | + | - | - |
| 16 | 17 | +++ | 15~25 | 1∶1.3~2.5 | ++ | + | + | - | - |
| 17 | 20 | + | 15~20 | 1∶1.3~1.5 | ++ | + | ++ | - | - |
| 18 | 6 | + | 15~20 | 1∶1.3~1.5 | + | + | + | + | + |
| 19 | 5 | +++ | 20~40 | 1∶1.3~5.0 | +++ | +++ | +++ | +++ | ++ |
| 20 | 15 | ++ | 15~20 | 1∶1.3~1.5 | ++ | + | ++ | + | - |
| 21 | 12 | + | 15~18 | 1∶1.3~1.4 | + | - | + | + | - |
| 22 | 0 | - | 12~15 | 1∶1.2~1.4 | + | - | + | + | - |
注:突起或伪足、分界膜、表面连接管道系统、致密颗粒、α颗粒中"-"表示无,"+"表示1%~20%细胞阳性,"++"表示21%~50%细胞阳性,"+++"表示50%以上细胞阳性。细胞核外形中"+"为核轻度不规则,"++"为核中度不规则,"+++"为核极度不规则
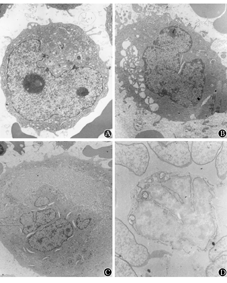

A:原始巨核细胞(Ⅰ期),细胞器少,无分界膜(DMS)、表面连接管道系统(SCCS)等特征性结构(×5 000);B:幼稚巨核细胞(Ⅱ期),胞质含未成熟的DMS、SCCS等结构(×3 000);C:幼稚巨核细胞(Ⅲ期),胞质可见高度发达的DMS、SCCS等结构,致密颗粒和α颗粒增多(×2 500);D:巨核细胞PPO阳性反应(×5 000)
血常规检测示22例AMKL患者WBC(1.54~50.40)×109/L,其中12例WBC>10×109/L;PLT(8~159)×109/L,其中19例PLT<100×109/L,5例PLT<20×109/L;幼稚细胞比例0.02~0.84。骨髓细胞形态学检查可见骨髓增生程度不一,幼稚细胞占有核细胞0.200~0.950。22例患者骨髓涂片CD41免疫组化染色阳性,可见数目不等、形态不一的原始和幼稚巨核细胞。22例患者中18例行染色体核型分析,其中15例为复杂核型异常,包括5例患者+21染色体异常;仅3例患者核型正常(表1)。
AMKL发病率较低,占所有急性白血病的5%~10%,儿童和成人均可发病[6]。Ribeiro等[7]报道儿童发病率明显高于成人,Paredes-Aguilera等[8]报道男性发病率高于女性。本组患者5岁以下儿童18例(81.8%),男女比例为2.67∶1,与文献报道一致。大多数AMKL患者的巨核细胞为原始或低分化细胞,无典型形态特征,易与其他细胞混淆,光镜下常描述为"异常细胞"或"分类不明细胞" 。其次,AMKL患者容易并发骨髓纤维化出现"干抽" ,临床误诊率很高[6]。
PPO定位于核膜和内质网上,是最早出现在原始巨核细胞的特异性标志酶,较CD41更为敏感、特异[9]。Ⅰ期巨核细胞也称原始巨核细胞,体积小,细胞直径10~15 μm,核规则,普通细胞器少,无巨核细胞特征性结构,PPO染色阳性。Ⅱ~Ⅲ期巨核细胞均称为幼稚巨核细胞,细胞体积逐渐增大,直径15~50 μm,染色质增多,巨核细胞DMS和SCCS特征性结构逐步发育成熟,致密颗粒和α颗粒增多,但PPO反应逐步减弱。Ⅳ期为终末期或成熟巨核细胞,直径40~60 μm,细胞周边出现环状微管和微丝结构,胞质中充满胞内血小板,但PPO阳性反应很弱[10]。通过观察巨核细胞的超微结构和PPO阳性反应,有助于鉴别骨髓增生异常综合征、原发免疫性血小板减少症等巨核细胞增多性疾病,提高AMKL诊断准确率。
本组22例AMKL患者中骨髓巨核细胞大部分属于Ⅰ期,除少量普通细胞器和细胞结构,无巨核细胞特征性结构。部分细胞直径在15 μm以内,外形规则,胞质稀少,光镜下形态似淋巴细胞,但电镜下可见核膜PPO阳性;部分细胞直径15 μm左右,表面有突起或伪足较多,胞质量多,光镜下形态似幼稚单核细胞,但电镜下可见未成熟DMS和SCCS膜性结构,提示这两种细胞为低分化的原始巨核细胞。5例患者骨髓巨核细胞大小不一,部分细胞体积小,结构类似Ⅰ期巨核细胞;部分细胞体积大,直径30~40 μm,细胞核大,核多极、多叶,胞质含致密颗粒、α颗粒,DMS和SCCS等巨核细胞特征结构,PPO反应弱,结构类似Ⅱ和Ⅲ期巨核细胞。这些患者Ⅳ期巨核细胞很少见。这一结果说明AMKL患者骨髓巨核细胞分化程度不同,大部分患者巨核细胞以原始巨核细胞(Ⅰ期)为主,少数患者同时含原始和幼稚巨核细胞(Ⅱ~Ⅲ期)。
本组22例患者骨髓细胞形态学检查发现原始和幼稚巨核细胞比例均高于0.200,但光镜下细胞形态学检测容易出现误差。所有患者行CD41免疫组化染色均呈现阳性反应,电镜检查显示这些巨核细胞结构幼稚,PPO反应阳性,两项检查结果均符合AMKL诊断标准。这说明AMKL患者诊断需要结合多种检测技术进行确诊[11]。
AMKL患者常表现为全血细胞减少,尤其是血小板减少,本组22例患者有19例血小板减少,其中5例为重度减少,与文献报道相符[11]。其病理机制可能与骨髓巨核细胞大量增殖,对其他血细胞产生竞争性抑制和损伤相关。
AMKL患者染色体异常发生率高且多为复杂核型,无规律性。本组18例患者行染色体核型分析,15例出现复杂核型异常。唐氏综合征患者的AMKL发生率是其他急性髓系白血病的400~500倍,在AMKL中20%~50%继发于唐氏综合征,因而有人认为染色体+21异常与AMKL相关[12]。本组5例患者+21染色体异常,占染色体异常患者的33.3%,与研究结果一致。
以上检查结果和临床分析表明,AMKL临床表现复杂,无典型的特征性表现,在临床上容易误诊。透射电镜观察能够细致反映白血病巨核细胞的异常形态和分化程度,结合染色体核型分析和细胞化学检查结果,不仅能提高AMKL诊断符合率,而且有助于更好地理解AMKL的发病机制。



























