
观察CD123在急性髓系白血病(AML)患者中的表达,探讨其与AML疗效和预后的关系。
回顾性分析第二军医大学长海医院137例初诊AML(M3除外)患者骨髓异常细胞群中CD123的表达情况,初诊时多参数流式细胞术检测CD123表达占骨髓异常细胞群≥20%定义为阳性,对CD123+与CD123-患者疗效和预后进行比较分析。
①137例AML患者中CD123+组84例(61.3%),CD123-组53例(38.7%)。所有病例根据细胞遗传学及分子生物学异常进行预后等级分层后,预后良好、预后中等、预后不良患者CD123表达差异无统计学意义(χ2=0.861,P=0.650)。而与CD123-组相比,CD123+组AML患者初诊时WBC更高[47.7(1.0~264.0)对22.4(0.7~211.0),z=-2.592,P=0.010]。②CD123+组首次诱导完全缓解(CR1)率为54.8%(46/84),CD123-组为73.6%(39/53),差异有统计学意义(χ2=5.121,P=0.027),最优疗效达完全缓解的111例患者共有52例复发,总复发率为46.8%,CD123+组与CD123-组复发率分别为50.8%(32/63)对41.7%(20/48),差异无统计学意义(χ2=0.911,P=0.340)。③CD123+组与CD123-组患者的中位总生存(OS)时间分别为20.000(95%CI 13.1~26.9)个月和44.0(95%CI 23.6~47.3)个月(χ2=5.874,P=0.015);中位无病生存(DFS)时间分别为7.8(95%CI 1.4~14.1)个月和18.6(95%CI 0~39.7)个月,差异无统计学意义(χ2=2.939,P=0.086)。④在预后中等组及年龄≤ 50岁组中,CD123+患者OS及DFS均较CD123-患者差。
CD123在AML患者中广泛表达,是影响患者CR1及OS的独立危险因素,对评估AML患者诱导化疗反应及生存预后具有重要意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性髓系白血病(AML)是骨髓造血干/祖细胞不同成熟阶段分化受阻,从而阻碍正常造血的一种高度异质性血液肿瘤[1]。目前标准诱导化疗方案可使AML完全缓解(CR)率达到60%~80%,然而最终仍有50%~70%的AML患者复发,5年生存率仅20%左右[2,3,4,5],耐药与复发仍是影响患者生存的主要危险因素。CD123又称IL-3受体α链(IL-3Rα),在大多数白血病干细胞(LSC)表面高表达,而在正常造血干/祖细胞(HSPC)表面低表达或不表达,是LSC的主要标志之一[6]。CD123与配体IL-3结合后可获得增殖和生存优势,从而促进AML的发生、发展,是AML复发或耐药的主要根源之一[7]。既往关于CD123的研究多在CD34+ CD38-亚群中进行[8],而目前CD123在AML骨髓异常细胞群中的表达与患者疗效和预后的关系国内外较少报道。本研究中,我们回顾性分析了137例初诊AML患者骨髓异常细胞群中CD123的表达分布,探讨其与AML疗效和预后的关系。
2012年1月至2015年12月第二军医大学长海医院收治的初诊AML(M3除外)患者137例,其中男70例,女67例,中位年龄46(13~72)岁。参照欧洲白血病协作组标准[9],根据患者初诊时白血病细胞遗传学和分子遗传学的改变进行AML预后危险度判定,其中预后良好组28例、预后中等组74例、预后不良组35例。我们以50岁为界限将患者分为2组,年龄≤ 50岁组90例,年龄>50岁组47例。137例患者诊断及分类均符合2008年WHO修订版造血和淋巴组织肿瘤分类诊断标准[10]。137例患者至少完成两次化疗,可评估首次诱导化疗后确切疗效。
137例患者初诊时采用EDTA抗凝管采集骨髓3 ml,抗体标记后,裂红、离心、PBS洗涤,采用8色流式细胞仪进行检测,以CD45dim/SSClow双参数散点图结合其他标志,设门圈出异常细胞群,在异常细胞群中分析CD123阳性细胞占所有异常细胞的百分比,CD123阳性细胞≥ 20%定义为表达阳性。
全部137例患者首次诱导方案中,119例采用DA(柔红霉素+阿糖胞苷)或IA(去甲氧柔红霉素+阿糖胞苷)方案;18例采用地西他滨+CAG(阿糖胞苷+阿克拉霉素+G-CSF)方案;12例采用HA/FA/MA(高三尖杉酯碱/氟达拉滨/米托蒽醌+阿糖胞苷)方案。巩固化疗多采用大剂量阿糖胞苷或FA方案,老年低增生AML患者继续地西他滨+CAG方案巩固化疗。疗效参照文献[11]标准进行评价。
随访截止时间为2017年2月7日,中位随访时间为17(1~60)个月。12例患者失访,其中CD123+组失访7例,CD123-组失访5例,失访病例以最后明确存活时间处理,末次随访仍存活者按截尾数据处理。生存指标:总体生存(OS)时间为从确诊之日至死亡或末次随访时间,无病生存(DFS)时间为从第1次完全缓解(CR1)直至死亡或复发或末次随访时间[8]。
采用SPSS 21.0软件进行数据分析,组间比较采用χ2检验或Mann-Whitney U检验;生存分析采用Kaplan-Meier法,采用Log-rank检验进行组间比较;CR1的影响因素采用非条件Logistic回归进行单因素和多因素分析,OS的影响因素采用Cox比例风险模型进行多因素分析。所有检验均为双侧检验,P<0.05为差异有统计学意义。
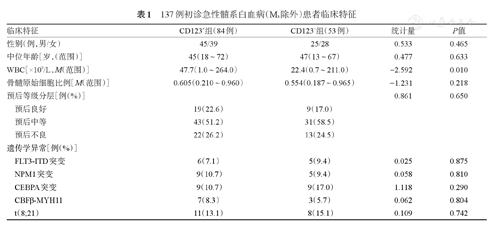
一般临床特征分析见表1。137例AML患者中,CD123+组84例(61.3%),CD123-组53例(38.7%)。伴FLT3-ITD突变11例、NPM1突变14例、CEBPA突变18例、CBFβ-MYH11融合基因10例、t(8;21)19例。全部患者中,首次诱导达CR1 85例、部分缓解14例、未缓解41例;行异基因造血干细胞移植34例。CD123+组WBC更高(z=-2.592,P=0.010),CD123+组与CD123-组之间预后等级分层分布差异无统计学意义(χ2=0.861,P=0.650),且两组间常见预后突变基因或融合基因分布差异亦无统计学意义(P值均>0.05)。
137例初诊急性髓系白血病(M3除外)患者临床特征
137例初诊急性髓系白血病(M3除外)患者临床特征
| 临床特征 | CD123+组(84例) | CD123-组(53例) | 统计量 | P值 | |
|---|---|---|---|---|---|
| 性别(例,男/女) | 45/39 | 25/28 | 0.533 | 0.465 | |
| 中位年龄[岁,(范围)] | 45(18~72) | 47(13~67) | 0.477 | 0.633 | |
| WBC[×109/L,M(范围)] | 47.7(1.0~264.0) | 22.4(0.7~211.0) | -2.592 | 0.010 | |
| 骨髓原始细胞比例[M(范围)] | 0.605(0.210~0.960) | 0.554(0.187~0.965) | -1.231 | 0.218 | |
| 预后等级分层[例(%)] | 0.861 | 0.650 | |||
| 预后良好 | 19(22.6) | 9(17.0) | |||
| 预后中等 | 43(51.2) | 31(58.5) | |||
| 预后不良 | 22(26.2) | 13(24.5) | |||
| 遗传学异常[例(%)] | |||||
| FLT3-ITD突变 | 6(7.1) | 5(9.4) | 0.025 | 0.875 | |
| NPM1突变 | 9(10.7) | 5(9.4) | 0.058 | 0.810 | |
| CEBPA突变 | 9(10.7) | 9(17.0) | 1.118 | 0.290 | |
| CBFβ-MYH11 | 7(8.3) | 3(5.7) | 0.062 | 0.804 | |
| t(8;21) | 11(13.1) | 8(15.1) | 0.109 | 0.742 | |
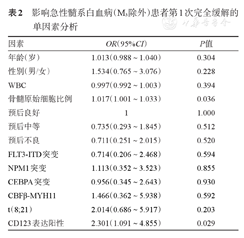
CD123+组CR1率为54.8%(46/84)、CD123-组CR1率为73.6%(39/53),差异有统计学意义(χ2=5.121,P=0.027)。首次诱导未达缓解者经过再诱导或多次诱导化疗后,111例(81.0%)患者最优疗效达CR,两组CR率分别为75.0%(63/84)和90.6%(48/53),差异有统计学意义(χ2=5.121,P=0.024)。进一步采用非条件Logistic回归模型进行单因素分析及多因素分析,单因素分析见表2,初诊高骨髓原始细胞比例及CD123表达阳性的患者CR1率较低,将上述两个因素纳入多因素分析模型,结果显示初诊高骨髓原始细胞比例[OR=1.019(95%CI 1.003~1.036),P=0.021]及CD123表达阳性[OR=2.434(95%CI 1.122~5.280),P=0.024]均是AML患者CR1的独立危险因素(表2)。至随访终点,最优疗效达CR的111例AML患者共有52例复发,总复发率为46.8%,CD123+组与CD123-组复发率分别为50.8%(32/63)对41.7%(20/48),差异无统计学意义(χ2=0.911,P=0.340)。
影响急性髓系白血病(M3除外)患者第1次完全缓解的单因素分析
影响急性髓系白血病(M3除外)患者第1次完全缓解的单因素分析
| 因素 | OR(95%CI) | P值 |
|---|---|---|
| 年龄(岁) | 1.013(0.988~1.040) | 0.304 |
| 性别(男/女) | 1.534(0.765~3.076) | 0.228 |
| WBC | 0.997(0.992~1.003) | 0.394 |
| 骨髓原始细胞比例 | 1.017(1.001~1.033) | 0.036 |
| 预后良好 | 1 | 1.000 |
| 预后中等 | 0.735(0.293~1.845) | 0.512 |
| 预后不良 | 0.711(0.251~2.015) | 0.520 |
| FLT3-ITD突变 | 0.714(0.206~2.468) | 0.594 |
| NPM1突变 | 1.113(0.352~3.523) | 0.855 |
| CEBPA突变 | 0.956(0.345~2.643) | 0.930 |
| CBFβ-MYH11 | 1.466(0.362~5.938) | 0.592 |
| t(8;21) | 2.014(0.686~5.917) | 0.203 |
| CD123表达阳性 | 2.301(1.091~4.855) | 0.029 |
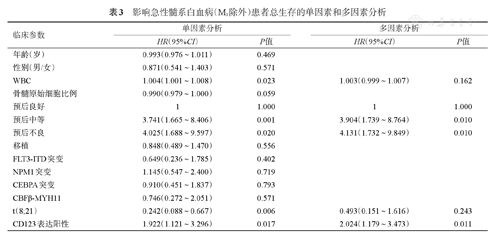
137例AML患者中位OS时间为29.0(95%CI 18.1~39.9)个月,中位DFS时间为13.5(95%CI 6.7~20.3)个月;而CD123+组与CD123-组的中位OS时间分别为20.0(95%CI 13.1~26.9)个月和44.0(95%CI 23.6~47.3)个月(χ2=5.874,P=0.015),2年OS率分别为43.3%对69.5%(图1A)。Cox回归模型多因素分析显示,预后等级分层中预后中等及预后不良组均较预后良好组OS差,HR分别为3.904(95%CI 1.739~8.764)及4.131(95%CI 1.732~9.849),P值均为0.010。同样CD123表达阳性[HR=2.024(95%CI 1.179~3.473),P=0.011]是影响患者OS的独立危险因素(表3)。CD123+组DFS较CD123-组差,中位DFS时间分别为7.8(95%CI 1.4~14.1)个月和18.6(95%CI 0~39.7)个月,但差异无统计学意义(χ2=2.939,P=0.086)(图1B)。
影响急性髓系白血病(M3除外)患者总生存的单因素和多因素分析
影响急性髓系白血病(M3除外)患者总生存的单因素和多因素分析
| 临床参数 | 单因素分析 | 多因素分析 | ||
|---|---|---|---|---|
| HR(95%CI) | P值 | HR(95%CI) | P值 | |
| 年龄(岁) | 0.993(0.976~1.011) | 0.469 | ||
| 性别(男/女) | 0.871(0.541~1.403) | 0.571 | ||
| WBC | 1.004(1.001~1.008) | 0.023 | 1.003(0.999~1.007) | 0.162 |
| 骨髓原始细胞比例 | 0.990(0.979~1.000) | 0.059 | ||
| 预后良好 | 1 | 1.000 | 1 | 1.000 |
| 预后中等 | 3.741(1.665~8.406) | 0.001 | 3.904(1.739~8.764) | 0.010 |
| 预后不良 | 4.025(1.688~9.597) | 0.020 | 4.131(1.732~9.849) | 0.010 |
| 移植 | 0.848(0.489~1.470) | 0.556 | ||
| FLT3-ITD突变 | 0.649(0.236~1.785) | 0.402 | ||
| NPM1突变 | 1.145(0.547~2.400) | 0.719 | ||
| CEBPA突变 | 0.910(0.451~1.837) | 0.793 | ||
| CBFβ-MYH11 | 0.746(0.272~2.051) | 0.571 | ||
| t(8;21) | 0.242(0.088~0.667) | 0.006 | 0.493(0.151~1.616) | 0.243 |
| CD123表达阳性 | 1.922(1.121~3.296) | 0.017 | 2.024(1.179~3.473) | 0.011 |
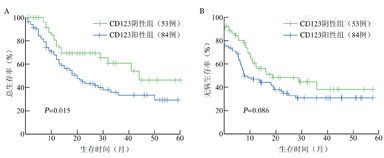

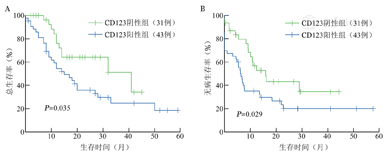
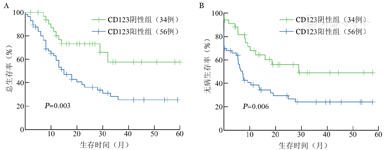
不同预后等级分层组内CD123+与CD123-患者生存曲线比较见图2,预后良好(28例)和预后不良(35例)组内CD123是否表达OS与DFS差异无统计学意义(P>0.05);而在预后中等组中(74例),CD123+患者OS和DFS率明显低于CD123-患者,差异有统计学意义(OS:35.9%对64.1%,χ2=6.345,P=0.012;DFS:20.0%对43.2%,χ2=4.413,P=0.036)。本研究中,年龄≤ 50岁90例,年龄>50岁47例。在年龄≤ 5 0岁的患者中,CD123+组(56例)OS和DFS均较CD123-组(34例)差,差异有统计学意义[中位OS时间:15.0(95%CI 10.0~20.0)个月对未达到,χ2=8.627,P=0.003;中位DFS时间:7.2(95%CI 5.0~9.4)个月对29.0个月,χ2=7.640,P=0.006](图3)。


AML是临床及生物学异质性很强的一种血液肿瘤。尽管细胞遗传学或分子生物学异常可以对AML进行危险度分层、提供预后信息以及指导临床治疗[8]。然而,临床上部分AML患者为正常核型且不伴基因突变,这类患者被划分为预后中等组,但其预后仍各不相同,因此,需要其他简便易获得的特异性标志物指导临床治疗及预后判断。而流式细胞术作为最方便快捷和具有高度敏感性的一种临床检测手段,应用其检测白血病细胞表面特异性抗原标志物,预测疾病治疗反应及预后更具有临床普遍适用性。
CD123是由360个氨基酸组成的糖蛋白,与CD131一起形成高亲和力的IL-3受体,通过结合IL-3配体,可促进HSPC增殖和生存[7,12]。CD123广泛表达在大多数AML原始细胞及LSC表面,且与AML不良预后相关[8,13]。然而,研究发现LSC并不总是存在CD34+CD38-细胞亚群中,在伴有NPM1突变的AML CD34-细胞亚群中同样发现存在LSC[14],且应用CD34+CD38-和CD34-亚群细胞均能在NSG小鼠中成功建立白血病模型[15,16]。这些证据表明LSC存在高度异质性,目前已知的表面抗原标志并不能完全鉴别LSC群体[15]。而CD123作为LSC的主要表面抗原标志之一,是目前AML免疫治疗的理想靶点。
我们的研究结果显示61.3%的AML患者骨髓异常细胞高表达CD123,将所有AML患者根据细胞遗传学及分子生物学异常进行危险度分层后发现CD123在三组中表达差异无统计学意义。Testa等[17]研究发现与正常CD34+细胞群相比大约45%的AML患者白血病细胞高表达CD123,且与AML不良预后有关。Muñoz等[18]研究发现45例AML患者除2例M7外,均为CD123表达阳性,且在CD34+和CD34-细胞群中CD123表达并无明显差异,但因其样本量较少,研究结果尚需进一步验证。Ehninger等[13]在319例初诊AML患者全部白血病细胞和CD34+白血病细胞中分别分析CD33和CD123的表达特点,结果发现77.9%的AML患者白血病细胞群高表达CD123。该研究以标准化的CD123平均荧光强度值>10定义为表达阳性,可能是其CD123阳性表达率高于本研究的原因之一。同样,Ehninger等[13]也发现在各危险分组中CD123表达无明显差异。本研究中,我们亦发现CD123阳性组WBC更高,既往研究已知CD123与其配体IL-3结合后可促进细胞增殖、存活[19],而外周血高WBC亦与AML不良预后相关。因此,一定程度上说明CD123的存在可促进外周血白细胞增殖,两者相互作用,成为AML预后不良因素之一。
疗效分析发现,CD123+组CR1率明显低于CD123-组,多因素分析显示CD123表达是AML患者首次诱导化疗失败的独立危险因素[OR=2.434(95%CI 1.122~5.280),P=0.024],提示可根据初诊时CD123的表达辅助临床快速判断患者是否具有诱导化疗失败的高风险。有研究提示CD123高表达是AML复发的强烈预测指标[20],但本研究我们尚未发现CD123表达对患者复发率有影响,考虑原因可能为多数CD123+组患者首次诱导化疗失败率较高,导致早期病死率较高,而缓解患者的复发率与CD123-组相当。当然,研究结果尚需扩大样本量或多中心前瞻性研究验证。
生存分析显示,CD123+组患者OS及DFS率均明显低于CD123-组,CD123-组较CD123+组具有明显生存优势。Cox模型多因素分析证实预后危险分层中预后中等与预后不良及CD123表达阳性是影响患者OS的独立预后不良因素,但对患者DFS并无明显影响,这与Vergez等[8]研究结果一致。为进一步明确CD123的预后价值,我们将137例AML按危险分层分为3组,在预后良好组和预后不良组CD123表达并不影响患者OS及DFS,考虑可能与这两组病例数较少有关。而临床中大约67%的AML患者最终归为预后中等组[21]。本研究我们发现预后中等组中CD123表达阳性显著降低了患者的OS及DFS(P值分别为0.035、0.029)。研究已知,AML是一种年龄相关疾病,随年龄增长而发病率递增,且年龄是影响AML患者预后的独立不良因素[22]。本研究中,在年龄≤ 50岁的患者CD123表达具有更显著的预后价值,CD123+组与CD123-组比较OS及DFS率均显著降低。Vergez等[8]回顾性分析111例年龄<65岁的初发AML患者,标准诱导方案化疗后,显示初诊CD34+CD38low/−CD123+细胞比例≤1%的AML患者OS及DFS均更差,且预后良好组和预后中等组亦有同样的预测作用。上述结果提示AML患者无论是所有白血病细胞抑或是LSC中CD123高表达者均有更差的生存预后,这为临床判断AML患者预后及指导治疗决策提供了简便易行的评估手段。
CD123在AML白血病细胞及LSC中均表达较高,提示CD123是AML的一个潜在免疫治疗靶点,最近,部分靶向CD123的抗体药物正在进行或已经完成Ⅰ期临床试验[23,24],而靶向CD123的细胞免疫治疗也已取得显著进展。Mardiros等[25]通过构建两种不同结构的CD123嵌合抗原受体T细胞(CAR-T),体内外试验均展现出显著杀伤CD123阳性细胞系及AML原代细胞的能力,最重要的是,体外实验未发现明显造血毒性。而Gill等[26]亦报道了CD123 CAR-T在CD123+AML原代细胞诱导建立的NSG小鼠白血病模型中可观察到显著抗白血病效应。综上所述,流式细胞术检测CD123表达对评估AML患者诱导化疗反应及生存预后具有重要意义,可帮助临床上尽快鉴别诱导化疗失败风险较高的患者,以便对这部分患者尽早进行强化治疗干预。同时,CD123在大部分AML白血病细胞及LSC上高表达,提示靶向CD123的细胞免疫治疗或许可以为复发难治CD123+ AML患者带来新的治疗希望。



























