
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着PET-CT在弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)中的广泛应用,增加了对DLBCL诊断分期及疗效评估的有效手段。目前PET-CT应用中多以18F标记的脱氧葡萄糖(Fluorodeoxyglucose,18F-FDG)为主要示踪剂,在治疗中期(2~4个疗程后)进行评估[1]。由于FDG反应细胞葡萄糖代谢水平,其灵敏度高、特异度较差,故研究人员致力于研发新型淋巴瘤示踪剂。18F标记的脱氧胸腺嘧啶(Fluorothymidine,18F-FLT)反应细胞增殖水平,在肺癌等肿瘤中显示了良好的与FDG的互补性[2]。在本研究中,我们对51例DLBCL患者两种示踪剂(FDG、FLT)标准摄取值(SUV)对其疗效、预后的影响进行分析,旨在探讨FDG、FLT PET-CT在初诊DLBCL预后评估中的作用。
以2008年9月至2010年10月在我院诊治的51例DLBCL患者为研究对象。入组标准:病理明确诊断为DLBCL;化疗为一线R-CHOP(利妥昔单抗+环磷酰胺+长春地辛+多柔比星+泼尼松)方案;患者化疗前均行FDG与FLT PET-CT检查。排除标准:滤泡淋巴瘤(FL)转化的DLBCL;既往有其他肿瘤病史;淋巴瘤病灶经手术切除者。收集整理患者临床和实验室指标,包括年龄、性别、国际预后指数(IPI)、有无B症状(发热、盗汗、体重减轻)、病理亚型、Ann Arbor分期等。本研究经医院伦理道德委员会批准,所有受试对象均签署知情同意书。
所有受试者接受化疗前均行18F-FDG及18F-FLT PET-CT躯干与头部显像检查,两次显像间隔时间为1~3 d。18F-FDG显像需检查前空腹4~5 h。PET-CT显像仪为美国GE公司产品Discovery VCT。两种示踪剂静脉注射剂量为4~5 MBq/kg,注射后60 min行PET-CT显像,扫描范围躯干由颈部至股骨上段(个别下肢受侵病例加扫全部下肢)。CT扫描(管电压120 kV,管电流110 mA)进行衰减校正,PET发射扫描每床位采集2 min,图像重建后以冠状位、矢状位和轴位断面显示。
图像由两位有经验的核医学科医师阅片,感兴趣区(ROI)法勾画每个患者多(单)发病灶中SUV最大处部位,记录最大值(SUVmax)及平均值(SUVmean)。因FLT在骨及肝脏中摄取程度高,故相应上述部位病变测量时参考FDG病变显像部位。
采用电话和(或)门诊随访,随访截止时间为2016年2月29日,中位随访时间为51(17~90)个月,无失访者。以无进展生存(PFS)及总体生存(OS)作为随访指标。PFS时间定义为从诊断到疾病进展、复发或任何原因导致死亡的时间或随访截止时间。OS时间定义为从诊断到任何原因导致死亡的时间或随访截止时间。
应用SPSS 20.0软件进行统计学分析。t检验比较SUVmax及SUVmean在完全缓解(CR)组及非CR组等临床特征分组患者间是否存在差异。受试者工作特征曲线(ROC曲线)根据患者疗效确定SUVmax及SUVmean最佳阈值;Kaplan-Meier法和Log-rank检验比较SUV值对PFS及OS的影响,Cox回归模型进行多因素分析。P<0.05为差异有统计学意义。
51例患者中,男29例,女22例,中位年龄53(18~77)岁。Ann-Arbor分期Ⅰ~Ⅱ期19例(37.3%),Ⅲ~Ⅳ期32例(62.7%);有B症状者25例(49.0%);生发中心来源(GCB)12例(23.5%),非生发中心来源(non-GCB)39例(76.5%);后接受自体干细胞移植(ASCT)者4例(7.8%);IPI评分0~1分者23例(45.0%),2分者16例(31.4%),3分者6例(11.8%),4~5分者6例(11.8%)。所有患者经R-CHOP方案6个疗程化疗,治疗结束后,33例(64.7%)患者达CR。
结果显示FDG显像CR组及非CR组两组间差异有统计学意义(P值均<0.05);FLT显像两组间差异无统计学意义(P值均>0.05)(表1)。
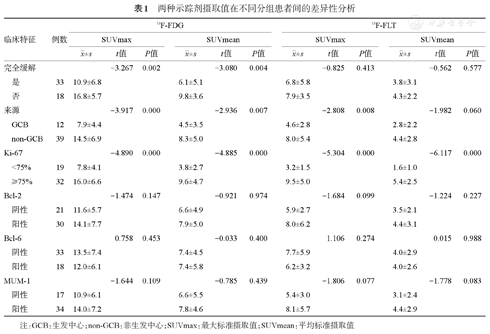
两种示踪剂摄取值在不同分组患者间的差异性分析
两种示踪剂摄取值在不同分组患者间的差异性分析
| 临床特征 | 例数 | 18F-FDG | 18F-FLT | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| SUVmax | SUVmean | SUVmax | SUVmean | |||||||||||
 ±s ±s | t值 | P值 |  ±s ±s | t值 | P值 |  ±s ±s | t值 | P值 |  ±s ±s | t值 | P值 | |||
| 完全缓解 | -3.267 | 0.002 | -3.080 | 0.004 | -0.825 | 0.413 | -0.562 | 0.577 | ||||||
| 是 | 33 | 10.9±6.8 | 6.1±5.1 | 6.8±5.8 | 3.8±3.1 | |||||||||
| 否 | 18 | 16.8±5.7 | 9.8±3.6 | 7.9±3.5 | 4.3±2.2 | |||||||||
| 来源 | -3.917 | 0.000 | -2.936 | 0.007 | -2.808 | 0.008 | -1.982 | 0.060 | ||||||
| GCB | 12 | 7.9±4.4 | 4.5±3.5 | 4.6±2.8 | 2.8±2.2 | |||||||||
| non-GCB | 39 | 14.5±6.9 | 8.3±5.0 | 8.0±5.4 | 4.4±2.8 | |||||||||
| Ki-67 | -4.890 | 0.000 | -4.885 | 0.000 | -5.304 | 0.000 | -6.117 | 0.000 | ||||||
| <75% | 19 | 7.8±4.1 | 3.8±2.7 | 3.2±1.5 | 1.6±1.0 | |||||||||
| ≥75% | 32 | 16.0±6.6 | 9.6±4.7 | 9.5±5.0 | 5.4±2.5 | |||||||||
| Bcl-2 | -1.474 | 0.147 | -0.921 | 0.974 | -1.684 | 0.099 | -1.224 | 0.227 | ||||||
| 阴性 | 21 | 11.6±5.7 | 6.6±4.9 | 5.9±2.7 | 3.5±2.1 | |||||||||
| 阳性 | 30 | 14.1±7.7 | 7.9±5.0 | 8.0±6.2 | 4.4±3.1 | |||||||||
| Bcl-6 | 0.758 | 0.453 | -0.033 | 0.400 | 1.106 | 0.274 | 0.015 | 0.988 | ||||||
| 阴性 | 33 | 13.5±7.4 | 7.4±4.5 | 7.7±5.9 | 4.0±2.9 | |||||||||
| 阳性 | 18 | 12.0±6.1 | 7.4±5.8 | 6.2±3.2 | 4.0±2.6 | |||||||||
| MUM-1 | -1.644 | 0.109 | -0.785 | 0.439 | -1.806 | 0.077 | -1.778 | 0.083 | ||||||
| 阴性 | 17 | 10.9±6.1 | 6.6±5.5 | 5.4±3.0 | 3.1±2.4 | |||||||||
| 阳性 | 34 | 14.0±7.2 | 7.8±4.6 | 8.1±5.7 | 4.4±2.9 | |||||||||
注:GCB:生发中心;non-GCB:非生发中心;SUVmax:最大标准摄取值;SUVmean:平均标准摄取值
对不同分子标志物分组后患者间两种示踪剂SUVmax、SUVmean的差异进行分析,结果显示SUVmax-FDG、SUVmean-FDG及SUVmax-FLT值在是否为生发中心来源组间差异有统计学意义,两种示踪剂SUVmax及SUVmean值均与不同Ki-67表达(以75%为界)组间差异有统计学意义,P值均<0.01(表1)。
18F-FDG:①SUVmax:ROC曲线下面积(AUC)为0.773,P=0.001;②SUVmean:AUC为0.775,P=0.001。18F-FLT:①SUVmax:AUC为0.675,P=0.040;②SUVmean:AUC为0.599,P=0.245。最佳阈值:18F-FDG:SUVmax为8.77,SUVmean为4.72;18F-FLT:SUVmax为8.01,SUVmean为4.28。
Kaplan-Meier生存分析显示,初诊两种示踪剂的SUVmax及SUVmean值均可以预测患者预后(P值均<0.05)(图1、图2)。




采用Cox回归模型进行预后相关因素多因素分析,结果显示FDG显像中SUVmax>8.77(HR=52.885,95% CI 1.110~2 508.150,P=0.044)与IPI评分>2分(HR=3.567,95% CI 1.330~9.565,P=0.014)是影响患者PFS的独立预后不良因素,SUVmax>8.77(HR=52.775,95% CI 1.121~2 495.763,P=0.044)与IPI评分>2分(HR=3.059,95% CI 1.167~8.019,P=0.031)也是影响患者OS的独立预后不良因素。
FDG PET-CT是临床评估DLBCL分期、疗效及预后的常规方法,尤其是治疗中(末)期PET-CT在临床的广泛应用,病变组织葡萄糖代谢在中期的下降程度可以准确评估患者的预后,目前已达标准化及定量化[4,5]。FDG由于在炎性组织的摄取影响了其在DLBCL显像中的特异性,FLT作为特异性相对较好的示踪剂可弥补FDG的不足。既往我们的研究结果显示初诊FDG及FLT PET-CT显像对鉴别侵袭性及惰性淋巴瘤具有重要意义[6]。而通过长期随访,初诊FDG及FLT摄取程度对患者疗效的影响及预后评估是本研究的主要目的。
尽管视觉分析已成为淋巴瘤评估有效而简洁方法,但半定量分析SUV值仍是DLBCL PET-CT研究中重要指标之一,且有文献报道SUVmax、SUVmean对预后评估存在一定差异[7]。在本研究中,我们发现初诊FDG摄取程度与疗效相关,即葡萄糖代谢程度较低者易达到CR,而FLT摄取程度与疗效间相关性欠佳,提示初诊FDG值在预测患者疗效方面优于FLT。Okuyucu等[8]认为初诊FDG SUVmean是评估非霍奇金淋巴瘤复发/转移最好的指标。Jang等[9]的研究也显示FDG SUVmax是评估复发/难治性DLBCL预后的有力指标。以上有关FDG的研究结果与本研究一致。
关于初诊FLT与预后评估的文献相对于FDG为少,原因在于受正电子药物生产制约,可从事FLT淋巴瘤研究的PET-CT中心不多。Herrmann等[10]研究显示DLBCL患者初诊FLT摄取程度与IPI评分相关,FLT SUVmean值在未达CR患者中较高(P=0.049)。分析其与本研究结果不一致的原因在于入组患者不同,文献中除DLBCL外,还包括了FL及间变性大细胞性淋巴瘤(ALCL),且P值接近0.05、SUVmax在达CR组与未达组间差异无统计学意义(P=0.218),均反应了初诊FLT在预测疗效方面作用有限。
中期FDG摄取值在预后评估中的研究较为成熟,目前研究结论已广泛应用于临床。但初诊时两种示踪剂摄取值与生存期的关系并无明确结论,FDG多显示初诊SUV值较高有预后不良作用。有文献报道根据ROC曲线选取的可以评估预后的SUV阈值不尽相同,FDG SUVmax范围可从6.0~15.0[9,11]。在本研究中,我们的结果显示初诊两种示踪剂对评估生存期均有重要作用,根据ROC曲线确定的SUVmax、SUVmean阈值与患者PFS及OS均有相关性,其中FDG的SUVmax阈值测算为8.77,大致在文献报道范围内。FLT未查阅到明确阈值与生存期的报道,因此本研究所测算出的FLT SUVmax、SUVmean阈值可为今后研究作为参考。FLT目前对于淋巴瘤仍是一种实验性的PET-CT示踪剂,因其图像信噪比较低及在骨骼病变显示受限等因素,并未广泛应用于临床。初诊PET-CT研究文献中报道的结果各有差异的原因在于不同研究中患者组成差异,研究病例数较少,统计方法的不同,初诊FDG、FLT研究经验有限,尤其是FLT图像评估标准具有不确定性。
如前所述,目前中期PET-CT评估已成为临床预后的关键手段,在国内也有较多文献报道[12]。但初诊时的数据是研究的基础,尤其是在缺乏患者动态评估管理的单位及易失访的患者中更显重要,可以为临床医师在化疗前对患者预后提供初步客观的认识。同时也应认识到初诊PET-CT评估相对于中期具有不确定性及不完善性,应结合临床指标如IPI评分,总体预测患者疗效及评估预后。
关于DLBCL分子标志物方面的研究报道屡见不鲜,但依据不同生物标志物设定的免疫分型方法,对DLBCL患者预后的影响尚存在争议。在本研究中,我们重点观测了部分标志物表达与核素摄取及预后的关系,Ki-67与FLT相关、Bcl-6具有一定的预后作用也与既往报道一致[13]。今后可关注"分子+影像+临床"三者评估方式共同的作用。
综上,初诊FDG评估DLBCL患者疗效优于FLT。FDG、FLT均可以较好地评估患者生存预后,需要与临床IPI评分紧密结合综合评估。FLT是可行的DLBCL PET-CT示踪剂,其治疗中期的价值及应用将做进一步深入研究。


























