
探讨肿瘤相关性巨噬细胞(TAM)在多发性骨髓瘤(MM)中的临床意义及其与肿瘤血管生成、免疫抑制的关系。
以2015年8月至2017年6月就诊的70例MM患者为观察对象,以20例良性血液病(缺铁性贫血13例,巨幼细胞性贫血7例)患者为对照,采用免疫组化法检测骨髓标本中CD163、CD34、VEGF的表达,采用流式细胞术检测Treg细胞比例,采用ELISA法检测IL-10水平,结合临床特征进行分析。
①70例患者中,男31例,女39例,中位年龄65(50~78)岁。MM患者组的TAM浸润密度、微血管密度(MVD)、VEGF表达水平、Treg细胞比例及IL-10水平均较对照组升高(P值均<0.05)。②在MM患者组中,疾病稳定组(15例)患者的上述指标均较初诊组(35例)和复发难治组(20例)低(P值均<0.05);后两组差异无统计学意义(P值均>0.05)。③35例初诊MM患者中27例完成4个疗程治疗,有效组(15例)治疗后TAM浸润密度较治疗前明显下降,差异有统计学意义[(20.20±7.66)对(28.87±11.97)个/高倍,t=2.362,P=0.025];无效组(12例)治疗前后差异无统计学意义[(42.00±13.76)对(48.25±13.59)个/高倍,t=1.119,P=0.275]。④硼替佐米方案治疗有效组患者(21例次)的TAM浸润密度较非硼替佐米方案治疗有效组(18例次)减低[(16.52 ±4.26)对(19.27±5.82)个/高倍,t=1.662,P=0.170]。⑤MM患者的TAM浸润密度与MVD、VEGF表达水平、Treg细胞比例及IL-10水平呈正相关(P值均<0.001)。
骨髓微环境中浸润的TAM与MM发生、发展、疗效及治疗耐药有关,其作用机制可能与TAM促进肿瘤血管形成及抑制免疫反应有关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
骨髓微环境在多发性骨髓瘤(multiple myeloma,MM)瘤细胞的生存、增殖、迁移、耐药等方面具有重要作用,并且影响MM患者的临床表现和预后[1]。巨噬细胞在骨髓微环境不同细胞因子的刺激下发生活化并根据表型分为M1和M2型,MM骨髓微环境中的肿瘤相关性巨噬细胞(tumor associated macrophages,TAM)主要为M2型巨噬细胞[2]。陈芯仪等[3]研究发现MM患者的TAM浸润密度和早期疗效有关,其通过促进瘤细胞分泌炎症因子、趋化因子及刺激相关受体表达,从而促进瘤细胞增殖以及保护瘤细胞免于凋亡。在本研究中我们通过检测MM及良性血液病患者骨髓组织中的TAM浸润密度、微血管密度(microvessel density,MVD)、VEGF表达水平、Treg细胞比例及IL-10水平,探讨TAM在MM中的临床意义及其是否参与骨髓瘤微环境中血管形成及抑制免疫反应,为MM靶向治疗提供新思路。
以我院2015年8月至2017年6月就诊的70例MM患者为研究对象,依据中国MM诊治指南(2015年修订)[4]明确诊断为MM,排除标准:既往或现阶段合并其他恶性肿瘤。70例MM患者中,男31例,女39例,中位年龄65(50~78)岁;初诊组35例、疾病稳定组15例、复发难治组20例;国际分期体系(ISS)分期Ⅰ期14例、Ⅱ期22例、Ⅲ期34例;免疫学分型:IgG型27例、IgA型18例、IgD型3例、轻链型22例。以20例血液系统良性疾病(缺铁性贫血13例、巨幼细胞贫血7例)患者为对照,排除标准:恶性肿瘤、慢性疾病、结缔组织疾病、感染性疾病等继发的血细胞减少。对照组20例患者中,男4例,女16例,中位年龄48(42~50)岁。MM患者组和对照组在年龄、性别上的差异无统计学意义(P>0.05)。本研究获我院伦理委员会批准(批准号:20140013),受试者均知情同意并签署同意书。
根据国际骨髓瘤工作组(IMWG)疗效判定标准进行疗效评价,分为治疗有效组与无效组。有效组包括完全缓解(CR)、非常好的部分缓解(VGPR)、部分缓解(PR),无效组包括疾病稳定(SD)、疾病进展(PD)、缓解后复发。
鼠抗人单克隆抗体(单抗)CD163(标记M2型巨噬细胞[5])、CD34(标记微血管)、通用型SP免疫组化试剂盒均购自北京中杉金桥生物技术有限公司,鼠抗人VEGF单抗购自福建迈新生物技术开发有限公司;鼠抗人CD25-FITC、CD127-PE、CD4-PC5购自美国BD公司;IL-10酶联免疫试剂盒购自武汉华美生物工程有限公司。
取患者髂后上棘骨髓液(2 ml)及骨髓活检组织,骨髓液常规离心分离上清置于EP管于-80 ℃冻存备用。骨髓活检组织常规固定、脱水、石蜡包埋、切片。
将骨髓石蜡切片行常规免疫组化SP二步法染色。TAM及MVD计数分别参照文献[6,7]方法:即首先在低倍镜(×40)下选取视野中巨噬细胞或微血管最密集的3个区域,在高倍镜(×400)下进行计数,取平均值进行统计分析。VEGF评分参照文献[8]方法进行评定:随机取3个高倍镜视野,造血细胞染色强度等级的平均数与阳性细胞比例等级数相乘,结果用任意单位(arbitrary unit,AU)值表示。以上免疫组化结果判定由两位病理科医师独自判断后取均数。
取100 μl抗凝骨髓液放入样品测定管,加入CD25-FITC、CD127-PE、CD4-PC5单抗各2.5 μl,混匀后反应15 min,溶血、洗涤、上机检测。CD4+CD25+CD127low/-细胞即为Treg细胞,结果以Treg细胞在CD4+细胞中的比例表示。
取-80 ℃冻存骨髓上清,按照ELISA试剂盒说明书进行操作。
采用查阅病历及电话回访的形式进行跟踪随访。随访截止日期为2017年6月30日。
采用SPSS 17.0软件进行统计学分析。计量资料以 ±s表示,符合正态分布的两组间均数比较采用t检验,相关性分析采用Pearson直线相关分析。P<0.05为差异有统计学意义。
±s表示,符合正态分布的两组间均数比较采用t检验,相关性分析采用Pearson直线相关分析。P<0.05为差异有统计学意义。
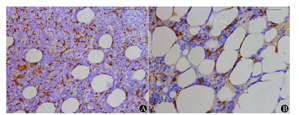
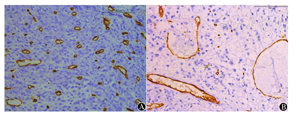
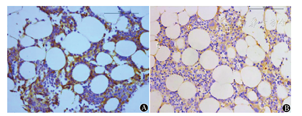
显微镜下观察发现:①CD163标记TAM阳性为胞质中出现黄色或棕黄色颗粒,MM患者染色多为强阳性,主要分布在瘤细胞周围,呈团簇状分布;对照组TAM散在分布,以血管周围居多(图1)。②CD34标记MVD阳性为血管内皮细胞胞浆呈棕黄色,MM患者骨髓MVD呈小管状、逗点状或条索状,可见许多细小分支;对照组骨髓中的MVD管腔大,分支少见,形态较成熟(图2)。③VEGF显色阳性为棕黄色或棕褐色,MM患者浆细胞胞质呈现出棕色颗粒,在部分细胞胞膜边缘呈棕色的深环状;对照组仅在血管内皮细胞中能够见到阳性表达,而在正常浆细胞中无阳性表达(图3)。



免疫组化法检测结果显示,与对照组比较,MM患者组骨髓组织中TAM浸润密度、MVD、VEGF表达水平明显升高,差异有统计学意义(P值均<0.001)(表1)。
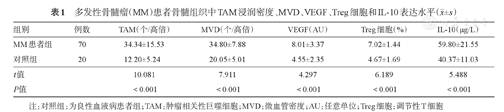
多发性骨髓瘤(MM)患者骨髓组织中TAM浸润密度、MVD、VEGF、Treg细胞和IL-10表达水平( ±s)
±s)
多发性骨髓瘤(MM)患者骨髓组织中TAM浸润密度、MVD、VEGF、Treg细胞和IL-10表达水平( ±s)
±s)
| 组别 | 例数 | TAM(个/高倍) | MVD(个/高倍) | VEGF(AU) | Treg细胞(%) | IL-10(μg/L) |
|---|---|---|---|---|---|---|
| MM患者组 | 70 | 34.34±15.53 | 34.80±7.88 | 8.01±3.37 | 7.02±1.44 | 59.80±21.55 |
| 对照组 | 20 | 12.20±5.24 | 20.05±5.01 | 4.55±2.35 | 4.67±1.69 | 40.37±11.03 |
| t值 | 10.081 | 7.911 | 4.297 | 6.189 | 5.488 | |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
注:对照组:为良性血液病患者组;TAM:肿瘤相关性巨噬细胞;MVD:微血管密度;AU:任意单位;Treg细胞:调节性T细胞
流式细胞术检测结果显示MM患者组骨髓组织中Treg细胞比例较对照组明显升高,差异有统计学意义(P<0.001)(表1)。ELISA法检测结果显示MM患者组骨髓组织中IL-10表达水平较对照组明显升高,差异有统计学意义(P<0.001)(表1)。
疾病稳定组患者的上述指标均较初诊组和复发难治组低(P值均<0.05);复发难治组与初诊组差异无统计学意义(P值均>0.05)(表2)。
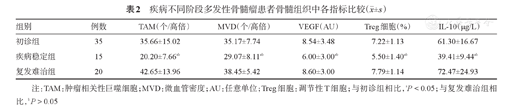
疾病不同阶段多发性骨髓瘤患者骨髓组织中各指标比较( ±s)
±s)
疾病不同阶段多发性骨髓瘤患者骨髓组织中各指标比较( ±s)
±s)
| 组别 | 例数 | TAM(个/高倍) | MVD(个/高倍) | VEGF(AU) | Treg细胞(%) | IL-10(μg/L) |
|---|---|---|---|---|---|---|
| 初诊组 | 35 | 35.66±15.02 | 35.17±7.74 | 8.54±3.48 | 7.22±1.13 | 61.30±16.67 |
| 疾病稳定组 | 15 | 20.20±7.66ab | 29.07±8.11ab | 6.00±3.00ab | 5.50±1.40ab | 39.41±9.44ab |
| 复发难治组 | 20 | 42.65±13.96 | 38.45±5.42 | 8.60±3.00 | 7.79±1.14 | 72.47±24.93 |
注:TAM:肿瘤相关性巨噬细胞;MVD:微血管密度;AU:任意单位;Treg细胞:调节性T细胞;与初诊组相比,aP<0.05;与复发难治组相比,bP>0.05
随访35例初诊MM患者,其中27例按期完成4个疗程治疗,治疗方案包括非硼替佐米方案[VAD(长春新碱+多柔比星+地塞米松)、CAD(环磷酰胺+表柔比星+地塞米松)方案]和硼替佐米方案(硼替佐米+地塞米松±沙利度胺)。有效组15例(CR 11例、PR 4例),无效组12例(PD 8例、缓解后复发4例)。有效组治疗后上述指标较治疗前明显下降,差异有统计学意义(P值均<0.05);无效组治疗前后差异无统计学意义(P值均>0.05)(表3)。
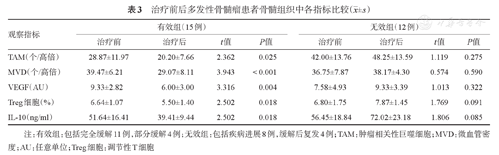
治疗前后多发性骨髓瘤患者骨髓组织中各指标比较( ±s)
±s)
治疗前后多发性骨髓瘤患者骨髓组织中各指标比较( ±s)
±s)
| 观察指标 | 有效组(15例) | 无效组(12例) | ||||||
|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后 | t值 | P值 | 治疗前 | 治疗后 | t值 | P值 | |
| TAM(个/高倍) | 28.87±11.97 | 20.20±7.66 | 2.362 | 0.025 | 42.00±13.76 | 48.25±13.59 | 1.119 | 0.275 |
| MVD(个/高倍) | 39.47±6.21 | 29.07±8.11 | 3.943 | <0.001 | 36.75±7.87 | 38.17±4.30 | 0.574 | 0.590 |
| VEGF(AU) | 9.33±2.82 | 6.00±3.00 | 3.316 | 0.004 | 7.58±4.93 | 9.33±3.39 | 1.013 | 0.322 |
| Treg细胞(%) | 6.64±1.07 | 5.50±1.40 | 2.502 | 0.018 | 6.80±1.75 | 7.87±1.45 | 1.769 | 0.091 |
| IL-10(ng/ml) | 51.64±16.41 | 39.41±9.44 | 2.502 | 0.018 | 56.45±18.84 | 72.02±23.18 | 1.806 | 0.085 |
注:有效组:包括完全缓解11例,部分缓解4例;无效组:包括疾病进展8例,缓解后复发4例;TAM:肿瘤相关性巨噬细胞;MVD:微血管密度;AU:任意单位;Treg细胞:调节性T细胞
35例初诊MM患者中位随访时间为6(2~10)个月。每2~4个疗程评估1次疗效,共纳入53次疗效评估。根据是否使用硼替佐米将患者分为两组,硼替佐米方案治疗有效组较非硼替佐米方案治疗有效组TAM浸润密度减低,差异无统计学意义(P=0.170)(表4)。
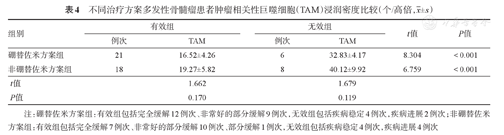
不同治疗方案多发性骨髓瘤患者肿瘤相关性巨噬细胞(TAM)浸润密度比较(个/高倍, ±s)
±s)
不同治疗方案多发性骨髓瘤患者肿瘤相关性巨噬细胞(TAM)浸润密度比较(个/高倍, ±s)
±s)
| 组别 | 有效组 | 无效组 | t值 | P值 | ||
|---|---|---|---|---|---|---|
| 例次 | TAM | 例次 | TAM | |||
| 硼替佐米方案组 | 21 | 16.52±4.26 | 6 | 32.83±4.17 | 8.304 | <0.001 |
| 非硼替佐米方案组 | 18 | 19.27±5.82 | 8 | 40.12±9.92 | 6.759 | <0.001 |
| t值 | 1.662 | 1.679 | ||||
| P值 | 0.170 | 0.119 | ||||
注:硼替佐米方案组:有效组包括完全缓解12例次、非常好的部分缓解9例次,无效组包括疾病稳定4例次,疾病进展2例次;非硼替佐米方案组:有效组包括完全缓解7例次、非常好的部分缓解10例次、部分缓解1例次,无效组包括疾病稳定4例次,疾病进展4例次
70例MM患者TAM浸润密度与骨髓组织MVD表达水平(r=0.647,P<0.001)、VEGF表达水平(r=0.796,P<0.001)、Treg细胞比例(r=0.825,P<0.001)及IL-10表达水平(r=0.818,P<0.001)均呈正相关。
近年来,新药的问世及治疗方案的不断改进显著提高了MM患者的疗效,中位生存期由原来的3~5年延长至5~7年[9],但MM仍是不可治愈的疾病,大部分患者最终仍会复发或是出现耐药进而导致患者死亡,故探索靶向治疗的方法以改善患者生活质量、延长生存期显得尤为必要。骨髓微环境提供了适合MM发生、发展的生存空间。TAM作为微环境中重要的炎性细胞,可分泌多种细胞因子和趋化因子,促进肿瘤的侵袭、浸润与转移,且与血管形成、免疫抑制及化疗耐药有关[10]。
Genin等[11]研究发现募集至肿瘤微环境的单核细胞在Th2细胞分泌的IL-4、IL-13、TGF-β的作用下分化为M2型巨噬细胞;Panchabhai等[12]发现冒烟型MM、意义未明的单克隆免疫球蛋白血症、初诊MM、疾病稳定期MM、复发MM患者中TAM浸润密度依次增加。我们在本研究中也发现MM患者骨髓组织中TAM浸润密度较良性血液病患者增多。提示MM患者骨髓微环境中确实存在TAM异常浸润,其在MM发病机制中可能有重要作用。进一步研究发现,疾病稳定组TAM浸润密度较初诊组及复发难治组明显下降,有效组治疗后TAM浸润密度较治疗前明显下降,而无效组治疗前后变化不明显,与Panchabhai等[12]的研究结果相似。Suyanı等[13]也提出因MM患者处于疾病不同阶段时的TAM浸润密度不同,故TAM可以作为评估疾病进展和临床预后的指标。我们根据是否使用硼替佐米对患者进行分组,结果显示硼替佐米方案治疗有效组较非硼替佐米方案治疗有效组TAM浸润密度减低,但由于例数较少,两者差异无统计学意义。有研究者将TAM与骨髓瘤细胞共同培养时,发现caspase3和PARP信号通路不易被激活,Bcl-xl表达较高,TAM可以通过以上途径阻断药物诱导的凋亡[2]。Musah等[14]研究发现硼替佐米和唑来膦酸同时使用可干扰TAM增殖、黏附和迁移,减少VEGF、成纤维细胞生长因子2(FGF-2)、肝细胞生长因子(HGF)和血小板衍生生长因子(PDGF)等细胞因子的分泌,降低FⅥ、Tie2/Tie和VEGF-2/VE-钙黏素等血管生长因子的表达,抑制VEGF-2和ERK1/2的磷酸化,下调NF-κB的活性。以上研究结果说明MM患者疗效与TAM浸润密度有关,TAM可以使骨髓瘤细胞逃避药物诱导的凋亡,硼替佐米治疗MM的良好疗效可能与其影响TAM增殖有关,阻断TAM可能成为MM的一种靶向治疗。
已有研究表明,TAM通过分泌VEGF促进骨髓瘤细胞的血管生成,同时其可诱导间质细胞分泌VEGF-C和VEGF-D,并通过与VEGFR结合刺激骨髓瘤细胞的生长[15]。Ribatti等[16]的研究结果也证实TAM通过"血管生成拟态"促进MM血管网的形成。本研究中MM患者骨髓组织中MVD及VEGF的表达水平较良性血液病患者明显升高;MVD、VEGF在MM患者疾病不同阶段及治疗4个疗程后的表达水平与TAM变化相一致;且MM患者骨髓微环境中TAM计数与MVD及VEGF表达水平呈正相关,进一步佐证了TAM可能通过分泌VEGF刺激内皮细胞增殖及微血管生成,从而增加肿瘤血供,促进MM的进展。
TAM通过分泌IL-10、PGE2、TGF-β等因子诱导Treg细胞浸润,而Treg细胞可抑制细胞毒性T细胞的杀瘤作用,促进肿瘤进展[17]。TAM高表达IL-10,低表达TNF-α、IL-1、IL-12而形成免疫抑制效应[18]。我们在研究中发现MM患者Treg细胞比例、IL-10水平较良性血液病明显升高,在MM疾病不同阶段及治疗4个疗程后的表达水平与TAM变化相一致,且MM患者TAM计数与Treg细胞比例、IL-10水平呈正相关,与Wang等[19]的研究结果相似。结合本研究结果,我们推测MM患者免疫抑制微环境可能与TAM导致的微环境中Treg细胞异常浸润及其分泌的抑制性细胞因子IL-10有关。
本研究结果初步证实TAM与MM发生、发展、疗效及治疗耐药有关,其作用机制可能与TAM促进骨髓瘤血管形成及抑制免疫反应有关。本研究时间较短且例数较少,相关结果有待后期扩大病例数进一步论证。针对TAM的靶向治疗(减少其在骨髓微环境中的浸润密度、抑制其促血管形成及免疫抑制功能、抑制其阻止药物诱导凋亡的功能)可能是治疗MM的一个有效途径。



























