
探讨芦可替尼(RUX)联合PTD方案(泼尼松+沙利度胺+达那唑)治疗骨髓纤维化(MF)的疗效和安全性。
对符合2016年WHO的MF诊断标准的MF患者,采用芦可替尼(RUX)联合PTD方案治疗,并评价该方案的临床疗效、血细胞计数变化和不良反应。
7例MF患者纳入研究,其中原发性骨髓纤维化(PMF)6例,原发性血小板增多症后骨髓纤维化(post-ET MF)1例;JAK2V617F突变4例,CARL突变1例,MPLW515突变1例,以上3种始动基因突变均阴性1例。7例患者治疗前均有肋缘下可触及的脾肿大。7例患者中5例获得临床改善,2例疾病稳定。7例患者均有不同程度的临床症状改善,6例患者有不同程度的脾脏缩小。3例患者接受芦可替尼单药治疗,均出现不同程度的血红蛋白浓度和血小板计数下降,改用芦可替尼联合PTD方案后血红蛋白浓度和血小板计数均明显上升。所有7例接受芦可替尼联合PTD方案治疗患者的血红蛋白浓度中位上升值为30(18~54)g/L,血小板计数中位上升值为116(13~369)×109/L,其中3例患者因血小板计数明显上升而调高芦可替尼剂量。全部7例患者均未发生血液学不良反应,未发生Ⅲ/Ⅳ级非血液学不良反应,Ⅰ/Ⅱ级非血液学不良反应包括便秘、腹胀、下肢水肿、丙氨酸转氨酶升高和齿龈感染各1例。
芦可替尼联合泼尼松、沙利度胺和达那唑治疗MF患者,可减少芦可替尼的血液学不良反应,使血红蛋白和血小板计数上升、提高临床疗效,且安全性好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
骨髓纤维化(MF)是一种Ph染色体阴性的髓系增生为特征的造血干细胞克隆性疾病。除原发性骨髓纤维化(PMF)外,还包括真性红细胞增多症后骨髓纤维化(post-PV MF)和原发性血小板增多症后骨髓纤维化(post-ET MF)[1]。芦可替尼是一种强效JAK1/JAK2抑制剂,我国参与的一项亚洲多个国家和地区的评价芦可替尼对亚洲MF患者有效性和安全性的Ⅱ期临床试验结果表明,芦可替尼能使大部分MF患者有不同程度的脾脏缩小,MPN-SAF-TSS症状评分降低,生活质量改善[2]。芦可替尼最常见的血液学不良事件包括贫血和血小板计数降低,进而导致患者需要减低剂量、暂时停药或输血。近期我们的一项研究结果表明,泼尼松联合沙利度胺和达那唑能使大部分MF患者贫血改善、血小板计数上升[3]。因此,我们开展了一项芦可替尼联合泼尼松、沙利度胺和达那唑治疗MF患者的探索性研究。
自2017年8月1日在中国医学科学院血液病医院就诊且符合以下条件的患者纳入研究:①年龄≥18岁;②符合2016年WHO的PMF和post-ET MF诊断标准;③外周血或骨髓原始细胞<10%;④有可触及的脾脏肿大;⑤治疗前3个月之内未接受过沙利度胺、泼尼松、雄激素、达那唑等药物治疗;⑥空腹血糖、肝肾功能正常,无周围神经病变及血栓病史。所有患者入组前完成以下检查以进行基线评估:血细胞计数及分类,完成MF症状评估表(MPN-SAF-TSS)[4]评估,骨髓穿刺细胞学检查,骨髓活组织病理检查和组织切片嗜银染色,染色体核型分析,JAK2V617F、CALR和MPL突变检测,心脏、肝脏和肾脏功能检查,并进行动态国际预后积分系统(DIPSS)预后评估[5]。
芦可替尼:PLT>200×109/L患者起始剂量为40 mg/d(分2次口服);PLT(100~200)×109/L患者起始剂量为30 mg/d(分2次口服);PLT(50~100)×109/L患者起始剂量为10 mg/d(分2次口服)。治疗过程中根据血小板计数调整芦可替尼剂量。调整剂量间隔至少2周,最大剂量为50 mg/d[1]。沙利度胺+泼尼松+达那唑:沙利度胺50 mg/d(睡前口服);泼尼松0.5 mg·kg-1·d-1(晨起顿服),3个月后根据疗效逐渐减量至停用;达那唑起始剂量为600 mg/d(分3次口服),依据肝功能检查结果调整剂量。
依据2013年的EUMNET和IWG-MRT共识疗效评价标准[6]进行疗效评估,包括完全缓解(CR)、部分缓解(PR)、临床改善(CI)、疾病进展(PD)、疾病稳定(SD)和复发。按照美国卫生及公共服务部、国立卫生研究院、国家癌症研究所联合发布的不良反应常用术语标准(CTCAE)4.03版进行不良反应评估。
患者入组治疗后前12周每周至少检查1次血常规、血糖和血压,每月检测1次肝、肾等脏器功能。通过门诊复查及电话联系进行随访,随访截止时间为2018年5月。
7例患者纳入研究,男4例,女3例,中位年龄55(36~58)岁。PMF患者6例,post-ET MF患者1例。JAK2V617F突变4例,CARL突变1例,MPLW515突变1例,3种始动基因突变均阴性1例。DIPSS预后分组:中危-1组2例,中危-2组4例,高危组1例。7例患者治疗前脾脏肋缘下均可触及,中位肋缘下长度为10(5~16)cm。患者治疗前血常规(中位数):HGB 87(57~144)g/L,ANC 7.99(1.42~21.68)×109/L,PLT 123(74~500)×109/L,2例患者治疗前存在红细胞输注依赖。根据患者的血小板计数,芦可替尼的起始剂量10、30、40 mg/d分别为2、3、2例。3例患者有芦可替尼单药治疗史,治疗过程中均出现明显的血红蛋白和血小板计数下降等血液学不良反应,后均改用芦可替尼联合PTD方案。4例患者诊断后即给予芦可替尼联合PTD方案治疗。详见表1。
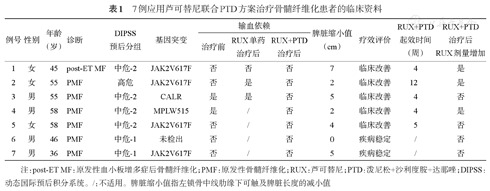
7例应用芦可替尼联合PTD方案治疗骨髓纤维化患者的临床资料
7例应用芦可替尼联合PTD方案治疗骨髓纤维化患者的临床资料
| 例号 | 性别 | 年龄(岁) | 诊断 | DIPSS预后分组 | 基因突变 | 输血依赖 | 脾脏缩小值(cm) | 疗效评价 | RUX+PTD起效时间(周) | RUX+PTD治疗后RUX剂量增加 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | RUX单药治疗后 | RUX+PTD治疗后 | ||||||||||
| 1 | 女 | 45 | post-ET MF | 中危-2 | JAK2V617F | 否 | 否 | 否 | 7 | 临床改善 | 4 | 是 |
| 2 | 女 | 55 | PMF | 高危 | JAK2V617F | 否 | 是 | 否 | 2 | 临床改善 | 12 | 是 |
| 3 | 男 | 55 | PMF | 中危-2 | CALR | 是 | 是 | 否 | 5 | 临床改善 | 4 | 否 |
| 4 | 男 | 58 | PMF | 中危-2 | MPLW515 | 是 | / | 否 | 2 | 临床改善 | 4 | 是 |
| 5 | 女 | 58 | PMF | 中危-2 | JAK2V617F | 否 | / | 否 | 4 | 临床改善 | 5 | 否 |
| 6 | 男 | 46 | PMF | 中危-1 | 未检出 | 否 | / | 否 | 0 | 疾病稳定 | / | 否 |
| 7 | 男 | 36 | PMF | 中危-1 | JAK2V617F | 否 | / | 否 | 5 | 疾病稳定 | / | 否 |
注:post-ET MF:原发性血小板增多症后骨髓纤维化;PMF:原发性骨髓纤维化;RUX:芦可替尼;PTD:泼尼松+沙利度胺+达那唑;DIPSS:动态国际预后积分系统。/:不适用。脾脏缩小值指左锁骨中线肋缘下可触及脾脏长度的减小值
依据2013年的EUMNET和IWG-MRT共识疗效评价标准,5例患者在治疗前均有不同程度贫血,应用芦可替尼联合PTD治疗后血红蛋白明显上升或脱离输血依赖,疗效评价为临床改善,中位起效时间为4(4~12)周;2例患者治疗前血常规大致正常,治疗后虽然血红蛋白和血小板均有不同程度上升,但仍评价为疾病稳定;全部患者中,6例有不同程度的脾脏缩小,中位肋缘下脾脏长度缩小值为4.5(2~7)cm,1例患者脾脏大小无变化(表1)。7例患者均有不同程度的临床症状改善,治疗前MPN-SAF-TSS评分为38(20~61)分,治疗后最低MPN-SAF-TSS评分为15(6~25)分,MPN-SAF-TSS评分降低中位值16(10~30)分,4例患者症状评分降低超过50%。
3例接受芦可替尼单药治疗的患者均出现不同程度的血红蛋白和血小板计数下降,其中1例由治疗前的非输血依赖变为红细胞输注依赖,2例患者因血小板计数明显下降而减低芦可替尼治疗剂量,该3例患者后期接受芦可替尼联合PTD方案治疗后,血红蛋白和血小板计数均明显上升,2例红细胞输注依赖患者均脱离红细胞输注(表2)。4例直接接受芦可替尼联合PTD方案治疗的患者,在治疗过程中不仅没有出现血红蛋白和血小板计数下降等血液学不良反应,反而均出现血红蛋白和血小板计数的升高。所有7例接受芦可替尼联合PTD治疗的患者,中位血红蛋白上升值为30(18~54)g/L,中位血小板计数升高值为116(13~369)×109/L,其中3例患者因血小板计数明显上升而提高芦可替尼剂量,其余4例患者血小板计数保持稳定,芦可替尼均维持起始剂量不变,所有7例患者在治疗过程中均未出现芦可替尼减量或停药;例1因血小板计数显著高于正常值而加用阿司匹林。7例接受芦可替尼联合PTD治疗的患者,ANC均波动于基线水平。
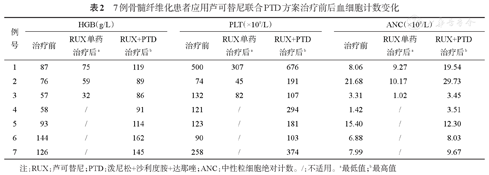
7例骨髓纤维化患者应用芦可替尼联合PTD方案治疗前后血细胞计数变化
7例骨髓纤维化患者应用芦可替尼联合PTD方案治疗前后血细胞计数变化
| 例号 | HGB(g/L) | PLT(×109/L) | ANC(×109/L) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | RUX单药治疗后a | RUX+PTD治疗后b | 治疗前 | RUX单药治疗后a | RUX+PTD治疗后b | 治疗前 | RUX单药治疗后a | RUX+PTD治疗后b | |
| 1 | 87 | 75 | 119 | 500 | 307 | 676 | 8.06 | 9.27 | 19.54 |
| 2 | 76 | 59 | 89 | 74 | 45 | 191 | 21.68 | 10.17 | 29.73 |
| 3 | 57 | 32 | 86 | 132 | 82 | 107 | 3.31 | 1.02 | 3.45 |
| 4 | 58 | / | 91 | 121 | / | 294 | 1.42 | / | 3.51 |
| 5 | 93 | / | 114 | 123 | / | 181 | 15.40 | / | 12.30 |
| 6 | 144 | / | 162 | 90 | / | 103 | 6.88 | / | 8.03 |
| 7 | 126 | / | 145 | 258 | / | 374 | 7.99 | / | 9.67 |
注:RUX:芦可替尼;PTD:泼尼松+沙利度胺+达那唑;ANC:中性粒细胞绝对计数。/:不适用。a最低值;b最高值
7例接受芦可替尼联合PTD治疗的患者均未出现血红蛋白和血小板计数下降等血液学不良反应,未出现Ⅲ/Ⅳ级非血液学不良反应,Ⅰ/Ⅱ级非血液学不良反应包括便秘1例、腹胀1例、下肢水肿1例、丙氨酸转氨酶(ALT)升高1例和齿龈感染1例,均经对症治疗后好转。ALT增高的患者在降低达那唑剂量和护肝治疗后,ALT恢复正常水平。没有患者因不良反应中断治疗。
MF的主要表现为骨髓进行性纤维化、进行性贫血、白细胞增多或减少、血小板增多或减少以及由髓外造血导致的巨脾,以及出现严重的体质性症状(乏力、盗汗、体重减轻、发热、骨痛等)。芦可替尼是一种强效JAK1/JAK2抑制剂,已被批准用于MF患者的一线治疗。美国和欧洲开展的随机对照研究(COMFORT-Ⅰ和COMFORT-Ⅱ)[7,8]以及我国参与的一项芦可替尼对亚洲MF患者有效性和安全性的Ⅱ期临床试验(诺华制药有限公司A2202研究,注册号NCT01392443)[2]结果表明,85.7%的MF患者有不同程度的脾脏缩小,53.1%的患者MPN-SAF-TSS症状评分降低超过50%,生活质量得到改善;芦可替尼最常见的血液学不良事件包括贫血和血小板计数降低,Ⅲ/Ⅳ级贫血、血小板计数降低、血小板减少症的发生率分别为47.6%、9.5%、3.2%。因此,在芦可替尼治疗MF过程中,需要严密监测血常规,及时给予红细胞输注纠正贫血,并根据血小板计数调整芦可替尼剂量,甚至暂时停药以减少血液学不良事件,这将影响芦可替尼缩脾和改善全身症状的疗效。
为了进一步改善和提高芦可替尼治疗MF的疗效,已有芦可替尼联合传统药物治疗MF的小系列临床研究报道。一项芦可替尼联合小剂量来那度胺(5 mg/d)治疗MF的研究结果表明,45%的患者因联合治疗导致的骨髓抑制和血液学不良事件早期中断治疗,继续联合治疗患者的缩脾疗效和芦可替尼单药治疗相似,该研究因而被提前终止[9]。另一项芦可替尼联合达那唑治疗MF患者的研究结果表明,14例患者中3例获得临床改善,1例获得部分缓解,5例血红蛋白升高超过10 g/L,5例患者血小板计数升高超过50×109/L,但分别有6例和4例患者出现血红蛋白和血小板下降等血液学不良反应[10],该研究初步表明芦可替尼联合达那唑治疗可在一定程度上缓解芦可替尼所致的血液学不良反应。
既往研究表明,传统剂量(>100 mg/d)的沙利度胺单药治疗MF患者贫血的有效率约为20%,但50%的患者不能耐受沙利度胺的不良反应而在3个月内中断治疗[11]。多项小样本研究表明,联合小剂量沙利度胺(50 mg/d)和泼尼松(0.5 mg·kg-1·d-1)治疗MF患者贫血的有效率约为50%,并能使部分有血小板减少的MF患者血小板计数上升,并且小剂量沙利度胺和泼尼松比传统剂量沙利度胺的耐受性好,没有患者因不良事件而中断治疗[12,13]。此外,还有研究发现,达那唑(600 mg/d)单药能使30%左右的MF患者贫血改善,使20%左右的有血小板减少的MF患者血小板计数上升[14]。我们近期完成的一项小剂量泼尼松联合小剂量沙利度胺和达那唑(PTD方案)治疗MF的研究结果表明,三药联合治疗疗效显著优于小剂量沙利度胺联合泼尼松的两药治疗方案,不仅能使71%的MF患者贫血改善,而且显著延长贫血改善的有效持续时间,使58%血小板减少MF患者的血小板计数上升超过50×109/L,而三药联合治疗并没有增加患者的不良反应[3]。
芦可替尼联合PTD方案治疗MF患者是否可减少芦可替尼的严重血液学不良事件发生、协同提高疗效和安全性呢?本研究7例患者中5例获得临床改善,2例疾病稳定。3例既往接受单药芦可替尼治疗出现血红蛋白或血小板减少等血液学不良反应的患者,在应用芦可替尼联合PTD方案治疗后均提高了血红蛋白和血小板水平。所有7例应用芦可替尼联合PTD方案治疗的患者不仅减少了芦可替尼所致的血液学不良反应,而且使血红蛋白和血小板计数上升,使3例红细胞输注依赖的患者脱离输血,并且3例患者在血小板升高的基础上提高了芦可替尼的治疗剂量,使芦可替尼的缩脾和改善全身症状达到最佳疗效。芦可替尼联合PTD治疗MF并未增加非血液学不良反应,患者耐受性好。芦可替尼联合PTD方案治疗MF患者的确切疗效和安全性有待于下一步开展前瞻性多中心临床研究和扩大样本量加以证实。



























