
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
骨髓增生异常综合征(MDS)是一组恶性克隆性干/祖细胞疾病,其主要特征为无效造血所致的难治性血细胞减少和易于向急性髓系白血病转化。该病主要发生于60岁以上人群,临床表现及预后差异性较大[1]。通过准确的预后评估,为不同危险分层的患者选择最适宜的治疗方案尤为重要。本文我们围绕现有MDS预后积分系统进行综述,旨在为MDS个体精准诊疗提供新思路。
20世纪80年代以来,多个关于MDS的预后积分系统被提出,得到最广泛认可的包括国际预后积分系统(IPSS)、基于WHO分型的预后积分系统(WPSS)和修订版国际预后积分系统(IPSS-R)[2]。
IPSS[3]是Greenberg等在1997年提出的,目前仍是判断患者能否进入来那度胺、阿扎胞苷、地西他滨等临床试验的标准[4]。但IPSS基于FAB分型、而非WHO分型系统是其主要缺陷;IPSS只针对原发初诊的MDS患者,无法判断骨髓增殖性疾病、继发于其他疾病或接受过治疗的MDS患者的预后;IPSS仅将血细胞减少(系)的数目作为评估变量,而忽视了血细胞减少严重程度的影响[3]。
选择最佳的预后积分系统对提高临床准确性和工作效率十分必要。2012年IPSS-R提出以来,有关各种积分系统效能比较的研究层出不穷,学者们从对初诊患者的预后评价能力、动态监测能力、临床试验患者排纳能力等多个方面比较这三个积分系统的适用性和准确性。在原发初诊患者的预后评价能力方面,IPSS-R能更准确地评估这类患者的总生存(OS)期[10]和无进展生存(PFS)期[15];特别是对于相对低危组患者,IPSS-R效能略强于WPSS,明显强于IPSS,是评价原发初诊患者的最佳选择。在动态监测能力方面,IPSS-R不仅可用于诊断时,也可用于来那度胺、去甲基化药物治疗MDS患者的动态监测,而且预测的准确度优于WPSS[10,16]。但是IPSS-R的评估作用只截止到移植前[17],而WPSS可预测移植后患者的OS、PFS、复发和非复发死亡[18]。在临床试验患者排纳能力方面,IPSS和IPSS-R强于WPSS已形成共识。但由于IPSS-R提出较晚,大多数MDS的临床试验还是采用IPSS来确定入组的患者[11],近年来才陆续有临床试验使用IPSS-R作为MDS患者的排纳标准[11]。
除了最常用的三个积分系统之外,相对低危预后积分系统(LR-PSS)[19]细化了IPSS的相对低危组(低危和中危-1),将IPSS中相对低危的患者重新划分成三个分组,更精确地评估了相对低危患者的预后。从现有文献来看,LR-PSS在评估相对低危患者OS方面的准确度略强于IPSS-R[20]。MD Anderson国际预后积分系统(MDA-CSS)[21]纳入了包含继发性MDS和骨髓增殖性疾病在内的1 915例患者,而且可以对患者实施动态监测,从而弥补IPSS-R的不足,但因其相对复杂且未被NCCN指南推荐,使得该系统普及程度不高。
为了进一步提高MDS预后积分系统的准确性,其策略是将影响预后的因素更多地纳入积分项中并赋予恰当的权重。如基因突变、年龄、ECOG评分、LDH等未能纳入到现有预后积分系统的因素,也与预后相关。特别是基因突变,因其与MDS的发生和表型密切相关[22],越来越受到关注,但基因突变的复杂性使其成为了提高MDS预后积分系统效能的最大难题。
随着高通量测序技术的发展,关于MDS基因层面的研究取得了极大的进展[22]。体细胞突变在MDS患者中非常常见,约90%的MDS患者存在至少1个基因突变,最常受累的是RNA剪切、DNA甲基化和染色质重塑相关基因,如SF3B1、TET2、SRSF2、ASXLl、DNMT3A和RUNXl等。
基因突变的信息十分复杂,不能仅用"有"或"无"来区分。在个体中,有的基因突变发生在大多数肿瘤细胞,而有的基因突变频率非常低,但基因突变对预后的影响和突变的频率不成正比[23];基因突变的方式也存在多样性,例如ASXL1主要出现无义突变或移码突变,而TET2除了无义突变和移码突变,还存在剪切位点改变和错义突变,将基因突变的频率和方式都考虑在内才能提高预后评估准确度。此外,基因之间存在共突变,预后良好和预后不良的基因同时突变,哪种突变起主导地位还未形成定论;多个不良预后基因同时突变,其结果是消失、叠加还是倍增,也尚未达成共识。另外,MDS基因突变与临床特征密切相关,若将基因突变纳入现有积分系统中,合理分配基因突变和临床变量的权重也较为困难。
(1)定性角度:指把基因突变的性质(不良预后突变或良好预后突变)作为影响预后的因素而进行的研究。2011年,Bejar等[24]在《新英格兰医学杂志》上发表了基因突变对MDS患者临床作用的研究,439例MDS患者被纳入队列,52%发生了基因突变,TP53、EZH2、ETV6、RUNX1和ASXL1这五个基因在纳入了年龄、性别和IPSS分层的多因素分析中表现出与OS期缩短相关,所以这五个基因被统称为"不良预后基因";发生不良预后基因突变患者的OS率与IPSS高一危险分层患者的OS率相似。由此,可先根据IPSS-R评分系统将患者进行预后分层,再根据有无不良预后基因突变,判断是否将患者划分入更高的危险分层。例如,IPSS-R中危患者存在不良预后基因突变,则将患者依照高危标准进行治疗。这种方法虽然简单,但缺乏准确性。由于这五个基因的相对危险度不同,TP53的HR接近2.5,而ASXL1的HR不足1.5,因此在预后评估中赋予不同基因相同权重仍欠合理。
(2)定量角度:指把基因突变的数量作为影响预后的因素而进行的研究。2013年,Papaemmanuil等[25]报道了一个含738例MDS患者的队列,对基因突变在预后中的作用进行探索。该研究将患者按基因突变数量分成6组(分别为1、2、3、4、5和≥6个突变),结果表明基因突变的数量(无论是预后不良或预后良好基因)与PFS期和OS期都呈负相关,尤其是基因突变≥6个的患者,PFS期明显缩短;而具体到每个基因,与预后的相关性则有限,可能与已纳入的临床指标削弱了基因突变的作用有关。此类研究仍缺乏准确性,基因突变数量≤5个时,不同分组之间的预后生存曲线存在许多交叉,不能有效区分各个分组。
(3)定性定量相结合角度:指把基因突变的性质和数量结合起来作为影响预后的因素而进行研究。Gangat等[26]采用这种基因突变分类方式,将之与临床特征相结合,使用多因素回归分析的方法排纳指标并赋予权重(表1)。这个模型相对简单,仅需要年龄、核型和基因三项指标就能够将患者分为低、中、高危三组,并有效区分患者预后。在染色体分型方面,该研究突出了单倍体异常的作用,却不如IPSS-R的染色体分型细致;此外,该模型尚未经过大型队列验证。
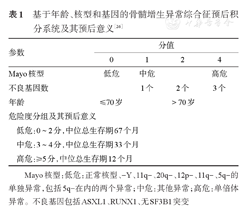
基于年龄、核型和基因的骨髓增生异常综合征预后积分系统及其预后意义[26]
基于年龄、核型和基因的骨髓增生异常综合征预后积分系统及其预后意义[26]
| 参数 | 分值 | ||||
|---|---|---|---|---|---|
| 0 | 1 | 2 | 4 | ||
| Mayo核型 | 低危 | 中危 | 高危 | ||
| 不良基因数 | 1个 | 2个 | 3个 | ||
| 年龄 | ≤70岁 | >70岁 | |||
| 危险度分组及其预后意义 | |||||
| 低危:0~2分,中位总生存期67个月 | |||||
| 中危:3~4分,中位总生存期33个月 | |||||
| 高危:≥5分,中位总生存期12个月 | |||||
Mayo核型:低危:正常核型、-Y、11q-、20q-、12p-、11q-、5q-的单独异常,包括5q-在内的两个异常;中危:其他异常;高危:单倍体异常。不良基因包括ASXL1、RUNX1、无SF3B1突变
(4)精准赋值角度:指通过统计学方法,精准权重、赋予分值、建立综合模型。与上述研究不同,Haferlach等[27]不是将基因按突变性质和突变数量进行分类分层,而是将具体的基因纳入其中,以期建立一种准确度更高的模型。该研究采纳了临床特征(年龄、性别、IPSS-R)和14个基因数据,将患者分为4组(低危、中危、高危、极高危),各组的3年OS率分别为95.2%、69.3%、32.8%和5.3%。随后,在175例患者组成的验证队列中证实,该模型的评估能力优于IPSS-R。2016年,Nazha等[28]发表了他们开发的预后评分模型,即:
总分=年龄×0.04+IPSS-R得分×0.3+EZH2×0.7+SF3B1×0.5+TP53×1
该模型将333例训练集患者分为4组,依次为低危组(总分≤3分),中危-1组(总分3.1~3.6分),中危-2组(总分3.7~4.6分),高危组(总分≥4.7分),4组中位OS期分别为37、23、19和12个月。在包含175例患者的验证队列中,该模型表现出了优于IPSS-R的评估效能。无论训练集还是验证集,均包含继发性MDS和骨髓增殖性疾病的患者,说明该模型对上述两种患者具有预后评估能力。此外,在随访过程中,随机挑选了53例患者进行配对和跟踪,证实该模型还具有良好的动态监测能力。但是,建立该模型所纳入的病例来自单中心,且验证队列人数较少,无法证实模型的普适性。2018年,Hou等[29]也开发了精准赋值的预后评分模型:
总分=年龄×0.025-IPSS-R相对低危组×1.184+CBL×0.829+IDH2×0.829+DNMT3A×0.452+ASXL1×0.442+TP53×2.254
该模型将患者分为4组,依次为低危(<-0.5分),中危(-0.5~0.5分),高危(0.51~1.5分),极高危(>1.5分),中位OS期分别为250、38、17和9个月。Hou等将该模型应用于328例WHO 2016分型的MDS患者中,证实该模型在OS期和无白血病生存期方面的预后评估效能优于IPSS-R。Nazha等和Hou等的积分模型都是以年龄、IPSS-R和基因突变为基础,但纳入的具体因素及其权重均有区别。Hou等的模型仅纳入了IPSS-R的相对低危组,而将突变频率更高的相对高危组排除在外,降低了基因突变和临床指标作用的重合度,有利于提高预后评价的准确性。但该模型不能用于评价骨髓增殖型疾病和继发性MDS患者,无动态监测能力,也未经过大规模队列验证。
目前MDS预后积分系统仍各存利弊,兼顾适用性、准确性的个体化预后评估工具仍有待探索。随着高通量测序技术和大数据分析手段的发展与应用,将基因组学信息视为与临床信息、细胞生物学信息同等重要的、独立的预后影响因素,赋予恰当的分值,纳入到积分系统中将是未来的研究方向,可能是实现MDS患者个体化精准诊疗的关键。


























