
评价脐血间充质干细胞(UC-MSC)在难治性重型再生障碍性贫血(RSAA)异基因造血干细胞移植(allo-HSCT)中的疗效及安全性。
回顾性分析郑州大学附属肿瘤医院2010年3月至2018年7月间接受UC-MSC联合同胞相合供者及无关供者)外周血干细胞移植的25例RSAA患者,其中同胞相合供者组10例,无关供者组15例。
25例患者中男13例,女12例。1例患者原发性植入失败,1例患者血小板植入不良,其余23例患者成功植入。粒细胞、血小板植入的中位时间分别为12.5(10~23)d、15(11~25)d。Ⅰ/Ⅱ度急性GVHD、慢性GVHD发生率分别为37.5%(9/24)、21.7%(5/23),未发生重度GVHD和严重移植相关并发症。中位随访22.9(1.6~107.8)个月,25例患者中4例死亡,21例(84%)存活,移植后5年总生存率为(83.6±7.5)%。
UC-MSC联合allo-HSCT治疗RSAA疗效确切、安全性好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
重型再生障碍性贫血(SAA)是严重危及患者生命的骨髓造血衰竭性疾病,造血干细胞移植(HSCT)和免疫抑制治疗(IST)是其主要的治疗手段[1,2]。环孢素A(CsA)联合抗胸腺细胞球蛋白(ATG)是SAA患者的标准一线IST方案,治疗有效率约70%,5年总生存(OS)率为60%~85%[1,2,3]。SAA患者IST后4~6个月仍未脱离输血或血象和骨髓象仍符合SAA标准,称为难治性SAA(RSAA)[4]。异基因造血干细胞移植(allo-HSCT)是RSAA的有效治疗方法。间充质干细胞(MSC)具有低免疫原性、促进造血、免疫调控的特点,动物及临床研究证实MSC与造血干细胞(HSC)共移植可预防GVHD、促进造血[5,6],因此MSC与HSC共移植可作为RSAA患者的治疗方法[7]。本中心应用同胞相合供者(MSD)及无关供者(UD)外周血干细胞(PBSC)联合脐血MSC(UC-MSC)共移植治疗25例RSAA患者,获得较好的疗效。
本回顾性研究纳入2010年3月至2018年7月在郑州大学附属肿瘤医院接受MSD- PBSC及UD-PBSC联合UC-MSC共移植的25例RSAA患者(表1),诊断标准符合文献[8]。根据供者来源分为MSD组和UD组,其中MSD组10例均为ATG无效/复发患者。所有患者及其监护人均签署移植相关风险同意书,本研究通过我院伦理审查委员会批准。采用高分辨基因分型检测方法,分别检测供者和患者的HLA-A、B、DR、DQ、Cw共10个位点,HLA相合情况见表1。所有患者均采用免疫抑制为主的减低剂量预处理方案,以氟达拉滨(Flu)+ATG+环磷酰胺(Cy)±白消安(Bu)±低剂量全身照射(TBI)为主(11例患者加用2~3 Gy TBI,4例患者加用Bu)。
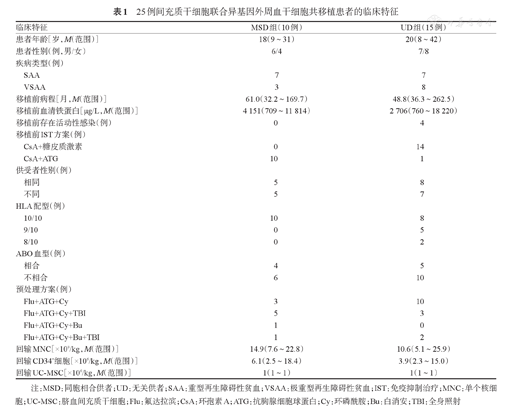
25例间充质干细胞联合异基因外周血干细胞共移植患者的临床特征
25例间充质干细胞联合异基因外周血干细胞共移植患者的临床特征
| 临床特征 | MSD组(10例) | UD组(15例) | |
|---|---|---|---|
| 患者年龄[岁,M(范围)] | 18(9~31) | 20(8~42) | |
| 患者性别(例,男/女) | 6/4 | 7/8 | |
| 疾病类型(例) | |||
| SAA | 7 | 7 | |
| VSAA | 3 | 8 | |
| 移植前病程[月,M(范围)] | 61.0(32.2~169.7) | 48.8(36.3~262.5) | |
| 移植前血清铁蛋白[μg/L,M(范围)] | 4 151(709~11 814) | 2 706(760~18 220) | |
| 移植前存在活动性感染(例) | 0 | 4 | |
| 移植前IST方案(例) | |||
| CsA+糖皮质激素 | 0 | 14 | |
| CsA+ATG | 10 | 1 | |
| 供受者性别(例) | |||
| 相同 | 5 | 8 | |
| 不同 | 5 | 7 | |
| HLA配型(例) | |||
| 10/10 | 10 | 8 | |
| 9/10 | 0 | 5 | |
| 8/10 | 0 | 2 | |
| ABO血型(例) | |||
| 相合 | 4 | 5 | |
| 不相合 | 6 | 10 | |
| 预处理方案(例) | |||
| Flu+ATG+Cy | 3 | 10 | |
| Flu+ATG+Cy+TBI | 5 | 3 | |
| Flu+ATG+Cy+Bu | 1 | 0 | |
| Flu+ATG+Cy+Bu+TBI | 1 | 2 | |
| 回输MNC[×108/kg,M(范围)] | 14.9(7.6~22.8) | 10.6(5.1~25.9) | |
| 回输CD34+细胞[×106/kg,M(范围)] | 6.1(2.5~18.4) | 3.9(2.3~15.0) | |
| 回输UC-MSC[×106/kg,M(范围)] | 1(1~1) | 1(1~1) | |
注:MSD:同胞相合供者;UD:无关供者;SAA:重型再生障碍性贫血;VSAA:极重型再生障碍性贫血;IST:免疫抑制治疗;MNC:单个核细胞;UC-MSC:脐血间充质干细胞;Flu:氟达拉滨;CsA:环孢素A;ATG:抗胸腺细胞球蛋白;Cy:环磷酰胺;Bu:白消安;TBI:全身照射
所有患者均应用CsA、霉酚酸酯(MMF)、短程甲氨蝶呤(MTX)预防GVHD。从干细胞回输前1周开始,给予CsA 2.5~3.0 mg·kg-1·d-1静脉滴注,恶心、呕吐等症状好转后改为口服4.5~5.5 mg·kg-1·d-1至少1年,维持血药浓度200~400 μg/L,根据GVHD情况进行个体化剂量调整。MMF从干细胞回输后第1天开始口服,成人1.0 g/d,儿童0.5 g/d,+30 d开始减量,+60 d减停。MTX 10 mg/m2于移植后第1、3、6、11天静脉给药。
所有患者均住百级层流病房,预处理前1周始给予肠道抗菌药物预防肠道感染、复方磺胺甲 唑片预防卡氏肺孢子虫病、更昔洛韦预防巨细胞病毒(CMV)感染,预防性应用抗真菌药物。预处理过程中加强水化、碱化尿液,预防出血性膀胱炎;静脉应用前列腺素E1预防肝静脉闭塞病(VOD)。移植期间输注的红细胞及血小板均经辐照处理。
唑片预防卡氏肺孢子虫病、更昔洛韦预防巨细胞病毒(CMV)感染,预防性应用抗真菌药物。预处理过程中加强水化、碱化尿液,预防出血性膀胱炎;静脉应用前列腺素E1预防肝静脉闭塞病(VOD)。移植期间输注的红细胞及血小板均经辐照处理。
PBSC的动员和采集均根据中华骨髓库制定的标准,全部25例患者中位单个核细胞(MNC)输注量为11.7(5.1~25.9)×108/kg,中位CD34+细胞输注量为4.9(2.3~18.4)×106/kg。UC-MSC来自天津昂赛细胞基因工程有限公司。PBSC输注结束后6 h输注UC-MSC 1×106/kg。
以外周血中性粒细胞绝对计数>0.5×109/L连续3 d为粒细胞植入,PLT>20×109/L连续7 d且脱离血小板输注为血小板植入。采用DNA短串联重复序列-聚合酶链式反应(STR-PCR)检测嵌合体,嵌合体中供者成分>95%、5%~95%分别定义为完全供者嵌合体、混合嵌合体,低于5%为植入失败。采用门诊复查的方式,随访至2019年1月20日。OS时间定义为HSC回输至随访截止或任何原因所致死亡的时间。
应用SPSS 19.0统计软件进行数据分析。计数资料以例数和百分率表示,OS率分析采用Kaplan-Meier法。
25例患者中,UD组1例患者原发性植入失败(+30 d供者嵌合率为31%,+37 d为0),至今造血未重建,仍为SAA疾病状态,输血依赖;MSD组1例患者+22 d粒细胞植入,至+41 d患者死亡时血小板仍未植入。MSD组1例患者回输同胞PBSC后造血重建较慢,+17 d嵌合率95%,+18 d回输UC-MSC,+25 d嵌合率20.57%,行二次移植,先后回输同胞PBSC和UC-MSC,二次移植后13 d粒细胞植入,14 d血小板植入,嵌合率100%。其余22例患者在回输后30 d内检测嵌合率均为完全嵌合。随访中,植入成功的23例患者中,仅UD组1例混合嵌合(65.8%~92.5%),其余22例患者持续保持完全嵌合状态。MSD组粒细胞、血小板植入的中位时间分别为13(11~23)d、12(11~22)d,UD组分别为12(12~18)d、15.5(11~25)d。详见表2。
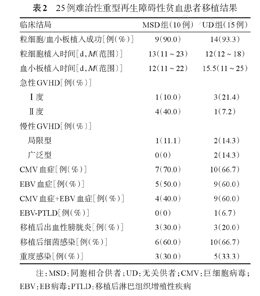
25例难治性重型再生障碍性贫血患者移植结果
25例难治性重型再生障碍性贫血患者移植结果
| 临床结局 | MSD组(10例) | UD组(15例) | |
|---|---|---|---|
| 粒细胞/血小板植入成功[例(%)] | 9(90.0) | 14(93.3) | |
| 粒细胞植入时间[d,M(范围)] | 13(11~23) | 12(12~18) | |
| 血小板植入时间[d,M(范围)] | 12(11~22) | 15.5(11~25) | |
| 急性GVHD[例(%)] | |||
| Ⅰ度 | 1(10.0) | 3(21.4) | |
| Ⅱ度 | 4(40.0) | 1(7.2) | |
| 慢性GVHD[例(%)] | |||
| 局限型 | 1(11.1) | 2(14.3) | |
| 广泛型 | 0(0) | 2(14.3) | |
| CMV血症[例(%)] | 7(70.0) | 10(66.7) | |
| EBV血症[例(%)] | 5(50.0) | 9(60.0) | |
| CMV血症+EBV血症[例(%)] | 4(40.0) | 9(60.0) | |
| EBV-PTLD[例(%)] | 0(0) | 1(6.7) | |
| 移植后出血性膀胱炎[例(%)] | 3(30.0) | 3(20.0) | |
| 移植后细菌感染[例(%)] | 6(60.0) | 10(66.7) | |
| 重度感染[例(%)] | 3(30.0) | 5(33.3) | |
注:MSD:同胞相合供者;UD:无关供者;CMV:巨细胞病毒;EBV:EB病毒;PTLD:移植后淋巴组织增殖性疾病
预处理过程顺利,未发生预处理相关的肠道、肝脏、肾脏不良反应,供者干细胞及UC-MSC回输顺利。25例患者中16例(64%)发生移植后细菌感染,包括粒细胞缺乏期感染、血流感染、皮肤软组织感染等,其中重度感染8例(32%)(MSD组3例,UD组5例),4例患者死亡。17例(68%)患者发生CMV血症,14例(56%)患者发生EB病毒(EBV)血症,13例(52%)患者同时存在CMV血症、EBV血症,经更昔洛韦、阿昔洛韦、大剂量静脉丙种球蛋白治疗后病毒转阴,其中UD组2例进展为CMV病(肺CMV感染,抗病毒治疗后痊愈),UD组1例患者进展为EBV相关移植后淋巴组织增殖性疾病(PTLD),经联合利妥昔单抗治疗后痊愈。出血性膀胱炎(HC)6例(24%),尿多瘤病毒检测均为高滴度(>1×103/拷贝),给予水化、碱化、抗病毒等治疗后5例痊愈,UD组1例给予二次回输UC-MSC后痊愈。未发生VOD、毛细血管渗漏综合征、移植相关性血栓性微血管病(TMA)。详见表2。
除外1例原发性植入失败的患者,共9例(37.5%)发生急性GVHD(MSD组5例,UD组4例),中位发生时间为26(4~60)d,均为Ⅰ/Ⅱ度急性GVHD,给予糖皮质激素、MTX、CsA、Ⅱ型TNF受体-抗体融合蛋白等免疫抑制剂治疗后均完全控制。除外+100 d内死亡的1例患者及1例植入失败患者,共5例(21.7%)发生慢性GVHD(MSD组1例,UD组4例),中位发生时间为210(141~240)d,其中局限型3例,广泛型2例,给予糖皮质激素、他克莫司、MMF等免疫抑制剂治疗后4例患者症状得到控制,UD组1例患者移植后持续蛋白尿(24 h尿蛋白定量3~5 g),肾脏穿刺活检病理示"系膜增生性肾小球病伴缺血性肾损伤" ,加用环磷酰胺等免疫抑制剂后得到控制。详见表2。
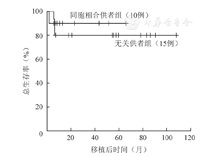
所有患者中位随访时间为22.9(1.6~107.8)个月,无失访病例。随访期内4例(16%)患者死亡(MSD组1例,UD组3例),死亡原因分别为肺感染+心肾功能衰竭+植入不良+肠道Ⅱ度急性GVHD+消化道出血、肺感染+脓毒症+感染性休克、肺感染+心衰、肺感染+颅内出血。存活的21例患者中1例植入失败,目前带病生存,其余20例患者造血重建后生存状态良好。全部25例患者5年OS率为(83.6±7.5)%,MSD组、UD组移植后5年OS率分别为(90.0±9.5)%、(80.0±10.3)%。随访期内所有患者平均生存时间为91.0(95%CI 75.9~106.1)个月。MSD组、UD组OS曲线见图1。

CsA联合ATG是SAA患者的标准IST方案,有效率约70%,IST后5年OS率为60%~85%[2,3,11]。MSC是从骨髓、外周血、脐血、胎盘或其他组织(如肺、肌肉等)分离获得的具有干细胞样生物学特性基质细胞群体,其生物学特性包括:体外培养条件下对塑料具有黏附性、多向分化潜能、低免疫原性(不表达MHC-Ⅱ类分子和Fas配体,不表达或者低表达MHC-I类分子,也不表达CD80、CD86、CD40、CD40L等共刺激分子)、免疫调控和自我更新能力[12,13]。以动物实验和临床研究为基础,目前MSC已广泛应用于血液病的治疗,尤其是造血干细胞移植,可促进HSC植入、治疗植入失败、植入不良以及预防和改善GVHD[6]。Meuleman等[14]对移植后植入不良的6例患者输注MSC,其中2例造血功能很快恢复。欧洲一项大型多中心研究应用MSC治疗糖皮质激素耐药的急性GVHD,55例患者中30例完全缓解(CR),9例部分缓解(PR)[15]。Lazarus等[16]应用同胞来源的MSC与HSC共移植治疗血液系统恶性肿瘤,统计结果表明,MSC能促进移植后造血功能的恢复,可显著降低急性GVHD的发生率。一些小样本量研究结果显示,仅输注MSC治疗RSAA具有较好的安全性,但造血反应率仅为20%~35%[17,18],与行二次挽救性IST有效率相当。Si等[19]应用UC-MSC联合allo-HSCT治疗37例儿童SAA患者,粒细胞、血小板植入中位时间分别为14(11~20)d、19(14~29)d,急、慢性GVHD发生率分别为45.9%、18.9%,3年OS率为74.2%。Fu等[20]对5例病史>5年的VSAA患者行UD-HSC联合UC-MSC共移植,4例造血重建,未发生重度GVHD和移植相关并发症。我中心的25例RSAA患者虽病史较长、移植前身体状态差,但移植后中位随访22.9(1.6~107.8)月,仍存活21例,5年OS率为(83.6±7.5)%。
移植后GVHD和植入失败是影响SAA患者allo-HSCT疗效的主要并发症。MSC在体内外均可抑制T细胞、B细胞、树突状细胞、自然杀伤细胞的增殖,可促进造血重建、预防移植物排斥和GVHD的发生,还可用于治疗GVHD[21]。Deeg等[22]回顾分析了87例RSAA患者行UD-HSCT的疗效,HLA全相合组Ⅱ~Ⅳ度急性GVHD、慢性GVHD发生率分别为69%、52%,HLA 1~3位点不合组Ⅱ~Ⅳ度急性GVHD、慢性GVHD发生率分别为77%、57%。Lee等[23]报道了50例(46例为ATG联合CsA治疗失败/无效)行UD-HSCT的SAA患者,Ⅱ~Ⅳ度急性GVHD和慢性GVHD发生率分别为46%、50.3%。本研究急、慢性GVHD的发生率分别为37.5%、21.7%,均在给予免疫抑制剂后得到有效控制,且无重度GVHD的发生,GVHD发生情况与相关文献报道[19,20]一致,比Deeg等[22]和Lee等[23]的报道(仅回输HSC)显著降低。MSD组粒细胞、血小板植入的中位时间分别为13 d、12 d,UD组分别为12 d、15.5 d,比陈欣等[24]报道的显著缩短。1例患者发生原发性植入失败,可能与病史长达16年、输血量大、供受者ABO血型不合、无关供者、HLA抗原8/10有关。以往研究表明,植入延迟与活动性感染有关[25]。MSD组1例患者造血重建前即合并较重的肺部感染,导致植入延迟,+22 d粒系植入,直至+49 d患者死亡血小板仍未植入。Le Blanc等[26]报道了3例行HSCT(仅回输HSC)后植入失败的病例,再次行MSC与HSC共移植后均达到造血重建。本组病例中,1例患者第一次仅回输同胞PBSC,+25 d查嵌合率20.57%,行二次移植,先后回输同胞PBSC和UC-MSC,粒细胞、血小板分别于+13、+14 d植入,嵌合率100%。
值得注意的是,移植后重度细菌感染8例(32%),且直接/间接(部分患者因肺部感染导致心力衰竭、呼吸衰竭死亡,部分患者因感染治疗过程中的并发症死亡)导致了4例患者的死亡。CMV血症、EBV血症发生率分别为68%、56%,两种病毒血症并存占52%,UD组1例患者发展为EBV相关PTLD,可能与其病史长达8年、长期IST、HLA抗原8/10及预处理应用ATG有关。以往研究显示,MSC免疫抑制的特点会导致机体对移植后感染的免疫反应受到抑制,进而使感染相关风险增加[14,27]。Sundin等[27]研究表明,MSC可能会感染CMV且病毒DNA无法在体外培养的MSC中检测到,加之MSC会抑制淋巴细胞增殖,从而使机体抗病毒能力下降。但Karlsson等[28]的体外研究显示,MSC并不能抑制病毒特异性T淋巴细胞的增殖。也有研究显示,移植后感染可能与早期免疫重建不佳、GVHD的发生、激素的长期应用有关,与MSC输注的相关性并不作为首要考虑[26,28]。HC与预处理相关药物(尤其是环磷酰胺)导致膀胱黏膜上皮损伤有关,MSC可参与组织修复过程[29]。本研究UD组1例Ⅳ度HC患者水化、碱化、抗病毒治疗无效,在二次输注UC-MSC后病情很快好转。
对于移植前存在活动性感染且抗感染治疗无效的患者,通过移植达到快速的粒细胞、血小板植入尤为重要。而MSC能调节骨髓微环境、促进造血[5,6,21],因此联合MSC的HSCT能达到快速造血重建[30]。移植前存在活动性感染的4例患者全部造血重建,重建时间无明显延迟,其中2例患者因粒细胞植入,抗感染治疗有效而获得良好生存。
本回顾性研究结果显示,MSD-PBSC/UD-PBSC联合UC-MSC共移植治疗RSAA安全可行,但仍需扩大样本量、进行随机双盲对照临床试验加以验证。



























