
探讨符合WHO(2016)诊断分型标准的骨髓增生异常综合征(MDS)5q-综合征患者的临床特征、来那度胺(LEN)疗效和生存情况。
回顾性分析2008年1月至2018年4月于中国医学科学院血液病医院就诊的77例符合WHO(2016)诊断分型标准的MDS 5q-综合征患者临床资料,比较单纯5q-与5q-伴1个非-7/7q-的其他染色体异常(ACA)患者临床特征、疗效及生存情况,并比较LEN与非LEN药物治疗的疗效与生存情况。
77例患者中,单纯5q-者64例,5q-伴ACA者13例,确诊时5q-伴ACA患者的中位年龄显著低于单纯5q-患者[58(29~64)岁对63(31~82)岁,z=2.164,P=0.030]。5q-伴ACA患者CD41免疫组化染色小巨核细胞(直径≤40 μm)检出率(91.7%,11/12)显著高于单纯5q-患者(60.0%,33/55)(P=0.046)。可评估LEN疗效的29例患者中,单纯5q-患者(19例)与5q-伴ACA患者(10例)血液学总反应率(78.9%对80.0%)、血液学完全缓解(CR)率(57.9%对60.0%)、细胞遗传学反应(CyR)率[69.2%(9/13)对66.7%(4/6)]、完全细胞遗传学反应(CCyR)率[61.5%(8/13)对33.3%(2/6)]相当。单纯5q-与5q-伴ACA患者中位总生存(OS)时间差异无统计学意义(62个月对78个月,P=0.313)。29例LEN组患者的血液学总反应率(79.3%对36.0%)、CR率(58.6%对8.0%)、CyR率[68.4%(13/19)对11.1%(1/9)]、CCyR率[52.6%(10/19)对0(0/9)]均高于非LEN组患者(25例),但两组患者中位OS时间差异无统计学意义(78个月对62个月,P=0.297)。
单纯5q-与5q-伴ACA患者临床特征大体相似,两组患者LEN疗效、中位OS时间无明显差异。LEN治疗5q-综合征患者的疗效肯定,优于非LEN药物。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
骨髓增生异常综合征(MDS)初诊患者染色体核型异常检出率约50%,5号染色体长臂缺失(5q-)是MDS最常见的染色体核型异常之一,初诊MDS患者5q-染色体异常检出率为10%~20%[1,2]。骨髓原始细胞<5%的MDS伴5q-患者具有特殊的临床特征,称之为5q-综合征。
WHO(2001)分型将染色体核型异常为单纯5q-、骨髓原始细胞<5%、外周血原始细胞<1%的MDS患者归为"MDS伴孤立性5q-"(也称5q-综合征)。随后研究发现除5q-外,伴有1个非-7/7q-的其他染色体异常(ACA)的MDS患者,其预后与伴单纯5q-的MDS患者无明显差异[3,4]。因此,WHO(2016)分型将5q-外伴ACA的患者也归于5q-综合征[5]。
既往一系列临床试验[6,7,8]及回顾性分析[9,10]均提示来那度胺(LEN)治疗5q-综合征患者疗效肯定,已推荐为5q-综合征患者的首选治疗药物。
本研究我们回顾性分析77例符合WHO(2016)分型标准的MDS 5q-综合征患者的临床资料。现将其临床特征、疗效及生存情况报道如下。
回顾性分析2008年1月至2018年4月就诊于中国医学科学院血液病医院的MDS病例资料,根据其骨髓及外周血涂片血细胞分类计数、染色体核型、骨髓单个核细胞流式细胞术免疫分型等实验室检查结果,按WHO(2016)分型标准重新进行诊断和分型,77例符合MDS 5q-综合征的患者纳入分析。骨髓细胞短期培养法,收集细胞常规制片,应用R显带技术进行常规染色体核型分析。每例患者至少分析20个中期分裂象,依据《人类细胞遗传学国际命名体制(ISCN2013)》标准进行核型描述。至少2个细胞分裂象具有相同的染色体增加或结构异常,或者3个细胞分裂象具有相同的染色体丢失确认为1个异常克隆。参照文献[11]方法进行二代测序分析基因突变情况。
共有32例患者接受了LEN治疗,其中29例可评估疗效(LEN组)。共有28例接受非LEN药物治疗,其中25例可评估疗效(非LEN组)。不可评估疗效的原因包括失访、用药<2个月、仅服用中药或仅输血支持治疗。LEN组:LEN 10 mg/d,口服,连用21 d,停7 d,28 d为1个疗程。如患者出现≥3级血细胞减少,药物适当减量或暂停,根据情况适当延迟下一疗程。非LEN组治疗药物包括EPO、雄激素(司坦唑醇、达那唑、十一酸睾酮)、免疫抑制或调节药物(沙利度胺、环孢素A、糖皮质激素)单药或联合治疗。
治疗反应标准参照2006版国际工作组(IWG)的MDS治疗反应标准[12],血液学反应包括完全缓解(CR)、部分缓解(PR)和血液学改善(HI),以患者治疗期间达到的最佳疗效来进行疗效评价。细胞遗传学反应(CyR)包括完全细胞遗传学反应(CCyR)和部分细胞遗传血反应(PCyR)。血液学总反应率为CR、PR和HI率之和。不良反应分级根据美国国立肿瘤研究所常见毒性标准(Version 4.0)进行判定。ANC<0.5 × 109/L定义为粒细胞缺乏。
随访时间从疾病确诊之日起,至2019年5月31日。通过住院病历、门诊病历及电话进行随访。对随访期间死亡的病例,以病历记录和(或)患者家属电话联系加以确认。总生存(OS)时间按确诊日期至随访结束日期或死亡日期计算。
使用SPSS 22.0软件进行统计学分析。偏态分布计量资料描述为中位数(范围),采用Mann-Whitney U检验进行组间比较;率的比较采用Fisher确切概率法。生存分析的单因素分析采用Kaplan-Meier法,各组生存曲线的比较采用Logrank检验;多因素分析采用Cox等比例风险模型。P<0.05为差异有统计学意义。
男23例(29.9%),女54例(70.1%),确诊时中位年龄为62(29~82)岁。64例(83.1%)患者染色体核型异常为单纯5q-,13例(16.9%)染色体核型异常为5q-伴ACA(表1)。确诊时HGB中位水平为67(34~126)g/L,WBC中位数为3.51(0.95~13.32)× 109/L,ANC中位数为2.03(0.34~9.53)× 109/L,PLT中位数为278(17~1 000)×109/L。68例(88.3%)患者PLT≥100×109/L,36例(46.8%)PLT≥300×109/L,23例(29.8%)患者PLT≥450×109/L,7例(9.1%)PLT≥600×109/L。按修订国际预后积分系统(IPSS-R)预后分组:极低危组占5.6%(4/72),低危组占73.6%(53/72),中危组占20.8%(15/72)。21例患者有可供分析的二代测序基因突变结果,中位基因突变数目为3(0~5)个,突变频率较高的基因包括:TP53(28.6%,6例)、U2AF1(19.0%,4例)、SETBP1(14.3%,3例)和ASXL1(14.3%,3例)。单纯5q-与5q-伴ACA患者临床特征比较见表2,单纯5q-患者的中位年龄[63(31~82)岁]显著高于5q-伴ACA患者[58(29~64)岁](P=0.030);5q-伴ACA患者CD41免疫组化染色小巨核细胞(直径≤ 40 μm)检出率(91.7%,11/12)显著高于单纯5q-患者(60.0%,33/55)(P=0.046)。两组患者其他临床指标差异均无统计学意义。

按WHO(2016)分型标准确诊的5q-综合征中13例5q-伴ACA患者的染色体核型
按WHO(2016)分型标准确诊的5q-综合征中13例5q-伴ACA患者的染色体核型
| 例号 | 染色体核型 |
|---|---|
| 1 | 47,XX,del(5)(q13q33),+21[5]/46,XX,del(5)(q13q33)[10] |
| 2 | 46,XY,t(2;11)(p21;q23),del(5)(q13q33)[7]/46,XY[2] |
| 3 | 46,XY,del(5)(q13q33),der(13)t(1;13)(q10;q10)[4]/46,XY,del (5)(q13q33)[13] |
| 4 | 46,XX,del(5)(q13),del(8)(q13)[3]/46,XX,del(5)(q13)[15]/ 46,XX[2] |
| 5 | 46,XX,del(2)(q34),del(5)(q31)[17]/46,XX[3] |
| 6 | 46,XY,5q-,+21[10]/46,XY[9] |
| 7 | 47,XX,del(5)(q13),+9[1]/46,XX,del(5)(q13)[10] |
| 8 | 46,XX,del(5)(q32),14ps+[9]/46,XX,14ps+[1] |
| 9 | 46,XY,del(5)(q13)[10]/46,XY,?+8,del(5)(q13)[1]/46,XY[9] |
| 10 | 46,XY,del(5)(q32),?i(17)(q10),inc[19]/46,XY[1] |
| 11 | 46,XY,del(5)(q13q33),der(17)[4]/46,XY,del(5)(q13q33)[16] |
| 12 | 47,XY,del(5)(q22)[12]/47,XY,idem,+21[5]/46,XY[3] |
| 13 | 46,XX,del(3)(p21),del(5)(q13q33)[17]/46,XX[3] |
注:ACA:(除5q-外)1个非-7/7q-的其他染色体异常

单纯5q-与5q-伴ACA的骨髓增生异常综合征患者基线临床特征比较
单纯5q-与5q-伴ACA的骨髓增生异常综合征患者基线临床特征比较
| 临床特征 | 单纯5q-组(64例) | 5q-伴ACA组(13例) | 统计量 | P值 | |
|---|---|---|---|---|---|
| 年龄[岁,M(范围)] | 63(31~82) | 58(29~64) | -2.164 | 0.030 | |
| 女性[例(%)] | 48(75.0) | 6(46.2) | 0.051 | ||
| HGB[g/L,M(范围)] | 67.5(34~126) | 64(45~92) | -0.054 | 0.960 | |
| WBC[×109/L,M(范围)] | 3.53(1.38~13.32) | 3.13(0.95~7.40) | -1.142 | 0.258 | |
| ANC[×109/L,M(范围)] | 2.15(0.62~9.53) | 1.46(0.34~4.90) | -1.550 | 0.123 | |
| PLT[×109/L,M(范围)] | 309(17~844) | 179(13~980) | -0.422 | 0.680 | |
| MCV[fl,M(范围)] | 103.0(67.7~120.8) | 103.0(84.8~115.4) | -1.724 | 0.085 | |
| 骨髓原始细胞比例[%,M(范围)] | 1.5(0~4.0) | 1.5(0~3.5) | -0.701 | 0.490 | |
| CD41免疫组化染色小巨核细胞检出情况[阳性例数/检测例数(%)] | 33/55(60.0) | 11/12(91.7) | 0.046 | ||
| 5号染色体长臂缺失区域[阳性例数/检测例数(%)] | 0.070 | ||||
| q13q33 | 41/61(67.2) | 5/12(41.7) | |||
| q31 | 9/61(14.8) | 1/12(8.3) | |||
| q13 | 4/61(6.5) | 1/12(8.3) | |||
| 其他区域 | 7/61(11.5) | 5/12(41.7) | |||
| IPSS-R分组[阳性例数/有效例数(%)] | 0.354 | ||||
| 极低危组 | 4/60(6.7) | 0/12(0.0) | |||
| 低危组 | 42/60(70.0) | 11/12(91.7) | |||
| 中危组 | 14/60(23.3) | 1/12(8.3) | |||
注:ACA:(除5q-外)1个非-7/7q-的其他染色体异常;MCV:红细胞平均体积;IPSS-R:修订国际预后积分系统
可评价疗效54例患者中位治疗17(2~84)个月,其中32例(53.9%)获得血液学反应,CR率为35.2%(19/54),HI率为24.1%(13/54)(均为红系反应)。共28例患者治疗后复查至少有1次染色体核型结果可供分析,该28例患者CyR率为50.0%(14/28),CCyR率为35.7%(10/28),PCyR率为14.3%(4/28)。
5例(9.3%)患者进展为急性髓系白血病(AML),4例(7.4%)进展为MDS伴原始细胞增多-1或2(MDS-EB-1或MDS-EB-2)。21例有二代测序结果的患者中,6例TP53突变的患者均没有疾病进展,15例无TP53突变的患者中2例进展为AML。疾病进展的9例患者中,4例后续行化疗[1例为地西他滨,1例为阿扎胞苷,1例为地西他滨联合CAG方案(阿克拉霉素+阿糖胞苷+G-CSF),1例为CAG],4例仅输血支持治疗,1例进展为MDS-EB-1的患者继续服用LEN,获得HI,但没有获得CyR。
应用LEN治疗的单纯5q-患者19例可评估血液学疗效,LEN中位治疗14(3~84)个月,血液学总反应率为78.9%(15/19),CR率为57.9%(11/19),HI率为21.1%(4/19)。13例单纯5q-的患者LEN治疗后可评估细胞遗传学反应,总CyR率为69.2%(9/13),其中CCyR率为61.5%(8/13),PCyR率为7.7%(1/13)。应用LEN治疗的5q-伴ACA患者10例可评估血液学疗效,LEN中位治疗18(2~70)个月,血液学总反应率为80.0%(8/10),CR率为60.0%(6/10),HI率为20.0%(2/10)。6例5q-伴ACA患者LEN治疗后可评估细胞遗传学反应,CyR率为66.7%(4/6),CCyR率为33.3%(2/6),PCyR率为33.3%(2/6)。两组患者血液学总反应率、CR率、总CyR率相近。
15例LEN治疗有效的单纯5q-患者,治疗过程6例复发,1例进展为MDS-EB-2,2例进展为AML。8例LEN治疗有效的5q-伴ACA患者,治疗过程中2例复发,1例进展为AML。
LEN组29例患者可评估血液学疗效,中位治疗时间为14(2~84)个月,26例(89.7%)连续治疗≥4个月。LEN组血液学总反应率为79.3%(23/29),CR率为58.6%(17/29),HI率为20.7%(6/29),LEN中位起效时间为2(0~7)个月,中位有效持续时间为25个月。LEN组19例患者可评估细胞遗传学反应,CyR率为68.4%(13/19),CCyR率为52.6%(10/19),PCyR率为15.8%(3/19)。非LEN组25例患者可评估血液学疗效,中位治疗时间为24(2~69)个月,血液学总反应率为36.0%(9/25),HI率为28.0%(7/25),CR率为8.0%(2/25)。非LEN组9例患者可评估细胞遗传学反应,总CyR率为11.1%(1/9),CCyR率为0,PCyR率为11.1%(1/9)。LEN组血液学总反应率(P=0.002)、CR率(P<0.001)、总CyR率、CCyR均高于非LEN组。
LEN治疗的主要不良反应为血细胞减少,9例(31.0%)患者在治疗后出现不同程度血细胞减少(6例为≥3级血细胞减少),5例(17.2%)出现皮疹。LEN治疗过程中1例患者出现脑梗死,无一例患者出现深静脉栓塞。
全部77例患者,失访5例,余72例纳入生存分析。中位随访36(2~101)个月,死亡24例,中位OS时间为75(95%CI 46~104)个月。3年OS率为(75.3±5.6)%,5年OS率为(60.9±7.7)%。影响生存的单因素分析显示,年龄>65岁、诊断前曾输血、ANC<0.8×109/L、红细胞平均体积(MCV)≤100 fl、骨髓原始细胞比例>2%、骨髓纤维化MF-2/3级是影响OS率的预后不良因素(表3),进一步纳入多因素分析,发现骨髓原始细胞比例>2%是预后不良的独立影响因素(HR=5.266,95% CI 1.329~20.876,P=0.018)。
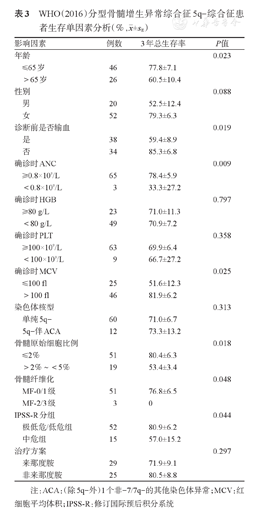
WHO(2016)分型骨髓增生异常综合征5q-综合征患者生存单因素分析(%, ±sE)
±sE)
WHO(2016)分型骨髓增生异常综合征5q-综合征患者生存单因素分析(%, ±sE)
±sE)
| 影响因素 | 例数 | 3年总生存率 | P值 | |
|---|---|---|---|---|
| 年龄 | 0.023 | |||
| ≤65岁 | 46 | 77.8±7.1 | ||
| >65岁 | 26 | 60.5±10.4 | ||
| 性别 | 0.088 | |||
| 男 | 20 | 52.5±12.4 | ||
| 女 | 52 | 79.3±6.3 | ||
| 诊断前是否输血 | 0.019 | |||
| 是 | 38 | 59.4±8.9 | ||
| 否 | 34 | 85.3±6.8 | ||
| 确诊时ANC | 0.009 | |||
| ≥0.8×109/L | 65 | 78.4±5.9 | ||
| <0.8×109/L | 3 | 33.3±27.2 | ||
| 确诊时HGB | 0.797 | |||
| ≥80 g/L | 23 | 71.0±11.3 | ||
| <80 g/L | 49 | 70.9±7.2 | ||
| 确诊时PLT | 0.358 | |||
| ≥100×109/L | 63 | 69.9±6.4 | ||
| <100×109/L | 9 | 66.7±27.2 | ||
| 确诊时MCV | 0.025 | |||
| ≤100 fl | 25 | 51.6±12.3 | ||
| >100 fl | 46 | 81.9±6.2 | ||
| 染色体核型 | 0.313 | |||
| 单纯5q- | 60 | 71.0±6.7 | ||
| 5q-伴ACA | 12 | 73.3±13.2 | ||
| 骨髓原始细胞比例 | 0.018 | |||
| ≤2% | 51 | 80.4±6.3 | ||
| >2%~<5% | 19 | 53.4±3.4 | ||
| 骨髓纤维化 | 0.048 | |||
| MF-0/1级 | 51 | 76.8±6.5 | ||
| MF-2/3级 | 3 | 0 | ||
| IPSS-R分组 | 0.044 | |||
| 极低危/低危组 | 52 | 80.9±6.2 | ||
| 中危组 | 15 | 57.0±15.2 | ||
| 治疗方案 | 0.297 | |||
| 来那度胺 | 29 | 71.9±9.1 | ||
| 非来那度胺 | 25 | 80.5±8.8 | ||
注:ACA:(除5q-外)1个非-7/7q-的其他染色体异常;MCV:红细胞平均体积;IPSS-R:修订国际预后积分系统
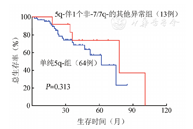
60例单纯5q-患者中位随访32(2~85)个月,中位OS时间为62(95%CI 45~79)个月;12例5q-伴ACA中位随访44(18~101)个月,中位OS时间为78(95%CI 18~138)个月。两组差异无统计学意义(P=0.313)(图1)。

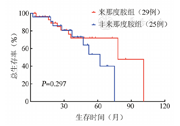
LEN组患者29例,中位随访38(4~101)个月,死亡9例,中位OS时间78(95%CI 42~114)个月;非LEN组患者25例,中位随访时间35(2~75)个月,死亡9例,中位OS时间为62(95%CI 42~81)个月。两组差异无统计学意义(P=0.297)(图2)。

1974 Van den Berghe等[13]首次提出伴5号染色体长臂缺失的MDS患者具有特殊的临床特征,称之为5q-综合征。WHO(2016)分型标准[5]将染色体核型异常为单纯5q-及5q-伴ACA的MDS患者均列为5q-综合征。本研究我们对单纯5q-及5q-伴ACA的患者进行回顾性分析,结果表明以下几个方面二者并无显著差异。
首先,单纯5q-与5q-伴ACA患者临床特征大体相似。本研究中单纯5q-与5q-伴ACA两组患者虽然在年龄、骨髓小巨核细胞检出率方面存在差异,但性别,外周血HGB、WBC、ANC、PLT,骨髓原始细胞比例,5号染色体长臂缺失区域,IPSS-R各亚组比例差异均无统计学意义。此前,Gurney等[14]回顾性分析Mayo临床中心的72例符合WHO(2016)分型标准5q-综合征的患者,单纯del(5q)61例、del(5q)伴ACA患者11例,两组患者在年龄、性别、外周血细胞计数、骨髓原始细胞比例等方面差异均无统计学意义。
其次,单纯5q-与5q-伴ACA患者LEN疗效无显著差异。本研究单纯5q-与5q-伴ACA患者LEN的血液学总反应率、CR率、总CyR率、CCyR率相近。MDS-003临床试验[7]中,64例MDS伴单纯5q-患者CyR率为77%、CCyR率为45%,15例5q-伴1个其他染色体异常的患者CyR率为67%、CCyR率为40%,6例5q-伴≥2个染色体异常患者CyR率为50%、CCyR率为50%;三组CyR率、CCyR率差异无统计学意义(P值分别为0.27、0.93)。意大利多中心研究报道LEN治疗IPSS低危及中危的MDS伴5q-患者的疗效,单纯5q-患者122例,5q-伴其他染色体异常27例,两组患者LEN的CyR率差异也无统计学意义(P=0.219)[10]。
第三,单纯5q-与5q-伴ACA患者总体生存无显著差异。本研究两组患者中位OS时间差异无统计学意义(62个月对78个月,P=0.313)。Haase等[1]的研究比较了86例单纯5q-与30例5q-伴1个其他染色体异常的MDS患者的中位OS时间,差异无统计学意义(80个月对47个月,P=0.30)。Mallo等[3]研究中,275例单纯5q-与89例5q-伴1个其他染色体异常的MDS患者中位OS时间差异也无统计学意义(63.4个月对46.0个月,P=0.131)。Gurney等[14]研究符合WHO(2016)分型标准的5q-综合征患者中,61单纯5q-与11例5q-伴ACA患者中位OS时间差异亦无统计学意义(55个月对38个月,P=0.52)。
由以上可见,我们的研究结果进一步支持WHO(2016)分型将单纯5q-及5q-伴ACA的MDS患者归为同一亚型是合适的。
迄今我国尚无LEN治疗5q-综合征患者的相关研究报道。本研究回顾性分析了我院近10年5q-综合征患者的临床资料,结果表明LEN组血液学总反应率、CR率、CyR率、CCyR率均高于非LEN组。其次,本研究LEN治疗组总体疗效与此前LEN治疗MDS伴5q-患者的临床试验[6,7,8](总有效率56%~76%,CyR率43%~83%)、波兰[9](LEN治疗MDS伴5q-患者红系反应率为72.2%)和意大利[10]的研究(LEN治疗MDS伴5q-患者红系反应率为85.8%,CyR率为22.6%)的疗效基本一致。现今,进口LEN已在我国上市,国产LEN也已相继上市,LEN(10 mg/d,连用21 d,停1周,28 d为1个疗程)被骨髓增生异常综合征中国诊断与治疗指南(2019年版)[15]推荐为低危、中危-1 5q-综合征患者的首选治疗方案。
综上,本研究结果提示单纯5q-与5q-伴ACA两组患者的临床特征、LEN疗效、中位OS时间大体相似,WHO(2016)分型将该两组患者归于5q-综合征是合适的。LEN治疗5q-综合征患者疗效肯定,优于非LEN药物治疗。但本研究为单中心回顾性分析,入组病例数较少,尚待下一步全国多中心、前瞻性研究来加以验证。



























