
分析原发系统型间变性大细胞淋巴瘤(ALCL)的临床特征及预后因素。
回顾性分析2013年1月至2018年12月期间在浙江大学医学院附属第一医院住院治疗的40例ALCL患者的临床资料,总结其临床特征并分析其预后相关因素。
①40例患者中男29例,女11例,中位年龄41(14~67)岁,Ann Arbor分期Ⅲ~Ⅳ期36例(90.0%),IPI评分中高危、高危23例(57.5%);25例(62.5%)有B症状,发热最为常见,其次为消瘦、盗汗;38例(95.0%)有结外侵犯;25例(62.5%)LDH升高;25例(62.5%)Ki-67≥80%;ALK阳性22例(55.0%),中位年龄29(14~67)岁,ALK阴性18例(45.0%),中位年龄51.5(19~67)岁,年龄差异有统计学意义(P=0.003)。②40例患者均接受化疗,采用CHOP(环磷酰胺+多柔比星+长春地辛+泼尼松)方案18例,ECHOP(依托泊苷+CHOP)方案12例,其他方案10例;26例(65.0%)获得完全缓解(CR),ALK阴性(P=0.029,OR=13.458)和Ki-67≥80%(P=0.04,OR=14.453)是CR的独立影响因素,ECHOP方案的CR率高于CHOP方案[83.3%(10/12)对38.9%(7/18),P=0.026]。③LDH水平、IPI评分、ALK表达情况以及化疗方案的选择对无进展生存(PFS)和总生存(OS)影响有统计学意义(P<0.05)。
ALCL发病男性居多,青少年至中老年均有发病,ALK阳性中年轻患者居多,诊断时临床分期晚,多数患者有结外侵犯,半数以上患者有B症状、LDH升高、Ki-67高表达;ALK表达与否、Ki-67表达水平以及化疗方案的选择可影响疗效,LDH水平、IPI评分、ALK表达与否以及化疗方案的选择可影响PFS和OS;ECHOP是较优的化疗方案,可改善预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
间变性大细胞淋巴瘤(ALCL)是一种少见且异质性明显的非霍奇金淋巴瘤(NHL),占成人NHL的1%~3%,占儿童及青少年淋巴瘤的10%~15%[1,2]。ALCL的细胞遗传学特征是存在t(2;5)染色体异常,可表达间变性淋巴瘤激酶(ALK),根据患者是否表达ALK,分为ALK阳性ALCL和ALK阴性ALCL,二者临床特征及预后截然不同。2016年修订的WHO分类[3]中将ALCL分为4种不同的类型:①原发系统型ALCL,ALK阳性;②原发系统型ALCL,ALK阴性;③乳房假体相关ALCL;④原发皮肤型ALCL。虽然4类ALCL形态学都以大细胞增殖为主且高表达CD30,但预后不同[4]。我们回顾性分析了40例原发系统型ALCL患者的临床特征、治疗效果及预后情况,旨在进一步探寻影响本病预后的相关因素,提高对本病的认识,为临床预后评估及治疗提供参考。
回顾性分析2013年1月1日至2018年12月31日浙江大学医学院附属第一医院血液科住院治疗的40例原发系统型ALCL患者,所有纳入患者均具有完整的临床和病理资料,诊断符合2016年WHO造血与淋巴组织肿瘤分类诊断标准[3],完成治疗且随访时间超过6个月。因乳房假体相关ALCL和原发皮肤型ALCL临床罕见,且预后相对较好,不纳入研究。收集患者性别、年龄、免疫组化、B症状(发热、盗汗、体重减轻)、结外受累情况、骨髓受累情况、ECOG评分、初诊时LDH水平、ALK表达、Ki-67指数等资料。根据患者骨髓象、淋巴结活检、腹部B超、CT、MRI、PET-CT等检查结果,评价患者全身受累范围并进行Ann Arbor分期,进一步进行淋巴瘤国际预后指数(IPI)评分。
40例患者均接受了初始化疗,采用CHOP(环磷酰胺+多柔比星+长春地辛+泼尼松)方案18例,ECHOP(依托泊苷+CHOP)方案12例,CHOP-L(CHOP+左旋门冬酰胺酶)方案3例,Hyper-CVAD/MA(环磷酰胺+多柔比星+长春地辛+地塞米松/甲氨蝶呤+阿糖胞苷)方案交替7例,治疗剂量为标准剂量。化疗后1例患者接受放疗,1例应用本妥昔单抗(brentuximab vedotin),10例应用西达苯胺,13例接受自体造血干细胞移植。一线治疗未缓解或缓解后复发患者予二线DHAP(顺铂+阿糖胞苷+地塞米松)、ICE(异环磷酰胺+卡铂+依托泊苷)、GDP(吉西他滨+顺铂+地塞米松)、MINE(美司钠+异环磷酰胺+米托蒽醌+依托泊苷)等方案化疗,无法耐受强化疗的予本妥昔单抗、西达苯胺等治疗。
按照2014年Lugano疗效标准[5]进行近期疗效评价,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。无进展生存(PFS)期指治疗开始到疾病复发、进展、死亡或随访终点的时间;总生存(OS)期指治疗开始到死亡或随访终点的时间。
全部病例以门诊及电话进行随访,随访截至2019年6月30日,死亡及失访病例以死亡、失访时间为随访终点。
采用SPSS 23.0软件进行统计分析。计数资料的组间比较采用χ2检验或Fisher精确概率法。采用Kaplan-Meier法绘制生存曲线,生存率的组间比较应用Log-rank检验。影响CR的多因素分析采用Logistic回归分析。
40例患者中男29例,女11例,男女比为2.64∶1,中位发病年龄41.5(14~67)岁;Ann Arbor分期:Ⅰ~Ⅱ期4例(10.0%),Ⅲ~Ⅳ期36例(90.0%)。25例(62.6%)有B症状,发热最为常见,其次为消瘦、盗汗;38例(95.0%)伴结外受累,其中27例(67.5%)有2个或2个以上结外病变,骨侵犯占32%(孤立或多发),软组织侵犯占27.5%;25例(62.5%)LDH升高。IPI评分:低危5例(12.5%)、低中危12例(30.0%)、中高危13例(32.5%)、高危10例(25.0%);1例患者合并SWEET综合征,1例合并干燥综合征,2例合并慢性乙型病毒性肝炎;40例患者治疗前肝、肾功能均无异常。
ALK阳性患者22例(55.0%),平均年龄(33.1±15.9)岁,中位年龄29(14~67)岁,ALK阴性患者18例(45%),平均年龄(48.1±13.9)岁,中位年龄51.5(19~67)岁,二者差异有统计学意义(z=2.856,P=0.003);62.5%(25/40)的患者Ki-67≥80%,8.7%(2/23)BCL-2阳性,5.3%(1/19)PAX-5阳性,26.7%(4/15)CD56阳性。
40例患者均接受了初始化疗,共有26例(65.0%)患者初始化疗后达CR,单因素分析显示:ALK阴性、Ki-67≥80%、结外侵犯≥2处、IPI 3~5分是影响CR危险因素(P值均<0.05)(表1)。将单因素有意义的客观指标进一步行Logistic回归分析,结果显示ALK阴性和Ki-67≥80%是影响CR的独立危险因素(表2)。本研究中,75.0%(30/40)的患者采用CHOP或ECHOP方案,其中CHOP组ALK阳性占44.4%(8/18),ALK阴性占55.6%(10/18),Ki-67≥80%占72.2%(13/18),ECHOP组ALK阳性占58.3%(7/12),ALK阴性占41.4%(5/12),Ki-67≥80%占58.3%(7/12),两种化疗方案中ALK表达情况和Ki-67表达强弱差异均无统计学意义(P>0.05),应用CHOP或ECHOP作为初始化疗方案的患者的CR率分别为38.9%(7/18)、83.3%(10/12),差异有统计学意义(P=0.026)。
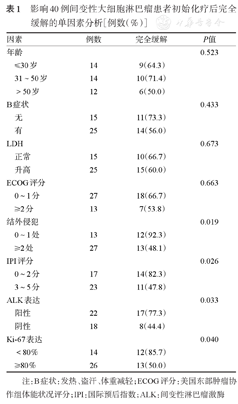
影响40例间变性大细胞淋巴瘤患者初始化疗后完全缓解的单因素分析[例数(%)]
影响40例间变性大细胞淋巴瘤患者初始化疗后完全缓解的单因素分析[例数(%)]
| 因素 | 例数 | 完全缓解 | P值 | |
|---|---|---|---|---|
| 年龄 | 0.523 | |||
| ≤30岁 | 14 | 9(64.3) | ||
| 31~50岁 | 14 | 10(71.4) | ||
| >50岁 | 12 | 6(50.0) | ||
| B症状 | 0.433 | |||
| 无 | 15 | 11(73.3) | ||
| 有 | 25 | 14(56.0) | ||
| LDH | 0.673 | |||
| 正常 | 15 | 10(66.7) | ||
| 升高 | 25 | 15(60.0) | ||
| ECOG评分 | 0.663 | |||
| 0~1分 | 27 | 18(66.7) | ||
| ≥2分 | 13 | 7(53.8) | ||
| 结外侵犯 | 0.019 | |||
| 0~1处 | 13 | 12(92.3) | ||
| ≥2处 | 27 | 13(48.1) | ||
| IPI评分 | 0.026 | |||
| 0~2分 | 17 | 14(82.3) | ||
| 3~5分 | 23 | 11(47.8) | ||
| ALK表达 | 0.033 | |||
| 阳性 | 22 | 17(77.3) | ||
| 阴性 | 18 | 8(44.4) | ||
| Ki-67表达 | 0.040 | |||
| <80% | 14 | 12(85.7) | ||
| ≥80% | 26 | 13(50.0) | ||
注:B症状:发热、盗汗、体重减轻;ECOG评分:美国东部肿瘤协作组体能状况评分;IPI:国际预后指数;ALK:间变性淋巴瘤激酶
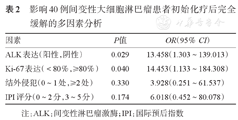
影响40例间变性大细胞淋巴瘤患者初始化疗后完全缓解的多因素分析
影响40例间变性大细胞淋巴瘤患者初始化疗后完全缓解的多因素分析
| 因素 | P值 | OR(95%CI) |
|---|---|---|
| ALK表达(阳性,阴性) | 0.029 | 13.458(1.303~139.013) |
| Ki-67表达(<80%,≥80%) | 0.040 | 14.453(1.133~184.308) |
| 结外侵犯(0~1处,≥2处) | 0.330 | 3.928(0.251~61.537) |
| IPI评分(0~2分,3~5分) | 0.174 | 6.018(0.452~80.078) |
注:ALK:间变性淋巴瘤激酶;IPI:国际预后指数
至随访结束,40例ALCL患者有30例存活,10例死亡。中位PFS期为24(95%CI 4~44)个月,中位OS期未达到。LDH水平、IPI评分、ALK表达情况以及化疗方案的选择是影响PFS、OS的预后因素(P<0.05)(表3)。应用CHOP或ECHOP作为初始化疗方案的患者的3年PFS率分别为(24.3±13.8)%、(80.8±12.2)%(P=0.020),3年OS率分别为(46.8±15.8)%、100.0%(P=0.024)(图1)。本研究还对标记了BCL-2、PAX-5、CD56的病例进行统计分析,结果显示CD56阴性患者的3年PFS、OS率均明显高于CD56阳性患者(P=0.042,P=0.039),PAX-5阴性患者的3年OS率高于PAX-5阳性的患者(P=0.010)。
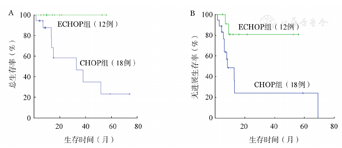

CHOP:环磷酰胺+多柔比星+长春地辛+泼尼松;ECHOP:依托泊苷+CHOP
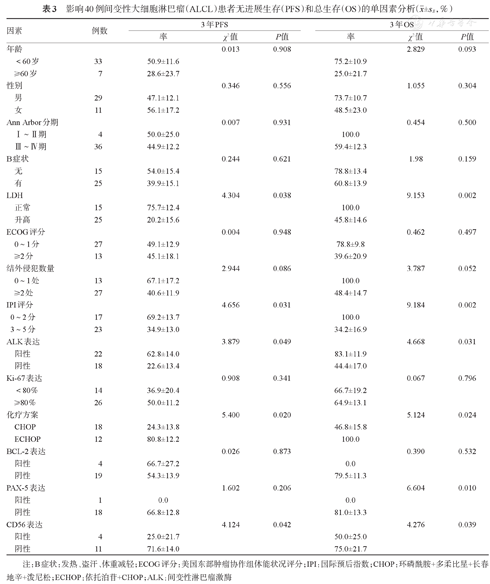
影响40例间变性大细胞淋巴瘤(ALCL)患者无进展生存(PFS)和总生存(OS)的单因素分析( ±sE,%)
±sE,%)
影响40例间变性大细胞淋巴瘤(ALCL)患者无进展生存(PFS)和总生存(OS)的单因素分析( ±sE,%)
±sE,%)
| 因素 | 例数 | 3年PFS | 3年OS | |||||
|---|---|---|---|---|---|---|---|---|
| 率 | χ2值 | P值 | 率 | χ2值 | P值 | |||
| 年龄 | 0.013 | 0.908 | 2.829 | 0.093 | ||||
| <60岁 | 33 | 50.9±11.6 | 75.2±10.9 | |||||
| ≥60岁 | 7 | 28.6±23.7 | 25.0±21.7 | |||||
| 性别 | 0.346 | 0.556 | 1.055 | 0.304 | ||||
| 男 | 29 | 47.1±12.1 | 73.7±10.7 | |||||
| 女 | 11 | 56.1±17.2 | 48.5±23.0 | |||||
| Ann Arbor分期 | 0.007 | 0.931 | 0.454 | 0.500 | ||||
| Ⅰ~Ⅱ期 | 4 | 50.0±25.0 | 100.0 | |||||
| Ⅲ~Ⅳ期 | 36 | 44.9±12.2 | 59.4±12.3 | |||||
| B症状 | 0.244 | 0.621 | 1.98 | 0.159 | ||||
| 无 | 15 | 54.0±15.4 | 78.8±13.4 | |||||
| 有 | 25 | 39.9±15.1 | 60.8±13.9 | |||||
| LDH | 4.304 | 0.038 | 9.153 | 0.002 | ||||
| 正常 | 15 | 75.7±12.4 | 100.0 | |||||
| 升高 | 25 | 20.2±15.6 | 45.8±14.6 | |||||
| ECOG评分 | 0.004 | 0.948 | 0.462 | 0.497 | ||||
| 0~1分 | 27 | 49.1±12.9 | 78.8±9.8 | |||||
| ≥2分 | 13 | 45.1±18.1 | 39.6±20.9 | |||||
| 结外侵犯数量 | 2.944 | 0.086 | 3.787 | 0.052 | ||||
| 0~1处 | 13 | 67.1±17.2 | 100.0 | |||||
| ≥2处 | 27 | 40.6±11.9 | 48.4±14.7 | |||||
| IPI评分 | 4.656 | 0.031 | 9.184 | 0.002 | ||||
| 0~2分 | 17 | 69.2±13.7 | 100.0 | |||||
| 3~5分 | 23 | 34.9±13.0 | 34.2±16.9 | |||||
| ALK表达 | 3.879 | 0.049 | 4.668 | 0.031 | ||||
| 阳性 | 22 | 62.8±14.0 | 83.1±11.9 | |||||
| 阴性 | 18 | 22.6±13.4 | 44.4±17.0 | |||||
| Ki-67表达 | 0.908 | 0.341 | 0.067 | 0.796 | ||||
| <80% | 14 | 36.9±20.4 | 66.7±19.2 | |||||
| ≥80% | 26 | 50.0±11.2 | 64.9±13.1 | |||||
| 化疗方案 | 5.400 | 0.020 | 5.124 | 0.024 | ||||
| CHOP | 18 | 24.3±13.8 | 46.8±15.8 | |||||
| ECHOP | 12 | 80.8±12.2 | 100.0 | |||||
| BCL-2表达 | 0.026 | 0.873 | 0.390 | 0.532 | ||||
| 阳性 | 4 | 66.7±27.2 | 0.0 | |||||
| 阴性 | 19 | 54.3±13.9 | 79.5±11.3 | |||||
| PAX-5表达 | 1.602 | 0.206 | 6.604 | 0.010 | ||||
| 阳性 | 1 | 0.0 | 0.0 | |||||
| 阴性 | 18 | 66.8±12.8 | 81.0±13.3 | |||||
| CD56表达 | 4.124 | 0.042 | 4.276 | 0.039 | ||||
| 阳性 | 4 | 25.0±21.7 | 50.0±25.0 | |||||
| 阴性 | 11 | 71.6±14.0 | 75.0±21.7 | |||||
注:B症状:发热、盗汗、体重减轻;ECOG评分:美国东部肿瘤协作组体能状况评分;IPI:国际预后指数;CHOP:环磷酰胺+多柔比星+长春地辛+泼尼松;ECHOP:依托泊苷+CHOP;ALK:间变性淋巴瘤激酶
ALCL是一类临床少见的恶性淋巴瘤,既往研究显示ALK的表达与预后关系密切,但临床上我们发现,该类型淋巴瘤异质性明显,单纯依据ALK的表达情况评估预后还远远不够,需要我们从大量临床数据中去挖掘更多有用信息,进一步了解本病的临床特点、预后影响因素,探寻最佳治疗方案。
本研究显示ALCL发病的临床特点表现为:男性多于女性,ALK阳性ALCL多见于青年人,ALK阴性ALCL以中老年多见,与既往报道[6,7]结论相似,患者就诊时多为晚期,本研究Ⅲ~Ⅳ期患者占比90%,与董菲等[8]的报道相符,半数以上患者有B症状、LDH升高、Ki-67高表达,95%的患者有结外受累,且67.5%患者有2个及以上结外病变,骨、软组织是最常见结外累及部位。
单因素分析发现ALK表达与否、Ki-67表达强弱、结外侵犯数量、IPI评分对CR影响有统计学意义(P<0.05),多因素Logistic回归结果显示,仅ALK表达情况和Ki-67表达强弱是CR的独立影响因素。虽结外侵犯数量、IPI评分并非CR的独立影响因素,结外侵犯数量≥2个的患者不能获得CR的风险是结外侵犯数0~1个患者的3.928倍,IPI评分3~5分的患者不能获得CR的风险是IPI评分0~2分患者的6.018倍,仍然具有一定的临床指导意义。除此之外,化疗方案的选择对CR率也有影响,应用ECHOP作为初始化疗方案患者的CR率明显高于初始化疗方案应用CHOP方案组(83.3%对38.9%,P=0.026)。IPI评分、ALK表达、LDH水平是影响PFS、OS的因素,与文献[11,12]的研究一致。除此之外,化疗方案的选择对PFS、OS的影响也具有统计学意义。提示影响CR、PFS、OS的因素既有客观因素(ALK表达、Ki-67表达强弱、IPI评分等),也有医疗决策因素(化疗方案的选择),本研究显示ECHOP方案优于CHOP方案,可使患者获得更好的预后。
ALK表达与否与预后密切相关已得到大家广泛共识,本研究再次证明,ALK阳性的ALCL患者有更高的CR率及更长的PFS和OS期。但我们发现,个别ALK阴性的患者预后极好,有2例ALK阴性患者的PFS期分别为48.5、69.3个月,OS期分别为51.8、74.0个月,远高于所在ALK阴性组患者的中位PFS(12.7个月)和中位OS(21.0个月)。King等[13]研究也发现:约有30%ALK阴性的ALCL患者携有DUSP22位点的重排,这些患者的预后良好,与ALK阳性的ALCL类似。由此可见,单纯依据ALK的表达情况评估预后还不够,今后随着检测手段的进步,应该在ALK分型的基础上再分亚组进行预后讨论。
关于ALCL患者其他免疫标志与预后的关系,目前报道较少,本研究将标记了BCL-2、PAX-5、CD56的病例做了统计,结果显示:CD56阴性患者3年PFS、OS率高于CD56阳性患者,PAX-5阴性患者的OS率高于PAX-5阳性患者,BCL-2的表达对PFS和OS影响无统计学意义,但因病例数过少,其临床意义有待进一步证实。既往有报道称高表达BCL-2蛋白的患者对化疗不敏感,预后较差[9],有PAX-5异常表达的T细胞淋巴瘤可能更具有侵袭性[10],唐晓文等[6]研究表明CD56阳性患者OS率较CD56阴性患者差,上述报道与本研究结果部分相符,BCL-2、PAX-5、CD56的表达对ALCL患者预后的影响值得进一步研究。
关于ALCL的治疗,目前国内外仍无标准的一线治疗方案,联合化疗仍是主要手段,临床上通常采用CHOP或类CHOP方案,多个研究表明,在CHOP中添加依托泊苷组成的ECHOP方案预后明显优于单纯CHOP方案[14,15,16],本研究结论与之相符,其原因可能为依托泊苷是拓扑异构酶Ⅱ(TopoⅡ)抑制剂,能诱导DNA双链和(或)单链裂解使细胞死亡,对生长迅速、细胞分裂活跃的肿瘤细胞作用尤为显著。本组患者Ki-67≥50%占37例(92.5%),Ki-67≥80%占25例(62.5%),提示ALCL患者肿瘤细胞生长迅速、细胞分裂活跃,因此化疗方案中加用依托泊苷能够取得更好的临床疗效。多个报道显示Ki-67水平与TopoⅡα在肿瘤细胞中的表达呈正相关[17,18,19],因此,TopoⅡ在ALCL患者的表达情况值得我们进一步研究,以便为依托泊苷在ALCL患者的应用及良好疗效找到更佳的理论依据。对于复发难治的患者,可采用二线方案化疗,获得CR后行造血干细胞移植或尝试靶向药物,如CD30单抗或ALK抑制剂。国外还报道了3例复发难治ALCL患者,应用PD-1抑制剂Nivolumab治疗后表现出非常好的临床疗效和良好的耐受性[20]。STAT3抑制剂是当下热门的研究领域,对于ALCL的治疗目前仍处于临床前的实验阶段[21]。
综上,本研究结果显示ALCL总体上是一个预后相对较好的T细胞淋巴瘤类型,ECHOP方案优于CHOP方案。但本研究为单中心回顾性分析,样本量较少,研究结论待大样本甚至多中心协作的随机对照前瞻性研究验证,以实现分层治疗并探索更加有效的治疗方案。



























