探讨脾肿大对慢性粒-单核细胞白血病(CMML)异基因造血干细胞移植(allo-HSCT)预后的影响。
对2004年至2018年在北京大学血液病研究所接受allo-HSCT后的25例CMML患者进行回顾性分析,根据预处理前2周是否伴有脾脏肿大分为脾肿大组和非脾肿大组,比较两组患者在植入、移植物抗宿主病(GVHD)、复发以及生存方面的差异。
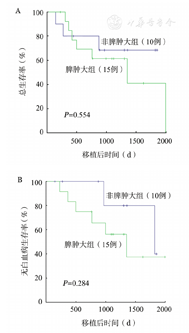
①脾肿大组15例(男8例,女7例),中位年龄45(23~61)岁;非脾肿大组10例(男、女各5例),中位年龄39(12~56)岁。两组患者基线特征差异无统计学意义(P>0.05)。②脾肿大组、非脾肿大组粒细胞植入率分别为93.3%(14/15)、100.0%(10/10),中位植入时间分别为17(11~20)d、14(11~18)d(χ2=5.303,P=0.021);脾肿大组、非脾肿大组血小板植入率分别为80.0%(12/15)、90.0%(9/10)(P=0.212),中位植入时间分别为17(12~33)d、15(12~19)d(χ2=0.470,P=0.493)。③脾肿大组5例发生急性GVHD(Ⅰ/Ⅱ度4例,Ⅲ/Ⅳ度1例),非脾肿大组6例发生急性GVHD(Ⅰ/Ⅱ度5例,Ⅲ/Ⅳ度1例)(χ2=0.204,P=0.652)。脾肿大组、非脾肿大组移植后100 d的急性GVHD累积发生率分别为33.3%(95%CI 14.9%~51.7%)、20.0%(95%CI 2.8%~37.2%)(P=0.635)。脾肿大组5例发生慢性GVHD(广泛型3例),非脾肿大组未发生慢性GVHD(P=0.041)。④脾肿大组、非脾肿大组3年累积复发率分别为(42.7±2.6)%、(11.1±1.2)%(χ2=1.824,P=0.122),3年总生存率分别为(61.5±13.5)%、(68.6±15.1)%(χ2=0.351,P=0.554),3年无白血病生存率分别为(56.3±14.8)%、(80.0±17.9)%(χ2=1.148,P=0.284)。
脾肿大可致CMML患者allo-HSCT后粒细胞植入延迟,对生存及复发无影响。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性粒-单核细胞白血病(CMML)是一类少见的血液系统恶性肿瘤,同时具有骨髓增生异常(MD)和骨髓增殖性(MP)特征。CMML的年发病率约为4/100 000,预后较差,中位总生存(OS)时间约为17个月[1]。目前,CMML的治疗选择包括羟基脲、去甲基化药物、细胞毒药物化疗和异基因造血干细胞移植(allo-HSCT)等[2,3]。约43%的CMML患者伴脾肿大[4,5]。由于其他手段治疗CMML疗效较差,且大部分患者移植前未接受治疗,因此多数患者在allo-HSCT前有脾肿大症状。既往有研究表明脾肿大是骨髓纤维化、急性髓系白血病(AML)、骨髓增生异常综合征(MDS)等疾病allo-HSCT预后不良的危险因素[6,7]。在CMML患者中脾肿大是否有相似的影响,目前尚无相关研究。本研究我们对25例接受allo-HSCT的CMML患者进行回顾性分析,探讨脾肿大对CMML患者allo-HSCT预后的影响。
纳入2004年1月至2018年6月期间在北京大学血液病研究所接受allo-HSCT且具有移植前脾脏资料的25例CMML患者,所有病例资料从病案数据库中查询获得。参考WHO(2016)诊断标准[8]将CMML分为CMML-0、CMML-1和CMML-2。
移植方案见文献[9]。单倍型移植预处理采用北京方案[10,11]:阿糖胞苷(Ara-C)4 g·m-2·d-1静脉滴注,-10、-9 d;白消安(Bu)0.8 mg/kg静脉滴注,每6 h 1次,-8 d~-6 d;环磷酰胺(Cy)1.8 g·m-2·d-1静脉滴注,-5、-4 d;司莫司汀250 mg/m2口服,-3 d;抗胸腺细胞球蛋白(ATG)2.5 mg·kg-1·d-1静脉滴注,-5 d~-2 d。全相合移植预处理方案:羟基脲800 mg/kg口服,-10 d;阿糖胞苷2 g/m2静脉滴注,-9 d;白消安0.8 mg/kg静脉滴注每6 h 1次,-8 d~-6 d;环磷酰胺1.8 g·m-2·d-1静脉滴注,-5、-4 d;司莫司汀250 mg/m2口服,-3 d。
采用超声检查测量脾脏大小(精确到0.1 cm),采用文献[12,13]标准判定脾肿大(长度>12 cm或厚度>4 cm)。粒细胞植入:中性细胞绝对计数(ANC)≥0.5×109/L连续3 d;血小板植入:血小板计数≥20×109/L连续7 d且脱离血小板输注。原发性血小板植入延迟:移植后60 d内未达到血小板植活标准(PLT<20×109/L)[14]。继发性血小板植入失败:移植后PLT<20×109/L连续7 d及以上,或需要血小板输注维持PLT≥20×109/L[15]。急性及慢性GVHD诊断参照文献[16,17]标准。
随访资料来自电话随访、住院/门诊病历。随访截止日期:2018年10月30日。OS时间:移植物末次回输至随访截止或死亡的日期。无白血病生存(LFS)时间:移植物末次回输至复发或死亡的日期,未发生者到随访截止。
分类变量采用χ2检验或fisher精确检验,连续变量采用Student'st检验或Mann-WhitneyU检验。采用Kaplan-Meier法绘制生存曲线,OS、LFS率的组间比较采用Log-rank检验。采用SPSS软件进行数据分析。复发、移植相关死亡为竞争风险,采用R软件cmprsk包进行竞争风险生存模型的比较。
根据预处理前2周是否伴有脾脏肿大将25例患者分为2组:①脾肿大组:15例(男8例,女7例),中位年龄45(23~61)岁,无巨脾(脾缘超过脐水平线以下或超过前正中线)患者,其中1例移植前接受脾切除术;②非脾肿大组:10例(男、女各5例),中位年龄39(12~56)岁。两组患者基线特征差异无统计学意义(表1)。
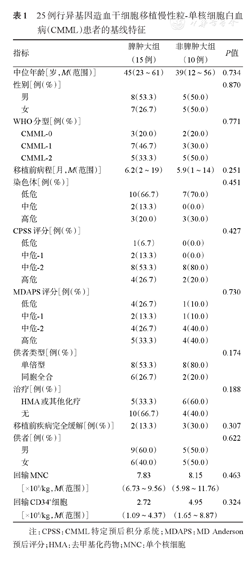
25例行异基因造血干细胞移植慢性粒-单核细胞白血病(CMML)患者的基线特征
25例行异基因造血干细胞移植慢性粒-单核细胞白血病(CMML)患者的基线特征
| 指标 | 脾肿大组(15例) | 非脾肿大组(10例) | P值 | |
|---|---|---|---|---|
| 中位年龄[岁,M(范围)] | 45(23~61) | 39(12~56) | 0.734 | |
| 性别[例(%)] | 0.870 | |||
| 男 | 8(53.3) | 5(50.0) | ||
| 女 | 7(26.7) | 5(50.0) | ||
| WHO分型[例(%)] | 0.771 | |||
| CMML-0 | 3(20.0) | 2(20.0) | ||
| CMML-1 | 7(46.7) | 3(30.0) | ||
| CMML-2 | 5(33.3) | 5(50.0) | ||
| 移植前病程[月,M(范围)] | 6.2(2~19) | 5.9(1~14) | 0.251 | |
| 染色体[例(%)] | 0.451 | |||
| 低危 | 10(66.7) | 7(70.0) | ||
| 中危 | 2(13.3) | 0(0.0) | ||
| 高危 | 3(20.0) | 3(30.0) | ||
| CPSS评分[例(%)] | 0.427 | |||
| 低危 | 1(6.7) | 0(0.0) | ||
| 中危-1 | 2(13.3) | 0(0.0) | ||
| 中危-2 | 8(53.3) | 8(80.0) | ||
| 高危 | 4(26.7) | 2(20.0) | ||
| MDAPS评分[例(%)] | 0.730 | |||
| 低危 | 4(26.7) | 1(10.0) | ||
| 中危-1 | 2(13.3) | 1(10.0) | ||
| 中危-2 | 4(26.7) | 4(40.0) | ||
| 高危 | 5(33.3) | 4(40.0) | ||
| 供者类型[例(%)] | 0.174 | |||
| 单倍型 | 8(53.3) | 8(80.0) | ||
| 同胞全合 | 6(26.7) | 2(20.0) | ||
| 治疗[例(%)] | 0.188 | |||
| HMA或其他化疗 | 5(33.3) | 6(60.0) | ||
| 无 | 10(66.7) | 4(40.0) | ||
| 移植前疾病完全缓解[例(%)] | 2(13.3) | 3(30.0) | 0.307 | |
| 供者[例(%)] | 0.622 | |||
| 男 | 9(60.0) | 5(50.0) | ||
| 女 | 6(40.0) | 5(50.0) | ||
| 回输MNC[×108/kg,M(范围)] | 7.83(6.73~9.56) | 8.15(5.98~11.76) | 0.463 | |
| 回输CD34+细胞[×106/kg,M(范围)] | 2.72(1.09~4.37) | 4.95(1.65~8.87) | 0.324 | |
注:CPSS:CMML特定预后积分系统;MDAPS:MD Anderson预后评分;HMA:去甲基化药物;MNC:单个核细胞
脾肿大组1例患者因移植预处理毒性死亡。脾肿大组、非脾肿大组粒细胞植入率分别为93.3%(14/15)、100.0%(10/10),中位植入时间分别为17(11~20)d、14(11~18)d(χ2=5.303,P=0.021);脾肿大组、非脾肿大组血小板植入率分别为80.0%(12/15)、90.0%(9/10)(P=0.212),中位植入时间分别为17(12~33)d、15(12~19)d(χ2=0.470,P=0.493)。脾肿大组1例(6.7%)患者发生原发性血小板植入延迟,3例(20.0%)患者发生继发性血小板植入失败;非脾肿大组1例(10.0%)患者发生继发血小板植入失败。
脾肿大组5例患者发生急性GVHD(Ⅰ/Ⅱ度4例,Ⅲ/Ⅳ度1例),中位发生时间为移植后51(16~96)d;非脾肿大组6例患者发生急性GVHD(Ⅰ/Ⅱ度5例,Ⅲ/Ⅳ度1例),中位发生时间为移植后45(14~80)d。两组急性GVHD发生率差异无统计学意义(χ2=0.204,P=0.652)。脾肿大组、非脾肿大组移植后100 d的急性GVHD累积发生率分别为33.3%(95%CI 14.9%~51.7%)、20.0%(95%CI 2.8%~37.2%)(P=0.635)。脾肿大组5例患者发生慢性GVHD(广泛型3例),非脾肿大组未发生慢性GVHD(χ2=3.590,P=0.041)。
脾肿大组、非脾肿大组分别有9例(60.0%)、3例(30.0%)患者发生细菌感染(χ2=0.416,P=0.556),4例(26.7%)、3例(30.0%)发生真菌感染(χ2=0.003,P=0.572),5例(33.3%)、4例(40.0%)发生巨细胞病毒(CMV)感染(χ2=0.490,P=0.484)。非脾肿大组1例(10.0%)发生EB病毒(EBV)感染,脾肿大组未发生EBV感染。无进展为CMV或EBV相关疾病病例。
脾肿大组6例患者复发,中位复发时间为移植后669(93~1 525)d,3年累积复发率为(42.7±2.6)%,非脾肿大组有1例复发,3年累积复发率为(11.1±1.2)%,两组3年累积复发率差异无统计学意义(χ2=1.824,P=0.122)。脾肿大组6例复发患者中1例放弃治疗,于3个月后死亡,3例接受化疗加供者淋巴细胞输注(DLI),2例接受二次移植。至随访截止,脾肿大组6例复发患者中只有1例存活。非脾肿大患者中1例复发,放弃治疗,于1个月后死亡。
脾肿大组8例死亡,其中3例为移植相关死亡(感染2例、脑出血1例),3年移植相关死亡率(TRM)为(21.7±1.4)%;非脾肿大组3例患者死亡,其中2例为移植相关死亡(均死于感染),3年TRM为(22.8±2.4)%,两组3年TRM差异无统计学意义(χ2=1.342,P=0.608)。
allo-HSCT是CMML患者的唯一治愈手段,移植后5年OS率为30%~50%[17],但脾肿大对于其预后影响的相关报道较少。Hart等[18]研究表明,脾肿大可导致造血干细胞归巢延迟,并破坏外周血干细胞。Rohrer等[19]也证实在造血干细胞归巢后,增大的脾可破坏正常的外周血干细胞,从而导致植入延迟。Zhao等[20]研究显示脾脏肿大是血液病患者原发性植入功能不良的危险因素。Shimomura等[6]研究发现,脾肿大可导致AML/MDS患者allo-HSCT后粒细胞和血小板植入率降低、OS率下降。Gergis等[7]研究发现脾肿大可影响骨髓纤维化患者植入率,Alchalby等[21]也在100例骨髓纤维化患者中证明了脾肿大可导致植入功能不良。本研究尽管未发现脾肿大对3年OS率有影响,但脾肿大组粒细胞植入延迟。尽管血小板植入率和植入时间差异无统计学意义,但本研究脾肿大组1例患者因血小板输注无效死于脑出血。需要注意的是:①本研究为单中心回顾性研究,样本量较少,可能存在偏倚。由于CMML的发病率较低,因此进行多中心、大规模的临床研究具有重要意义。②本研究结果显示脾肿大导致粒细胞植入延迟,而对血小板植入没有影响,出现这种差异的原因除需考虑样本量小导致偏倚外,还有可能与CMML患者脾脏病理改变与骨髓纤维化和MDS不完全相同有关。Steensma等[4]研究发现CMML患者的脾脏组织中普遍存在克隆性单核细胞,部分存在髓外造血,而骨髓纤维化患者脾肿大通常是髓外造血表现。
脾肿大患者是否需要在移植前进行脾脏处理仍存在争议。脾肿大的治疗措施包括脾切除术、脾区放疗、化疗或新型药物等。在骨髓纤维化患者中,大量研究提示脾切除术和脾区放疗有助于改善移植预后,然而在CMML中尚缺乏相关研究。CMML患者脾切除术并发症发生率、手术相关死亡率分别为13%、41%[22]。因此脾切除术是否能够使CMML患者获益,一方面需要明确脾肿大对于移植预后的影响,另一方面需要评估脾切除术相关风险是否超过获益,要回答这一问题还需要进一步研究。去甲基化药物治疗及JAK抑制剂相对而言更为安全,但疗效并不理想。印度一项应用地西他滨治疗CMML的多中心Ⅱ期临床研究结果显示,20%的脾肿大患者脾脏显著缩小[23]。Geissler等[24]在1例脾肿大CMML患者中应用JAK2抑制剂取得较好的效果。Padron等[25]应用芦可替尼治疗9例伴脾肿大CMML患者,5例患者脾脏显著缩小。
总之,本组病例结果初步显示,移植前伴有脾肿大可导致CMML患者allo-HSCT后粒细胞植入延迟,对生存及复发无显著影响。上述结论尚需进行大样本临床研究加以验证。