
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
异柠檬酸盐脱氢酶(isocitrate dehydrogenase,IDH)是三羧酸循环的限速酶,催化柠檬酸为α酮戊二酸(α-ketoglutarate, α-KG),其家族包括IDH1、IDH2和IDH3三个成员,IDH1定位于细胞质和过氧化物酶体中,IDH2和IDH3定位于细胞线粒体。IDH1和IDH2突变作为急性髓系白血病(AML)进展中早期克隆事件,对AML预后的作用受到突变位点和其他共同发生突变的影响,对12 747例IDH1/2突变患者进行meta分析发现,正常核型急性髓系白血病(CN-AML)患者中IDH1突变者完全缓解率、总生存率和无事件生存率较低,而IDH2突变患者的总生存率较高[1,2,3]。Ward等[4]采用siRNA沉默IDH1基因直接导致神经胶质瘤细胞株SF188细胞生长减慢,证明IDH1抑制神经胶质瘤细胞增殖,而不是抑癌基因。我们前期对320例CN-AML患者研究显示,与IDH1基因mRNA低表达患者相比较,高表达患者预后差,IDH1基因表达水平是独立于WBC、原始细胞比例、染色体核型和基因突变等临床特征的独立预后因素之一[5]。本研究主要探讨IDH1基因影响AML预后的可能机制。
人AML细胞株THP-1细胞购于中国科学院上海细胞生物学研究所,测序证实为IDH1和DIH2野生型,培养于含10%胎牛血清的RPMI 1640培养基中,置于37 ℃、5% CO2、饱和湿度的恒温培养箱中培养。取生长状态良好的对数生长期细胞进行实验。
胎牛血清和RPMI 1640培养基购自于美国Gibco公司;噻唑蓝(MTT)购自美国Sigma公司;Annexin Ⅴ/PI细胞凋亡检测试剂盒购自美国Biovision公司;β-actin抗体购自美国Santa Cruz公司;Caspase-3、poly(ADP-ribose)polymerase(PARP)、Cytc、BCL-2、Bak、PI3K、AKT、p-AKT、p-mTOR和p-p70S6K等抗体均购自美国Cell Signaling公司;阿柔比星(ACR)纯品由深圳万乐药业公司赠送,高三尖杉酯碱(HHT)纯品购自浙江省药品检验所,柔红霉素(DNR)纯品购自大连美仑生物科技有限公司;siRNA由美国Invitrogen公司合成,序列见表1;siRNA的阴性对照(negative control,NC)、带红色荧光的阳性对照、LipofectamineTM RNAiMAX转染试剂、Opti-MEM I Medium和RT试剂盒均购自美国Invitrogen公司;RNAiso plus和SYBR Green(SYBR@Premix Ex Taq TM Ⅱ)购自宝生物工程(大连)有限公司;随机引物由生工生物工程(上海)有限公司合成。

IDH1 siRNA的序列
IDH1 siRNA的序列
| siRNA | 正向引物(5'→3') | 反向引物(5'→3') |
|---|---|---|
| IDH1-181 | AAAUGAUUCGUGUCAUUUCAUCUCC | GGAGAUGAAAUGACACGAAUCAUUU |
| IDH1-182 | AAAUCAGUUGCUCUGUAUUGAUCCC | GGGAUCAAUACAGAGCAACUGAUUU |
| IDH1-183 | UUCAAACUGGGACUUGUACUGCUUG | CAAGCAGUACAAGUCCCAGUUUGAA |
取生长状态良好的对数生长期THP-1细胞,875×g离心5 min,弃上清,用含10%FBS的RPMI 1640培养基重悬并计数,调整细胞密度为6×105/ml,铺于24孔板内,每孔500 μl。按照LipofectamineTM RNAiMAX操作说明配制转染混合物。500 μl转染体系的转染混合物的比例如下:混合物1:Opti-MEM I Medium 50 μl,LipofectamineTM RNAiMAX 1 μl,共计51 μl;混合物2:Opti-MEM I Medium 50 μl,siRNA 1 μl(20 nmol/L),共计51 μl。混合物1和混合物2充分混匀后置于室温20 min后,加入已经铺好细胞的24孔板内,轻轻混匀,置于37 ℃、5%CO2培养箱培养。转染后24、48和72 h收集细胞,用流式细胞仪检测转染效率。实验均重复3次。
总RNA抽提按照RNAiso plus说明书进行。cDNA逆转录应用Invitrogen RT试剂盒,根据说明书将1 μg的总RNA逆转录为cDNA。IDH1基因mRNA表达量按SYBR Green(SYBR@Premix Ex Taq TM Ⅱ)PCR Kit说明书操作。以C-ABL基因作为内参,PCR引物序列如下:C-ABL:正向引物5′-TGGAGATAACACTCTAAGCATAACTAAAGGT-3′,反向引物5′-GATGTAGTTGCTTGGGACCCA-3′。IDH1:正向引物5′-TCCCTACGTGGAATTGGATCTACA-3′,反向引物5′-TGCAGCATCCTTGGTGACTTG-3′。冰上配制PCR体系:2×SYBR@ Premix Ex Taq TMⅡ 12.5 μl;上游引物(10 μmol/L)0.25 μl,下游引物(10 μmol/L)0.25 μl,cDNA 1.0 μl,ddH2O 11.0 μl,共25 μl;PCR程序:95 ℃预变性5 min,95 ℃ 30 s,60 ℃ 1 min,40个循环。变性、退火、延伸扩增40个循环。制作C-ABL和IDH1熔解曲线,所有引物的熔解曲线为单一熔解峰,均介于75~85 ℃,表明PCR特异性较好。每个样本重复3次,IDH1的相对表达量用2-△△CT计算。
siRNA IDH1-181+182和NC转染THP-1细胞后,细胞密度调整为1.5×104/ml,以每孔200 μl接种于96孔培养板内,设置4个复孔,培养1~7 d。siRNA IDH1-181+182和NC转染THP-1细胞48 h后,收集细胞,密度调整为1×105/ml,以每孔200 μl的体积接种于96孔培养板内,分别加入不同浓度化疗药物HHT(10、20、40、80和160 ng/ml)、ACR(20、40、80和160 ng/ml)和DNR(20、40、60、80和100 ng/ml),对照孔细胞加入相应体积的溶解药物溶剂,毎个浓度设置4个复孔。根据实验要求相应的时间后加入MTT工作液(5 mg/ml),每孔20 μl,充分混匀后置于5%CO2、37℃、饱和湿度的培养箱继续培养4 h。2 189×g离心10 min,弃上清,加入DMSO,每孔200 μl,用Bio-rad酶标仪,检测570 nm吸光度值。实验均重复3次。
按照Annexin Ⅴ/PI检测试剂盒说明进行操作。收集siRNA干扰的THP-1细胞,预冷PBS洗涤2遍,875×g离心5 min,弃去上清;细胞团块重悬于1×结合缓冲液100 μl,将细胞重悬液转移到试管中;分别加入5 μl PI和5 μl Annexin Ⅴ,充分混匀,室温避光反应10 min后上流式细胞仪检测,应用Cellquest 1.2软件分析结果。实验均重复3次。
收集siRNA干扰的THP-1细胞,预冷PBS洗涤2遍,875×g离心5 min,弃去上清;75%酒精重悬细胞,4 ℃固定;预冷PBS洗涤固定好的细胞悬液3遍,弃去上清;1 ml预冷的PBS重悬细胞,加入RNA酶2 μl,37 ℃反应30 min,悬液冷却后加入PI工作液30 μl,避光,4 ℃孵育30 min;用流式细胞仪检测,ModfitLD软件分析细胞周期结果。实验均重复3次。
收集siRNA干扰的THP-1细胞,预冷PBS洗涤3遍,加入细胞裂解液混匀后冰上裂解40 min,离心收集上清,BCA法检测蛋白浓度。以40 μg总蛋白进行SDS-PAGE后转膜至PVDF膜,50 g/L脱脂牛奶室温封闭1 h,一抗4 ℃孵育过夜,次日洗涤后加入相应二抗共孵育l h,洗涤后进行X线胶片显影。
采用SPSS 19.0软件进行数据分析。IC50采用加权直线回归方程计算,常规进行方差齐性和正态性检验。单变量组间比较采用t检验,方差不齐者采用非参数检验。以P<0.05为差异有统计学意义。统计图则采用Graphpad Prism6.0软件进行绘制。
IDH1 siRNA有IDH1-181、IDH1-182和IDH1-183三个片段,三个片段单独应用时IDH1基因mRNA下调水平不理想,将三个片段按不同方式组合,总浓度仍为20 nmol/L,转染THP-1细胞48 h后检测IDH1基因mRNA的表达情况,IDH1-181+183、IDH1-181+182、IDH1-182+183和IDH1-181+182+183组的IDH1基因mRNA抑制率分别为(63.69±7.73)%、(71.64±9.64%)、(64.91±9.79)%和(69.04±5.27)%。因此,选用IDH1-181+182组合进行后续试验。IDH1-181+182转染THP-1细胞48 h后Western blot检测IDH1蛋白表达情况,结果如图1所示,IDH1蛋白表达明显下调,表明THP-1细胞IDH1基因siRNA成功。


1:阴性对照;2:IDH1-181+182干扰组
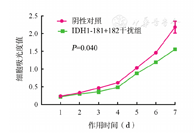
IDH1-181+182转染THP-1细胞后,MTT法检测THP-1细胞的增殖,结果如图2所示,与NC组相比较,沉默IDH1基因能够抑制THP-1细胞的增殖(t=2.60,P=0.040)。

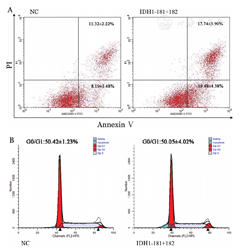
对干扰细胞进行凋亡检测,结果如图3A所示,干扰72 h后,IDH1-181+182干扰组凋亡率为(37.22±8.27)%,明显高于NC组的(19.50±1.18)%(t=-3.67,P=0.021)。如图3B所示,IDH1-181+182干扰组和NC组G0/G1期细胞的比例分别为(50.05±4.02)%和(50.42±1.23)%,差异无统计学意义(t=0.15,P=0.890)。

采用Western blot法检测干扰48 h THP-1细胞凋亡蛋白的变化,结果如图4所示,与NC组相比较,IDH1-181+182干扰组的Caspase-3和PARP的剪切带明显增加,促凋亡蛋白Bak和Cytc表达水平明显升高,而抗凋亡蛋白BCL-2和IAP家族成员c-IAP1表达水平明显下调。
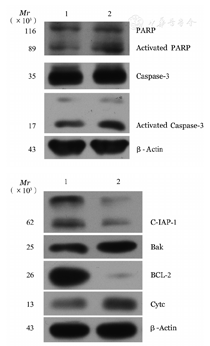

1:阴性对照;2:IDH1-181+182干扰组
PI3K/AKT信号通路在肿瘤细胞增殖和凋亡中起重要的作用,因此,我们检测沉默IDH1基因48 h THP-1细胞PI3K/AKT信号通路蛋白的变化。结果如图5所示,IDH1-181+182干扰组与NC组相比较,沉默IDH1基因后,PI3K/AKT/mTOR信号通路被抑制,信号通路中的PI3K110α、p-AKT、p-mTOR和p-p70S6K表达均下调。
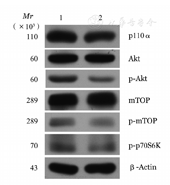

1:阴性对照;2:IDH1-181+182干扰组
siRNA干扰THP-1细胞48 h后,比较其对化疗药物的敏感性。结果如图6所示,HHT、ACR、DNR分别作用24 h后,与NC组相比较,IDH1-181+182干扰组THP-1细胞生存率降低,差异均有统计学意义(HHT:t=4.8,P=0.005;ACR:t=3.0,P=0.041;DNR:t=3.8,P=0.012)。
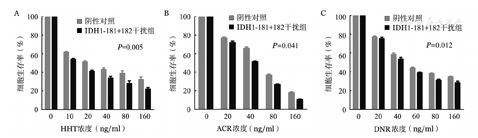

A、B、C分别为对高三尖杉酯碱(HHT)、阿柔比星(ACR)、柔红霉素(DNR)敏感性的影响
AML是一组高度异质性的血液系统恶性肿瘤,信号通路的调节紊乱和持续激活促进骨髓造血干/祖细胞的增殖。磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)/雷帕霉素靶蛋白(mTOR)信号通路在多种肿瘤中被激活,对肿瘤细胞的增殖、凋亡、血管生成和代谢等方面起着重要作用[6]。多项研究显示60%~80%的AML患者PI3K/Akt/mTOR信号通路被激活,这类患者总生存和无事件生存时间短,预后差,PI3K/Akt/mTOR信号通路被作为AML治疗的靶点[7]。
IDH1位于胞质和过氧化物酶体,以NADP+作为辅助因子,催化异柠檬酸的氧化脱羧反应生成α-酮戊二酸和NADPH,激活各种αKG依赖性双加氧酶,并提供还原当量,在脂质生物合成和氧化还原稳态中起重要作用[8]。大量研究证实肿瘤细胞IDH1突变为杂合的点突变,IDH1突变使其获得了新的酶活性,催化α-KG生成2-羟戊二酸(2-HG),其通过竞争性抑制依赖α-KG的酶活性来发挥病理作用。Ward等[9]研究发现突变IDH1细胞胞质2-HG的产生依赖于保留的野生型IDH1等位基因的活性。我们前期对320例CN-AML患者研究显示IDH1基因mRNA高表达者预后差,是CN-AML独立预后因素之一[5]。IDH1基因表达通过何种机制影响AML预后?我们选择AML细胞株中IDH1基因表达量最高,IDH1基因野生型的THP-1细胞作为研究对象,设计siRNA干扰野生型IDH1基因的转录,发现沉默THP-1细胞IDH1基因,细胞增殖受抑制。siRNA干扰野生型IDH1基因抑制AML细胞株THP-1细胞增殖与Ward等[10]采用siRNA沉默胶质瘤细胞株SF188细胞IDH1基因导致细胞增殖减慢和Metallo等[11]采用shRNA沉默肺癌细胞株A549细胞IDH1基因抑制细胞增殖一致。
细胞凋亡和周期阻滞是引起细胞生长抑制的常见原因。我们沉默THP-1细胞IDH1基因诱导细胞发生凋亡,但细胞周期未受影响。细胞凋亡是程序性死亡,细胞受到凋亡信号刺激后,各种Caspase被级联剪切激活是凋亡过程中重要的事件,受凋亡相关蛋白的调控,如BCL-2、BCL-xl、MCL-1等拮抗细胞凋亡,Bax、Bak、Bid等促进细胞凋亡,其中Bax/BCL-2的比例决定细胞凋亡和Caspase激活的级联反应。Western blot检测结果显示siRNA沉默THP-1细胞IDH1基因后抗凋亡蛋白BCL-2下调,而促凋亡蛋白Bak上调,BCL-2和Bax位于线粒体的外膜上,BCL-2下调,导致Bax/BCL-2比例上调,细胞色素C从线粒体释放到胞质中,促进Caspase激活的级联反应,因此,我们检测到Caspase-3及PARP被激活。IAP家族由多个成员组成包括CIAP-1、CIAP-2和XIAP等,结合并抑制caspase的活性来抑制凋亡,Western blot检测结果显示siRNA沉默IDH1基因后THP-1细胞CIAP-1下调,促进细胞凋亡。
PI3K/Akt/mTOR信号通路在60%~80%AML患者中被激活,调控细胞增殖和凋亡。Western blot检测发现siRNA沉默THP-1细胞IDH1基因后PI3K/AKT信号通路被抑制,PI3K110α、p-AKT、p-mTOR和p-P70S6K下调,可能通过抑制PI3K/Akt通路,诱导细胞凋亡,通过PI3K/Akt/mTOR/p70S6K途径抑制蛋白合成和细胞增殖,增加细胞对临床常用化疗药物HHT、ACR和DNR的敏感性。
综上所述,在AML患者中,IDH1基因mRNA高表达患者预后差,IDH1基因可能通过PI3K/AKT途径抑制细胞凋亡和促进细胞增殖。因此,下调AML细胞株THP-1细胞IDH1基因表达能够抑制PI3K/AKT信号通路,诱导细胞凋亡和抑制细胞增殖,增加化疗药物的敏感性。


























