
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
美国食品药物管理局(FDA)相继于2006、2010年批准原研达沙替尼(商品名:施达赛)用于二线和一线治疗成人慢性髓性白血病慢性期(CML-CP)患者。2013年9月国内首仿达沙替尼(商品名:依尼舒)被国家食品药品监督管理总局(CFDA)批准上市,在国内二线治疗CML-CP上具有较好的疗效和安全性[1,2];但国产达沙替尼在国内并没有一线治疗适应证。鉴于此,我们开展了多中心、开放性、前瞻性、单臂临床研究,旨在评价国产达沙替尼初始治疗新诊断的成人CML-CP患者的有效性和安全性,为中国CML-CP患者一线应用国产达沙替尼提供循证医学证据。
本研究为多中心、开放性、前瞻性、单臂临床研究,纳入2016年4月至2017年12月于浙江大学医学院附属第一医院、华中科技大学同济医学院附属同济医院、深圳市第二人民医院、复旦大学附属中山医院就诊的CML-CP患者。入组标准:①年龄≥18周岁;②首次使用研究药物前6个月内明确诊断Ph+CML-CP患者,诊断标准参照2016版中国CML诊断与治疗指南[3];③ECOG评分0~2分;④肝肾等主要器官功能正常[血清ALT和AST≤2.5×正常值下限(ULN);血清肌酐(Cr)≤1.5×ULN;血钾、镁、磷和总钙量≥ULN等];⑤受试者自愿参加并签署知情同意书,签署知情同意书过程符合《药物临床试验质量管理规范》要求。排除既往接受抗CML药物治疗(羟基脲除外)、肝肾心等脏器功能不全、合并其他原发恶性肿瘤、正在接受强CYP3A4抑制剂/诱导剂治疗、对本类制剂过敏或研究者因其他原因认为不适合入组的患者。本研究获得参研中心医学伦理委员会批准[2015伦审第(141)号]。
所有患者均使用国产达沙替尼(商品名:依尼舒,正大天晴药业集团股份有限公司产品)治疗,具体方案为:起始剂量100 mg/d,口服,每日1次。治疗过程中根据患者的不良反应适当调整用药剂量。
根据2013版欧洲白血病网络治疗指南(ELN)[4]评估患者疗效,包括完全血液学反应(CHR)、完全细胞遗传学反应(CCyR)、分子学反应,分子学反应包括主要分子学反应(MMR)、深度分子学反应(deep molecular response, DMR,MR4.0及以上);最佳疗效反应被定义为TKI治疗3个月时BCR-ABLIS≤10%、6个月时BCR-ABLIS≤1%或12个月时BCR-ABLIS≤0.1%。
根据美国国家癌症研究所(NCI)制定的常见不良事件评价标准(CTCAE)4.0版,对不良事件(adverse event,AE)进行分级(Ⅰ~Ⅳ)。
通过参研中心各医院门诊随访,随访截止时间为2019年12月,中位随访时间为24(7~24)个月。
统计分析采用SAS 9.3统计分析软件计算,可信区间采用95%的可信度(95%CI)。
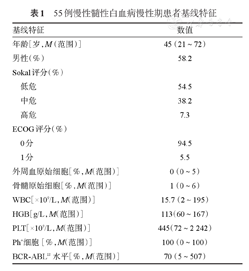
本研究共纳入55例国产达沙替尼一线治疗的CML-CP患者,其中男32例,女23例,中位年龄45(21~72)岁;Sokal评分低危患者30例(54.5%),中危患者21例(38.2%),高危患者4例(7.3%)。患者临床特征详见表1。
55例慢性髓性白血病慢性期患者基线特征
55例慢性髓性白血病慢性期患者基线特征
| 基线特征 | 数值 | |
|---|---|---|
| 年龄[岁,M(范围)] | 45(21~72) | |
| 男性(%) | 58.2 | |
| Sokal评分(%) | ||
| 低危 | 54.5 | |
| 中危 | 38.2 | |
| 高危 | 7.3 | |
| ECOG评分(%) | ||
| 0分 | 94.5 | |
| 1分 | 5.5 | |
| 外周血原始细胞[%,M(范围)] | 0(0~5) | |
| 骨髓原始细胞[%,M(范围)] | 1(0~6) | |
| WBC[×109/L,M(范围)] | 15.7(2~195) | |
| HGB[g/L,M(范围)] | 113(60~167) | |
| PLT[×109/L,M(范围)] | 445(72~2 242) | |
| Ph+细胞[%,M(范围)] | 100(0~100) | |
| BCR-ABLIS水平[%,M(范围)] | 70(5~507) | |
治疗3个月时,共55例患者进行疗效评估,其中81.8%(45/55)的患者获得最佳疗效反应。89.1%(49/55)的患者获得CHR;74.1%(40/54)的患者获得CCyR;14.5%(8/55)的患者达到MMR(BCR-ABLIS≤0.1%),其中5.5%(3/55)达到MR4.0(BCR-ABLIS≤0.01%),1.8%(1/55)达到MR4.5(BCR-ABLIS≤0.0032%)。
治疗6个月时,共55例患者进行疗效评估,其中76.4%(42/55)的患者获得最佳疗效反应。92.7%(51/55)的患者达CHR。52.7%(29/55)的患者达到MMR,其中27.3%(15/55)达到MR4.0,21.8%(12/55)达到MR4.5。
治疗12个月时,3例退组(1例因妊娠,1例因Ⅰ~Ⅱ级胸腔积液,1例因Ⅲ级血小板减少),共52例患者进行疗效评估,其中80.8%(42/52)的患者获得最佳疗效反应。96.2%(50/52)的患者获得CHR;93.9%(46/49)的患者获得CCyR;80.8%(42/52)的患者达到MMR,其中38.5%(20/52)达到MR4.0,28.8%(15/52)达到MR4.5。Sokal评分低危和中高危患者MMR率分别为85.7%(24/28)和75.0%(18/24),差异无统计学意义(P>0.05)。
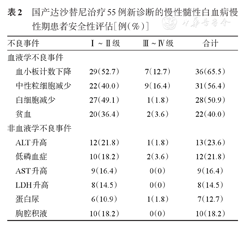
对55例患者进行不良事件评估,结果显示大部分患者对国产达沙替尼均可耐受,安全性良好,详见表2。随访12个月时,52例可评估患者中23例(44.2%)接受剂量调整,5例因Ⅰ~Ⅱ级胸腔积液。无患者发生疾病进展。
国产达沙替尼治疗55例新诊断的慢性髓性白血病慢性期患者安全性评估[例(%)]
国产达沙替尼治疗55例新诊断的慢性髓性白血病慢性期患者安全性评估[例(%)]
| 不良事件 | Ⅰ~Ⅱ级 | Ⅲ~Ⅳ级 | 合计 | |
|---|---|---|---|---|
| 血液学不良事件 | ||||
| 血小板计数下降 | 29(52.7) | 7(12.7) | 36(65.5) | |
| 中性粒细胞减少 | 22(40.0) | 9(16.4) | 31(56.4) | |
| 白细胞减少 | 27(49.1) | 1(1.8) | 28(50.9) | |
| 贫血 | 20(36.4) | 2(3.6) | 22(40.0) | |
| 非血液学不良事件 | ||||
| ALT升高 | 12(21.8) | 1(1.8) | 13(23.6) | |
| 低磷血症 | 10(18.2) | 2(3.6) | 12(21.8) | |
| AST升高 | 9(16.4) | 0(0) | 9(16.4) | |
| LDH升高 | 8(14.5) | 0(0) | 8(14.5) | |
| 蛋白尿 | 6(10.9) | 1(1.8) | 7(12.7) | |
| 胸腔积液 | 10(18.2) | 0(0) | 10(18.2) | |
血液学不良事件:55例患者中36例(65.5%)发生血小板减少;发生Ⅲ~Ⅳ级血小板减少、中性粒细胞减少、白细胞减少、贫血的患者分别为7例(12.7%)、9例(16.4%)、1例(1.8%)和2例(3.6%),经减量或短暂停药均可恢复。
非血液学不良事件:本研究中非血液学不良事件发生率由高到低依次为ALT升高、低磷血症、胸腔积液、AST升高、LDH升高、蛋白尿等,多为Ⅰ~Ⅱ级,患者多可耐受;Ⅲ级不良事件少见,无患者出现Ⅳ级非血液学不良事件。其中10例(18.2%)患者发生胸腔积液,均为Ⅰ~Ⅱ级,7例于用药3个月内首次出现。
国际多中心随机对照Ⅲ期DASISION研究证实,达沙替尼100 mg,每日1次口服,能有效用于CML-CP的一线长期治疗,并且安全性良好[5]。但原研达沙替尼在国内尚未申报一线治疗适应证。基于此,我们开展了多中心、开放性、前瞻性、单臂临床研究,旨在评价国产达沙替尼治疗CML-CP患者的有效性和安全性。在这一项研究中,国产达沙替尼剂量为100 mg,每日1次。
DASISION 5年随访研究证实接受达沙替尼治疗的患者分子学缓解率更高,而3个月获得BCR-ABLIS≤10%的患者无进展生存(PFS)期及总生存(OS)期显著延长,提示早期分子学反应对评估预后有重要意义,而且分子学反应深度也是决定CML停药和实现无治疗缓解(TFR)的一个关键因素[5,6]。本研究结果显示,国产达沙替尼治疗3、6、12个月时分别有81.8%、76.4%、80.8%的患者达到最佳疗效反应。同时,国产达沙替尼治疗12个月MR4.0率及MR4.5率分别为38.5%及28.8%,高于DASISION研究中的MR4.0率和MR4.5率(5%)[5]。通过对比本研究与DASISION研究达沙替尼组患者的基线特征发现,本研究入组患者质量在多方面更优,可能是造成疗效显著优于DASISION研究的主要原因,包括ECOG 0分患者比例(94.5%对82%)、Hasford低中危患者比例(91%对81%)、中位外周血和骨髓原始细胞比例[0(0~5%)对1%(0~10%),1%(0~6%)对2%(0~14%)],其中原始细胞比例的差异源自我国诊断CML-CP基于WHO外周血或骨髓中原始细胞<10%的标准,美国MDACC标准为<15%。此外,本研究中自诊断到入组接受达沙替尼治疗中位时间更短[17(2~111)d对30(1~291)d],可能更早接受达沙替尼治疗会让CML-CP患者获益更多。本研究目前的结果显示国产达沙替尼能快速且深度靶向清除BCR-ABL融合基因,从而抑制BCR-ABL激酶活性。该结论仍需延长随访时间予以证实。
既往研究证实CML患者接受12个月伊马替尼治疗同时获得CCyR及MMR预示进展风险更低[7]。MMR的获得与持续CCyR相关[8,9]。接受伊马替尼治疗12个月时获得MMR的患者在随访8年后均未发生加速或急变[10]。因此,在长期随访中,更多的患者快速并同时获得CCyR及MMR成为一个非常重要的治疗目标[7]。本研究结果显示,国产达沙替尼治疗12个月CCyR率达93.9%,MMR率达80.8%,疗效理想,高于历史对照DASASION研究CCyR率(83%)和MMR率(46%)。更令人兴奋的是,本研究治疗3个月即获得74.1%的CCyR率,足以反映国产达沙替尼快速起效的特点。需指出的是,我们目前的研究随访时间短,不足以反映国产达沙替尼对OS的影响。另外,IRIS研究表明,不同Sokal评分分层患者经伊马替尼治疗后所获得的CCyR率和MMR率差异有统计学意义[10,11];但本研究结果中,Sokal评分低危和中高危患者接受国产达沙替尼治疗12个月获得的MMR率分别为85.7%和75.0%,差异并无统计学意义(P>0.05),提示国产达沙替尼可能改善Sokal中高危患者的预后,但由于本研究高危患者占比不足10%,未来还需要扩大样本量的研究予以证实。
安全性评估结果显示,本组病例中血液学不良事件较非血液学不良事件多见,其中血小板计数下降的发生率最高,达65.5%。血液学不良事件以Ⅰ~Ⅱ级为主,无需特殊处理。而Ⅲ~Ⅳ级不良事件多经过减量或短暂停药即可恢复。非血液学不良事件亦多为Ⅰ~Ⅱ级,Ⅲ级非血液学不良事件少见,无患者发生Ⅳ级非血液学不良事件。ALT升高最常见,发生率为23.6%。备受关注的胸腔积液发生率为18.2%(10/55),均为Ⅰ~Ⅱ级,导致1例患者中途退出研究、1例暂停用药、4例剂量调整、1例暂停用药且剂量调整,多数患者经减量或暂停用药后获得缓解。10例出现胸腔积液的患者中,7例于用药后3个月内首次出现胸腔积液;12个月CCyR率为100%(8/8,1例未查、1例退组),12个月MMR率为89%(8/9,1例退组),高于总体人群的93.9%和80.8%。DASISION 1年随访研究中胸腔积液的发生率为10%,26例患者12个月CCyR率为92%[12];随访5年胸腔积液的发生率28%,96%的患者达到经确认的CCyR,82%达到MMR[5]。CA180-034研究两年随访中[13],二线使用达沙替尼(100 mg每日1次)的CML-CP患者胸腔积液发生率为14%,发生胸腔积液的患者与未发生的患者相比,PFS与OS相似,CCyR率更高(OR=2.1,95%CI 1.3~3.5),胸腔积液不良反应并未影响达沙替尼的短期与长期疗效,且可能加快达沙替尼的反应率。因胸腔积液退组的患者年龄72岁,是10例患者中唯一70岁以上的患者,退组时间为第二次胸腔积液出现后。D-First研究表明:胸腔积液的发生与年龄有关,年龄>60岁的患者胸腔积液发生率显著高于年龄<60岁的患者(P<0.01)[14]。本研究中,所有患者随访1年无一例发生肺动脉高压,但我们依然强调严密监测心脏超声检查,以尽早发现并处理肺动脉高压。此外,Marin等[15,16]证实不良事件的发生会降低患者服用TKI药物的依从性,但本研究无一例患者存在依从性问题。
总之,我们的研究结果初步显示,CML-CP患者一线接受国产达沙替尼治疗能快速获得CCyR及MMR,相当比例的患者还能获得更深的分子学反应,同时安全性良好。


























