
分析酪氨酸激酶抑制剂(TKI)耐药的慢性髓性白血病(CML)患者BCR-ABL激酶区突变状况、类型和影响因素。
回顾性分析2001年6月至2019年9月就诊于北京大学人民医院并发生TKI耐药的CML患者的BCR-ABL激酶区突变状况。采用Sanger测序法检测BCR-ABL激酶区突变,二元Logistic回归模型进行多因素分析。
共纳入804例CML患者,发生1 093例次TKI耐药,其中对伊马替尼、尼洛替尼、达沙替尼耐药分别为576(52.7%)、238(21.8%)、279(25.5%)例次。伊马替尼、尼洛替尼和达沙替尼耐药患者BCR-ABL突变检出率分别为50.5%、63.9%和57.3%,T315I突变检出率均最高,分别为12.3%、27.3%和34.1%。此外,检出率≥5%的突变类型在伊马替尼耐药患者中为Y253F/H(7.5%)和F359V/C/I(5.6%),在尼洛替尼耐药患者中为F359V/C/I(12.2%)、Y253F/H(11.8%)和E255K/V(10.5%),在达沙替尼耐药患者中为F317L/V/I/C(11.5%)和E255K/V(5.4%)。多因素分析显示,TKI减停用药史是影响BCR-ABL突变检出的共同因素,无TKI减停用药史患者突变检出率更高。此外,男性、年龄小、无共存疾病、诊断至服用当前TKI间隔较长、开始服用当前TKI时为进展期、继发耐药、耐药时处于进展期或血液学耐药与较高比例检出BCR-ABL突变相关。发生治疗失败至筛查BCR-ABL突变时间间隔、耐药时当前TKI和总TKI服用时间也与突变检出率相关。服用达沙替尼或尼洛替尼、继发耐药与检出T315I突变相关。
CML患者发生TKI耐药时,半数以上的患者检测出BCR-ABL突变,其中T315I突变比例最高,人口学、疾病状态和TKI用药等临床特征与BCR-ABL突变的检出率和类型相关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
酪氨酸激酶抑制剂(TKI)显著改善了慢性髓性白血病(CML)患者的预后,但仍有部分患者在TKI治疗过程中出现耐药。既往研究显示,接受伊马替尼治疗的CML患者中,1年内20%~30%患者发生耐药[1,2,3]。BCR-ABL激酶区突变是TKI耐药的主要机制之一,突变改变了BCR-ABL的构象,影响其与TKI结合,进而抑制TKI抗肿瘤效应。其中,T315I突变患者对一代TKI(伊马替尼)和二代TKI(尼洛替尼、达沙替尼)广泛耐药[4]。BCR-ABL激酶区突变是国内外专家公认选择TKI治疗CML患者时的重要参考[5,6]。国外已有多项研究报道TKI耐药CML患者BCR-ABL激酶区突变的类型[7,8,9,10],国内也有研究报道中国TKI耐药CML患者的突变类型,但病例数相对较少[11,12,13]。为此,本研究中我们回顾性分析了自2001年6月至2019年9月于北京大学人民医院就诊并发生TKI耐药的CML患者,分析BCR-ABL激酶区突变在中国CML患者中的分布特征,并探究与BCR-ABL激酶区突变特别是T315I突变相关的因素。
回顾性收集2001年6月至2019年9月就诊于北京大学人民医院并发生TKI耐药的CML患者临床资料。CML的分期参考欧洲白血病网(European Leukemia Net, ELN)指南标准[5]。
①一线TKI耐药:采用ELN推荐中TKI作为一线治疗反应评估中的"治疗失败"标准:治疗3个月时未达完全血液学反应(CHR)或Ph+细胞比例>95%,治疗6个月时BCR-ABLIS>10%或Ph+细胞比例>35%,治疗12个月时BCR-ABLIS>1%或Ph+细胞比例>0,任何时间失去CHR、完全细胞遗传学反应(CCyR ,Ph+细胞为0)或主要分子学反应(MMR,BCR-ABLIS≤0.1%),出现新的BCR-ABL激酶区突变,进展至加速期或急变期,出现Ph+克隆演变(CCA/Ph+,Ph+细胞基础上的其他克隆性染色体异常)。②二线TKI耐药:治疗3个月时未达CHR或Ph+细胞比例>95%,治疗6个月时BCR-ABLIS>10%或Ph+细胞比例>65%,治疗12个月时BCR-ABLIS>10%或Ph+细胞比例>35%,任何时间失去CHR、部分细胞遗传学反应(PCyR,Ph+细胞比例1%~35%)、CCyR或MMR,出现新的BCR-ABL激酶区突变,进展至加速期或急变期,出现CCA/Ph+。③三线TKI耐药:目前国内外尚无统一的三线TKI耐药标准,本研究采用与二线TKI耐药相同的标准。④原发耐药:患者在治疗初期即对TKI缺乏血液学、细胞遗传学或分子学反应。⑤继发耐药:患者在获得一段时间、一定程度的治疗反应后再次丧失反应。⑥TKI耐药次数:同一患者先后服用多种TKI,每发生一种TKI耐药记为一次TKI耐药。⑦BAR-ABL突变:同一患者先后发生多次TKI耐药,每次TKI耐药时检出新的BCR-ABL突变类型记为服用该TKI时检出的BCR-ABL突变。
采用红细胞裂解法获得CML患者骨髓或外周血中有核细胞,采用TRIzol法提取总RNA。总RNA经逆转录酶逆转录成cDNA[14],按既往报道的方法采用巢式PCR进行ABL激酶区扩增,PCR终产物为863 bp,对应ABL蛋白的第219~506氨基酸[11]。将PCR测序结果与野生型ABL基因(美国GeneBank X16416.1)进行序列比对,确定突变类型。
连续变量通过ROC曲线确定影响突变的界值。患者疾病特征采用描述性统计分析,组间比较采用Person卡方检验。将单因素分析中P<0.2的因素纳入二元Logistic回归模型进行多因素分析,P<0.05为差异有统计学意义。采用SPSS 22.0软件进行统计学分析。
本研究纳入804例CML患者,共发生1 093例次TKI耐药,其中对伊马替尼、尼洛替尼和达沙替尼耐药分别为576(52.7%)、238(21.8%)和279例次(25.5%)。男性710例次(65.0%),中位年龄38(4~83)岁,468例次(42.8%)合并其他疾病,162例次(14.8%)在开始服用当前TKI时为进展期(加速期或急变期),479例次(43.8%)曾有TKI减停用药史。554例次(50.7%)为TKI原发耐药。对当前TKI耐药时,有182(16.7%)、104(9.5%)、518(47.4%)和200例次(18.3%)分别处于进展期、血液学耐药(慢性期、但丧失或未达CHR)、细胞遗传学耐药和分子学耐药。804例患者中,检测T315I突变时所服用的TKI(一次或多次BCR-ABL突变检测均未检出突变者记首次检测时所服用的TKI,检出非T315I突变者记首次检出该突变时所服用的TKI,检出T315I突变者记首次检出T315I突变时所服用的TKI)分别为伊马替尼386例(48.0%),尼洛替尼182例(22.6%),达沙替尼236例(29.4%);一代TKI 386例(48.0%),二代TKI 418例(52.0%);一线TKI 423例(52.6%),二线TKI 273例(34.0%),三线及以上TKI 108例(13.4%)。对伊马替尼、尼洛替尼和达沙替尼耐药患者的临床特征详见表1。
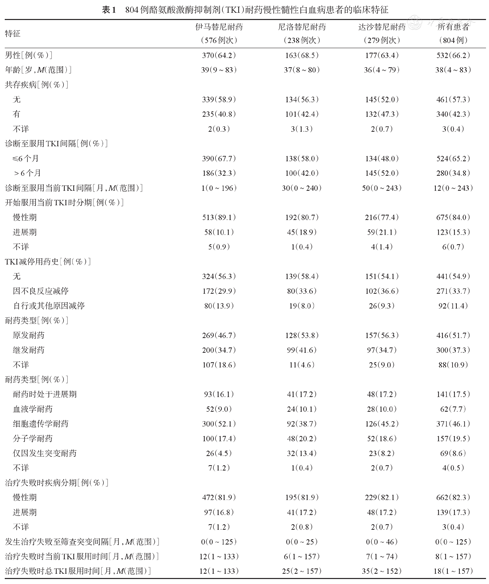
804例酪氨酸激酶抑制剂(TKI)耐药慢性髓性白血病患者的临床特征
804例酪氨酸激酶抑制剂(TKI)耐药慢性髓性白血病患者的临床特征
| 特征 | 伊马替尼耐药(576例次) | 尼洛替尼耐药(238例次) | 达沙替尼耐药(279例次) | 所有患者(804例) | |
|---|---|---|---|---|---|
| 男性[例(%)] | 370(64.2) | 163(68.5) | 177(63.4) | 532(66.2) | |
| 年龄[岁,M(范围)] | 39(9~83) | 37(8~80) | 36(4~79) | 38(4~83) | |
| 共存疾病[例(%)] | |||||
| 无 | 339(58.9) | 134(56.3) | 145(52.0) | 461(57.3) | |
| 有 | 235(40.8) | 101(42.4) | 132(47.3) | 340(42.3) | |
| 不详 | 2(0.3) | 3(1.3) | 2(0.7) | 3(0.4) | |
| 诊断至服用TKI间隔[例(%)] | |||||
| ≤6个月 | 390(67.7) | 138(58.0) | 134(48.0) | 524(65.2) | |
| >6个月 | 186(32.3) | 100(42.0) | 145(52.0) | 280(34.8) | |
| 诊断至服用当前TKI间隔[月,M(范围)] | 1(0~196) | 30(0~240) | 50(0~243) | 12(0~243) | |
| 开始服用当前TKI时分期[例(%)] | |||||
| 慢性期 | 513(89.1) | 192(80.7) | 216(77.4) | 675(84.0) | |
| 进展期 | 58(10.1) | 45(18.9) | 59(21.1) | 123(15.3) | |
| 不详 | 5(0.9) | 1(0.4) | 4(1.4) | 6(0.7) | |
| TKI减停用药史[例(%)] | |||||
| 无 | 324(56.3) | 139(58.4) | 151(54.1) | 441(54.9) | |
| 因不良反应减停 | 172(29.9) | 80(33.6) | 102(36.6) | 271(33.7) | |
| 自行或其他原因减停 | 80(13.9) | 19(8.0) | 26(9.3) | 92(11.4) | |
| 耐药类型[例(%)] | |||||
| 原发耐药 | 269(46.7) | 128(53.8) | 157(56.3) | 416(51.7) | |
| 继发耐药 | 200(34.7) | 99(41.6) | 97(34.7) | 300(37.3) | |
| 不详 | 107(18.6) | 11(4.6) | 25(9.0) | 88(10.9) | |
| 耐药类型[例(%)] | |||||
| 耐药时处于进展期 | 93(16.1) | 41(17.2) | 48(17.2) | 141(17.5) | |
| 血液学耐药 | 52(9.0) | 24(10.1) | 28(10.0) | 62(7.7) | |
| 细胞遗传学耐药 | 300(52.1) | 92(38.7) | 126(45.2) | 371(46.1) | |
| 分子学耐药 | 100(17.4) | 48(20.2) | 52(18.6) | 157(19.5) | |
| 仅因发生突变耐药 | 26(4.5) | 32(13.4) | 23(8.2) | 69(8.6) | |
| 不详 | 7(1.2) | 1(0.4) | 2(0.7) | 4(0.5) | |
| 治疗失败时疾病分期[例(%)] | |||||
| 慢性期 | 472(81.9) | 195(81.9) | 229(82.1) | 662(82.3) | |
| 进展期 | 97(16.8) | 41(17.2) | 48(17.2) | 139(17.3) | |
| 不详 | 7(1.2) | 2(0.8) | 2(0.7) | 3(0.4) | |
| 发生治疗失败至筛查突变间隔[月,M(范围)] | 0(0~125) | 0(0~25) | 0(0~46) | 0(0~125) | |
| 治疗失败时当前TKI服用时间[月,M(范围)] | 12(1~133) | 6(1~157) | 7(1~74) | 8(1~157) | |
| 治疗失败时总TKI服用时间[月,M(范围)] | 12(1~133) | 25(2~157) | 35(2~152) | 18(1~157) | |
576例次伊马替尼耐药中,291例次(50.5%)检出突变,其中54例次(9.4%)检出至少2种突变。在所有44种BCR-ABL突变类型中,T315I突变发生率最高,共71例次(12.3%),其次为Y253F/H(43例次,7.5%)、F359V/C/I(32例次,5.6%)(图1A)。P环突变共105例次(18.2%),包括Y253F/H(43例次,7.5%)、E255K/V(25例次,4.3%)、G250E(22例次,3.8%)、Q252H(8例次,1.4%)和L248V(7例次,1.2%)。
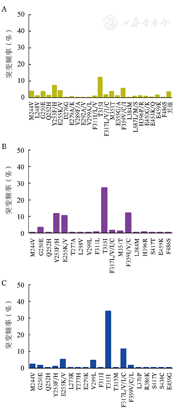

238例次尼洛替尼耐药中,152例次(63.9%)检出突变,其中25例次(10.5%)检出至少2种突变。共检出18种突变类型,其中T315I突变发生率最高(65例次,27.3%),其次为F359V/C/I(29例次,12.2%)、Y253F/H(28例次,11.8%)和E255K/V(25例次,10.5%),发生率均>5%(图1B)。P环突变共62例次(26.1%),包括Y253F/H(28例次,11.8%)、E255K/V(25例次,10.5%)、G250E(8例次,3.4%)和Q252H(1例次,1.4%)。
279例次达沙替尼耐药中,160例次(57.3%)检出突变,其中24例次(8.6%)检出至少2种突变。共检出19种突变类型,其中T315I突变发生率最高(95例次,34.1%),其次为F317L/V/I/C(32例次,11.5%)、E255K/V(15例次,5.4%),发生率均>5%(图1C)。P环突变共24例次(8.6%),包括E255K/V(15例次,5.4%)、G250E(5例次,1.8%)、Y253F/H(3例次,1.1%)和Q252H(1例次,0.4%)。
将检出任意BCR-ABL突变作为终点,根据ROC曲线确定相应连续变量的界值如下:在伊马替尼、尼洛替尼、达沙替尼耐药患者中,年龄分别为46、30和49岁,诊断至服用当前TKI间隔分别为6、30和30个月,发生治疗失败至筛查突变间隔分别为6、0和1个月,治疗失败时当前TKI服用时间分别为8、7和15个月,治疗失败时总TKI服用时间分别为8、7和17个月。将检出T315I突变作为终点,根据ROC曲线确定相应连续变量的界值如下:年龄为49岁,诊断至服用当前TKI间隔为6个月,发生治疗失败至筛查突变间隔为0个月,治疗失败时当前TKI服用时间为47个月,治疗失败时总TKI服用时间为14个月。
在伊马替尼、尼洛替尼和达沙替尼耐药的CML患者中分别分析影响检出突变的因素,单因素分析纳入年龄、性别、共存疾病、开始服用当前TKI时分期、诊断至服用TKI间隔、诊断至服用当前TKI间隔、TKI减停用药史、耐药时当前TKI服用时间、耐药类型(原发耐药或继发耐药;耐药时处于进展期、血液学耐药、细胞遗传学耐药、分子学耐药)、发生治疗失败至筛查BCR-ABL突变间隔等因素。在所有TKI耐药CML患者中分析影响检出T315I突变的因素,单因素分析时,除上述因素外,还纳入了当前TKI种类(伊马替尼、尼洛替尼或达沙替尼;一代或二代;一线、二线或三线及以上)。单因素分析结果详见表2和表3。
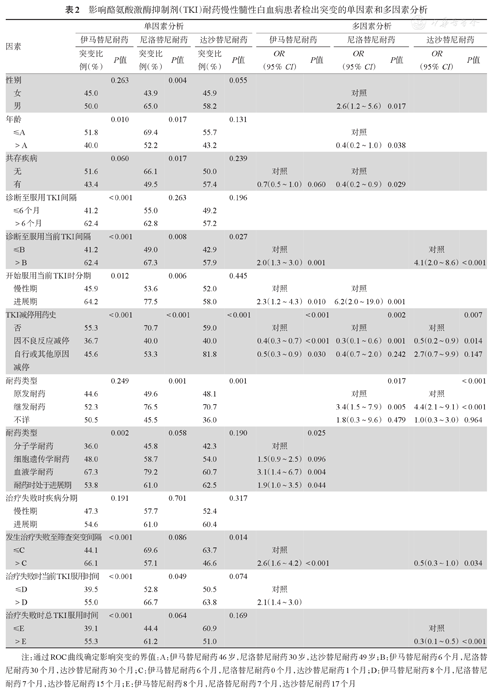
影响酪氨酸激酶抑制剂(TKI)耐药慢性髓性白血病患者检出突变的单因素和多因素分析
影响酪氨酸激酶抑制剂(TKI)耐药慢性髓性白血病患者检出突变的单因素和多因素分析
| 因素 | 单因素分析 | 多因素分析 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 伊马替尼耐药 | 尼洛替尼耐药 | 达沙替尼耐药 | 伊马替尼耐药 | 尼洛替尼耐药 | 达沙替尼耐药 | ||||||||
| 突变比例(%) | P值 | 突变比例(%) | P值 | 突变比例(%) | P值 | OR(95%CI) | P值 | OR(95%CI) | P值 | OR(95%CI) | P值 | ||
| 性别 | 0.263 | 0.004 | 0.055 | ||||||||||
| 女 | 45.0 | 43.9 | 45.9 | 对照 | |||||||||
| 男 | 50.0 | 65.0 | 58.2 | 2.6(1.2~5.6) | 0.017 | ||||||||
| 年龄 | 0.010 | 0.017 | 0.131 | ||||||||||
| ≤A | 51.8 | 69.4 | 55.7 | 对照 | |||||||||
| >A | 40.0 | 52.2 | 43.2 | 0.4(0.2~1.0) | 0.038 | ||||||||
| 共存疾病 | 0.060 | 0.017 | 0.239 | ||||||||||
| 无 | 51.6 | 66.1 | 50.0 | 对照 | 对照 | ||||||||
| 有 | 43.4 | 49.5 | 57.4 | 0.7(0.5~1.0) | 0.060 | 0.4(0.2~0.9) | 0.029 | ||||||
| 诊断至服用TKI间隔 | <0.001 | 0.263 | 0.196 | ||||||||||
| ≤6个月 | 41.2 | 55.0 | 49.2 | ||||||||||
| >6个月 | 62.4 | 62.8 | 57.2 | ||||||||||
| 诊断至服用当前TKI间隔 | <0.001 | 0.008 | 0.027 | ||||||||||
| ≤B | 41.2 | 49.0 | 42.9 | 对照 | 对照 | ||||||||
| >B | 62.4 | 67.3 | 57.9 | 2.0(1.3~3.0) | 0.001 | 4.1(2.0~8.6) | <0.001 | ||||||
| 开始服用当前TKI时分期 | 0.012 | 0.006 | 0.445 | ||||||||||
| 慢性期 | 45.9 | 53.6 | 52.0 | 对照 | 对照 | ||||||||
| 进展期 | 64.2 | 77.5 | 58.0 | 2.3(1.2~4.3) | 0.010 | 6.2(2.0~19.0) | 0.001 | ||||||
| TKI减停用药史 | <0.001 | <0.001 | <0.001 | <0.001 | 0.002 | 0.007 | |||||||
| 否 | 55.3 | 70.7 | 59.0 | 对照 | 对照 | 对照 | |||||||
| 因不良反应减停 | 36.7 | 40.0 | 40.0 | 0.4(0.3~0.7) | <0.001 | 0.3(0.1~0.6) | 0.001 | 0.5(0.2~0.9) | 0.014 | ||||
| 自行或其他原因减停 | 45.6 | 53.3 | 81.8 | 0.5(0.3~0.9) | 0.030 | 0.4(0.7~2.0) | 0.242 | 2.7(0.7~9.9) | 0.147 | ||||
| 耐药类型 | 0.249 | 0.001 | 0.001 | 0.017 | <0.001 | ||||||||
| 原发耐药 | 44.6 | 49.6 | 48.1 | 对照 | 对照 | ||||||||
| 继发耐药 | 52.3 | 76.5 | 70.7 | 3.4(1.5~7.9) | 0.005 | 4.4(2.1~9.1) | <0.001 | ||||||
| 不详 | 50.5 | 45.5 | 36.0 | 1.8(0.3~9.6) | 0.479 | 1.0(0.3~3.0) | 0.964 | ||||||
| 耐药类型 | 0.002 | 0.058 | 0.190 | 0.025 | |||||||||
| 分子学耐药 | 36.0 | 45.8 | 42.3 | 对照 | |||||||||
| 细胞遗传学耐药 | 48.0 | 58.7 | 54.0 | 1.5(0.9~2.5) | 0.096 | ||||||||
| 血液学耐药 | 67.3 | 79.2 | 60.7 | 3.1(1.4~6.7) | 0.004 | ||||||||
| 耐药时处于进展期 | 53.8 | 61.0 | 62.5 | 1.9(1.0~3.5) | 0.044 | ||||||||
| 治疗失败时疾病分期 | 0.191 | 0.701 | 0.317 | ||||||||||
| 慢性期 | 47.3 | 57.7 | 52.4 | ||||||||||
| 进展期 | 54.6 | 61.0 | 60.4 | ||||||||||
| 发生治疗失败至筛查突变间隔 | <0.001 | 0.086 | 0.014 | ||||||||||
| ≤C | 44.1 | 69.6 | 63.7 | 对照 | |||||||||
| >C | 66.1 | 57.1 | 46.6 | 2.6(1.6~4.2) | <0.001 | 0.5(0.3~1.0) | 0.034 | ||||||
| 治疗失败时当前TKI服用时间 | <0.001 | 0.049 | 0.074 | ||||||||||
| ≤D | 39.5 | 52.8 | 50.5 | 对照 | |||||||||
| >D | 55.0 | 66.7 | 63.8 | 2.1(1.4~3.0) | |||||||||
| 治疗失败时总TKI服用时间 | <0.001 | 0.064 | 0.169 | ||||||||||
| ≤E | 39.1 | 44.4 | 60.9 | 对照 | |||||||||
| >E | 55.3 | 61.2 | 51.0 | 0.3(0.1~0.5) | <0.001 | ||||||||
注:通过ROC曲线确定影响突变的界值:A:伊马替尼耐药46岁,尼洛替尼耐药30岁,达沙替尼耐药49岁;B:伊马替尼耐药6个月,尼洛替尼耐药30个月,达沙替尼耐药30个月;C:伊马替尼耐药6个月,尼洛替尼耐药0个月,达沙替尼耐药1个月;D:伊马替尼耐药8个月,尼洛替尼耐药7个月,达沙替尼耐药15个月;E:伊马替尼耐药8个月,尼洛替尼耐药7个月,达沙替尼耐药17个月
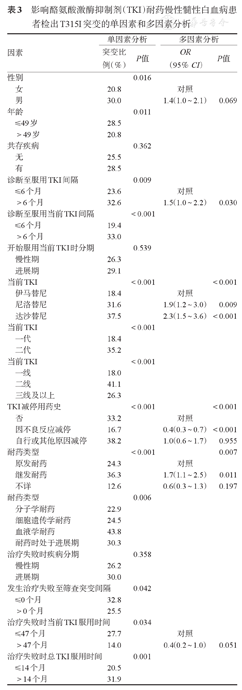
影响酪氨酸激酶抑制剂(TKI)耐药慢性髓性白血病患者检出T315I突变的单因素和多因素分析
影响酪氨酸激酶抑制剂(TKI)耐药慢性髓性白血病患者检出T315I突变的单因素和多因素分析
| 因素 | 单因素分析 | 多因素分析 | |||
|---|---|---|---|---|---|
| 突变比例(%) | P值 | OR(95%CI) | P值 | ||
| 性别 | 0.016 | ||||
| 女 | 20.8 | 对照 | |||
| 男 | 30.0 | 1.4(1.0~2.1) | 0.069 | ||
| 年龄 | 0.011 | ||||
| ≤49岁 | 28.5 | ||||
| >49岁 | 20.8 | ||||
| 共存疾病 | 0.362 | ||||
| 无 | 25.5 | ||||
| 有 | 28.5 | ||||
| 诊断至服用TKI间隔 | 0.009 | ||||
| ≤6个月 | 23.6 | 对照 | |||
| >6个月 | 32.6 | 1.5(1.0~2.2) | 0.030 | ||
| 诊断至服用当前TKI间隔 | <0.001 | ||||
| ≤6个月 | 19.4 | ||||
| >6个月 | 33.0 | ||||
| 开始服用当前TKI时分期 | 0.539 | ||||
| 慢性期 | 26.3 | ||||
| 进展期 | 29.1 | ||||
| 当前TKI | <0.001 | <0.001 | |||
| 伊马替尼 | 18.4 | 对照 | |||
| 尼洛替尼 | 31.6 | 1.9(1.2~3.0) | 0.009 | ||
| 达沙替尼 | 37.5 | 2.3(1.5~3.6) | <0.001 | ||
| 当前TKI | <0.001 | ||||
| 一代 | 18.4 | ||||
| 二代 | 35.2 | ||||
| 当前TKI | <0.001 | ||||
| 一线 | 18.0 | ||||
| 二线 | 41.1 | ||||
| 三线及以上 | 26.3 | ||||
| TKI减停用药史 | <0.001 | <0.001 | |||
| 否 | 33.2 | 对照 | |||
| 因不良反应减停 | 16.7 | 0.4(0.3~0.7) | <0.001 | ||
| 自行或其他原因减停 | 38.2 | 1.0(0.6~1.7) | 0.955 | ||
| 耐药类型 | <0.001 | 0.007 | |||
| 原发耐药 | 24.3 | 对照 | |||
| 继发耐药 | 36.3 | 1.7(1.1~2.5) | 0.011 | ||
| 不详 | 12.6 | 0.6(0.3~1.3) | 0.197 | ||
| 耐药类型 | 0.006 | ||||
| 分子学耐药 | 22.9 | ||||
| 细胞遗传学耐药 | 24.5 | ||||
| 血液学耐药 | 43.8 | ||||
| 耐药时处于进展期 | 30.3 | ||||
| 治疗失败时疾病分期 | 0.358 | ||||
| 慢性期 | 26.2 | ||||
| 进展期 | 30.0 | ||||
| 发生治疗失败至筛查突变间隔 | 0.042 | ||||
| ≤0个月 | 32.8 | ||||
| >0个月 | 25.5 | ||||
| 治疗失败时当前TKI服用时间 | 0.034 | ||||
| ≤47个月 | 27.7 | 对照 | |||
| >47个月 | 14.0 | 0.4(0.2~1.0) | 0.051 | ||
| 治疗失败时总TKI服用时间 | 0.001 | ||||
| ≤14个月 | 20.5 | ||||
| >14个月 | 31.9 | ||||
在伊马替尼、尼洛替尼和达沙替尼耐药CML患者中分别分析影响BCR-ABL突变检出的因素,多因素分析结果如表2所示,TKI减停用药史是影响BCR-ABL突变检出的共同因素,因不良反应减停TKI的患者突变检出率均较无TKI减停用药史的患者更低。此外,男性、年龄小、无共存疾病、诊断至服用当前TKI间隔时间长、服用当前TKI时为进展期、继发耐药、耐药时处于进展期或血液学耐药和治疗失败时当前TKI服用时间长的患者突变检出率更高。发生治疗失败至筛查BCR-ABL突变时间间隔也与检出突变相关,在伊马替尼耐药CML患者中,间隔>6个月的患者突变检出率更高,而在达沙替尼耐药CML患者中,间隔≤1个月的患者突变检出率更高。
在所有CML患者中分析影响T315I突变检出的因素,多因素分析结果显示,男性(P=0.069)、诊断至首次服用TKI间隔>6个月、服用尼洛替尼或达沙替尼和继发耐药患者T315I突变检出率更高,因不良反应减停TKI和治疗失败时当前TKI服用时间>47个月(P=0.051)的患者T315I突变检出率更低(表3)。
我们的研究结果显示,伊马替尼、尼洛替尼和达沙替尼耐药CML患者BCR-ABL突变检出率分别为50.5%、63.9%和57.3%,其中T315I突变检出率均为最高,分别为12.3%、27.3%和34.1%。无TKI减停用药史是影响伊马替尼、尼洛替尼和达沙替尼耐药患者检出突变的共同因素。对T315I突变分析显示,男性、诊断至首次服用TKI间隔>6个月、服用尼洛替尼或达沙替尼和继发耐药患者T315I突变检出率更高,因不良反应减停TKI和治疗失败时当前TKI服用时间>47个月的患者T315I突变检出率更低。
既往研究发现,伊马替尼、尼洛替尼和达沙替尼耐药CML患者BCR-ABL突变检出率分别为12%~63%、24%~28%和14%~27%,其中多项研究中T315I突变检出率最高[15]。本研究中伊马替尼、尼洛替尼和达沙替尼耐药CML患者BCR-ABL突变检出率与既往研究报道一致。
本研究结果显示,伊马替尼、尼洛替尼或达沙替尼耐药的CML患者中,无TKI减停用药史患者突变检出率高于因不良反应减停TKI的患者。Vaidya等[16]发现BCR-ABL突变与TKI选择压力有关。因此,无TKI减停史患者突变检出率高可能与TKI压力性选择作用更强相关。
尼洛替尼耐药CML患者中,男性和年轻患者BCR-ABL突变检出率更高。Pagnano等[17]报道了一项多中心回顾性研究,TKI(包括伊马替尼、尼洛替尼和达沙替尼)耐药的CML患者中,检出突变患者较未检出突变患者中位年龄更小[49(15~89)岁对51(15~89)岁,P=0.01],男性患者比例更高(64.1%对56.0%,P=0.08)。伊马替尼和达沙替尼耐药患者中,发生治疗失败至筛查突变间隔与突变检出率相关,伊马替尼耐药患者间隔越长(>6个月),突变检出率更高,而在达沙替尼耐药患者中,间隔越短(<1个月),突变检出率更高。这种差异可能是由于伊马替尼多作为一线治疗,而达沙替尼则多作为二线或三线治疗。
我们的研究结果显示,诊断至服用当前TKI间隔长、耐药时处于进展期或血液学耐药、继发耐药与BCR-ABL突变检出率更高相关,与多项研究结果一致[8, 10,11]。
对影响T315I突变的因素分析显示,尼洛替尼和达沙替尼耐药的CML患者较伊马替尼耐药患者T315I突变发生率更高,这可能是由于尼洛替尼和达沙替尼更多作为二线或三线治疗,尤其达沙替尼在国内尚未批准作为一线治疗。DASISION研究两年随访结果显示,达沙替尼组发生BCR-ABL突变的患者中,T315I突变占70%(7/10),而伊马替尼组发生BCR-ABL突变的患者中无T315I突变[18]。Branford等[19]报道在伊马替尼耐药患者中,治疗失败时加速期或急变期患者较慢性期患者T315I突变检出率更高。本研究未得到类似结果,可能是由于本研究中CML患者服用的TKI除伊马替尼外,还包括尼洛替尼和达沙替尼。
本研究不足之处包括:①非前瞻性、随机研究;②并非所有患者均规律监测了血液学、细胞遗传学和分子学反应,一定程度上干扰了耐药准确时间、耐药类型和突变检出时间的判断。
总之,我们的研究结果显示,伊马替尼、尼洛替尼和达沙替尼耐药的CML患者,半数以上均检测出BCR-ABL突变,其中T315I突变比例均为最高,人口学、疾病状态和TKI用药等临床特征与BCR-ABL突变的检出率和类型显著相关。



























