
评估艾曲泊帕联合免疫抑制治疗(IST)在中国再生障碍性贫血(AA)患者中的疗效及安全性。
调查分析2015年4月至2019年5月来自中国14个血液病治疗中心、连续应用艾曲泊帕治疗至少3个月的输血依赖非重型和重型AA患者临床资料。
纳入19例IST初治及37例IST难治性AA患者,中位艾曲泊帕治疗时间为7(3~31)个月,中位艾曲泊帕最大稳定使用剂量为75(50~150)mg/d。10例应用艾曲泊帕联合标准IST一线治疗的SAA患者3个月血液学反应(HR)率为60%,完全HR(CR)率为30%;9例艾曲泊帕联合环孢素A(CsA)一线治疗SAA患者后3个月HR率为89%,CR率为44%。19例患者应用艾曲泊帕联合IST一线治疗,至调查随访时HR率为79%,CR率为52.6%。19例CsA±雄激素治疗无效的AA患者,艾曲泊帕开始治疗后3个月HR率为57.9%(11/19),最佳HR率为68.4%;标准IST治疗无效的难治性AA,艾曲泊帕治疗最佳HR率为44%。51%患者应用艾曲泊帕发生不同严重程度的不良反应,以胃肠道不适最为常见。
艾曲泊帕治疗可加快HR的获得,改善HR质量;残存造血细胞较多的AA患者或可采用非抗胸腺细胞球蛋白免疫抑制联合艾曲泊帕治疗;艾曲泊帕可作为CsA±雄激素治疗无效AA的补救治疗;艾曲泊帕不良反应轻微,多可耐受。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
再生障碍性贫血(AA)是自身免疫介导的骨髓衰竭综合征,其中,极重型/重型再生障碍性贫血(V/SAA)进行性贫血、出血和感染,病死率高。HLA相合造血干细胞移植受限于患者年龄、体能状况、供者来源及治疗相关风险等,因此更多患者接受免疫抑制治疗(IST)方案。然而,抗胸腺细胞球蛋白(ATG)联合环孢素A(CsA)的标准IST方案血液学反应(HR)率仅70%左右,且完全HR(CR)率不高,其重要原因之一为体内残存造血干细胞(HSC)较少[1]。
艾曲泊帕为一种小分子TPO受体激动剂,与造血干/祖细胞膜受体结合可促进其增殖分化,产生扩增体内残存HSC的作用,同时兼具免疫调节、诱导免疫耐受及鳌合祛铁作用[2]。文献报告艾曲泊帕联合IST治疗初治SAA患者有效率高达90%[3],而单药治疗难治/复发V/SAA患者可使40%~50%患者血象改善[4]。迄今,艾曲泊帕治疗中国AA患者HR及安全性评估的报道较少。为评估艾曲泊帕治疗中国AA患者的疗效及安全性,我们进行了多中心真实世界应用调查研究。
收集2015年4月至2019年5月来自中国14个血液病治疗中心诊断为输血依赖非重型再生障碍性贫血(TD-NSAA)及V/SAA并应用艾曲泊帕治疗的71例患者病例资料,艾曲泊帕使用剂量≥50 mg且连续应用至少3个月。15例因服药方法不正确(服药中断大于两周、分次服用或未空腹服用)而被剔除,最终56例患者纳入研究。
AA诊断参照国际粒细胞减少与AA研究组1987年标准[5],分型标准参照文献[6,7]。TD-NSAA分型诊断标准为AA患者外周血ANC<0.5×109/L或PLT<20×109/L或HGB<80 g/L,网织红细胞绝对值(ARC)<20×109/L。初治SAA疗效判定标准:①CR:HGB>100 g/L、PLT>100×109/L及ANC>1.5×109/L。②部分治疗反应(PR):脱离血制品输注依赖,血液学检查好转,不再符合SAA标准,但血常规未达到CR标准。③无治疗反应(NR):患者未脱离血制品输注支持治疗和(或)血液学检查仍符合SAA标准。TD-NSAA疗效判定标准:①CR同上。②PR:至少一系达正常水平或倍增,或初始HGB<60 g/L经治疗后至少升高30 g/L,或初始ANC<0.5×109/L经治疗后至少升高0.5×109/L,或初始PLT<20×109/L经治疗后至少升高20×109/L。③NR:血常规下降或未达上述PR标准。
难治性SAA定义[4]:标准IST难治性SAA:上述ATG联合CsA方案治疗6个月评价无效患者;CsA±雄激素难治性SAA:CsA方案治疗至少6个月,经疗效评估为无效患者。难治性SAA疗效标准[4]:血小板反应定义为PLT较基线增加≥20×109/L或治疗前依赖血小板输注(PLT<20×109/L)的患者至少连续8周不需输注血小板(PLT≥20×109/L);中性粒细胞反应定义为ANC较基线值增加一倍及以上或增加>0.5×109/L。血红蛋白反应定义为HGB较基线增加≥15 g/L;或依赖红细胞输注(HGB<80 g/L)的患者,与入组前8周相比,连续8周红细胞输注量减少4 U及以上。三系应答定义为同时发生血小板、红系和中性粒细胞应答的患者。不依赖输血定义为连续8周以上无血小板或红细胞输注。不再依赖使用G-CSF定义为入组前依赖使用G-CSF的患者,至少连续2周不再使用。
①ATG联合CsA方案:兔ATG 3.0~3.5 mg·kg-1·d-1×5 d或猪ATG 20~30 mg·kg-1·d-1×5 d;CsA起始剂量3~5 mg·kg-1·d-1,分2次口服,后根据CsA血药浓度调整剂量,维持CsA谷浓度150~250 μg/L。②CsA±雄激素方案:CsA剂量应用方法同前,雄激素为司坦唑醇2 mg每日3次或达那唑200 mg每日3次或十一酸睾酮40 mg每日3次口服。
本研究为多中心真实世界调查研究,故艾曲泊帕的应用时机及疗程并不统一,艾曲泊帕使用方法:25 mg或50 mg每日1次口服起始应用,未有明显不良反应及PLT升高<20×109/L或是仍依赖血小板输注,则每2周增加25 mg,至该患者最大使用剂量或150 mg/d。本研究中我们将患者至少2周连续使用的最大剂量设定为最大稳定剂量,本研究艾曲泊帕最大剂量为150 mg/d。
共56例患者符合研究纳入标准,最早起始应用艾曲泊帕时间为2015年4月,最末起始应用艾曲泊帕时间为2019年2月。中位年龄39(7~80)岁,其中男26例,女30例。包括14例VSAA、24例SAA、18例TD-NSAA。19例初治患者中10例应用艾曲泊帕联合ATG+CsA标准IST,9例应用艾曲泊帕联合CsA±雄激素治疗。37例难治性AA患者中,18例为ATG+CsA方案无效难治性、19例为CsA±雄激素方案难治性患者。中位艾曲泊帕治疗时间为7(3~31)个月,中位艾曲泊帕最大稳定剂量为75(50~150)mg,从艾曲泊帕开始应用至加量到稳定剂量的中位时间28(0~257)d。中位随访时间9(3~40)个月。艾曲泊帕治疗前患者临床及实验室特征见表1。
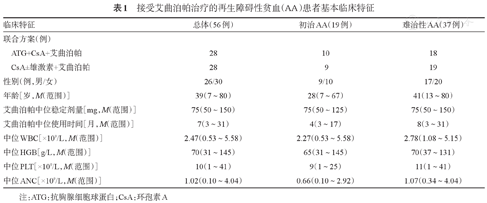
接受艾曲泊帕治疗的再生障碍性贫血(AA)患者基本临床特征
接受艾曲泊帕治疗的再生障碍性贫血(AA)患者基本临床特征
| 临床特征 | 总体(56例) | 初治AA(19例) | 难治性AA(37例) | |
|---|---|---|---|---|
| 联合方案(例) | ||||
| ATG+CsA+艾曲泊帕 | 28 | 10 | 18 | |
| CsA±雄激素+艾曲泊帕 | 28 | 9 | 19 | |
| 性别(例,男/女) | 26/30 | 9/10 | 17/20 | |
| 年龄[岁,M(范围)] | 39(7~80) | 28(7~67) | 41(13~80) | |
| 艾曲泊帕中位稳定剂量[mg,M(范围)] | 75(50~150) | 75(50~125) | 75(50~150) | |
| 艾曲泊帕中位使用时间[月,M(范围)] | 7(3~31) | 4(3~17) | 8(3~31) | |
| 中位WBC[×109/L,M(范围)] | 2.47(0.53~5.58) | 2.27(0.53~5.58) | 2.78(1.08~5.15) | |
| 中位HGB[g/L,M(范围)] | 70(31~145) | 65(31~145) | 70(37~131) | |
| 中位PLT[×109/L,M(范围)] | 10(1~41) | 9(1~25) | 11(1~41) | |
| 中位ANC[×109/L,M(范围)] | 1.02(0.10~4.04) | 0.66(0.10~2.92) | 1.07(0.34~4.04) | |
注:ATG:抗胸腺细胞球蛋白;CsA:环孢素A
10例初治AA患者接受艾曲泊帕联合标准IST,其中SAA 4例、VSAA 6例。艾曲泊帕均与ATG同时应用。治疗后3个月6例(60.0%)患者获得HR,其中3例(30.0%)外周血参数恢复正常,获得CR。至调查时间,一线ATG+CsA+艾曲泊帕治疗患者HR率达70.0%(7/10),其中5例为CR。4例SAA患者经ATG+CsA+艾曲泊帕方案治疗,治疗后3个月3例获得HR,至随访终点全部4例患者均获得HR。6例VSAA患者治疗后3个月3例获得HR,此后至随访终点未再有患者获得疗效。
9例患者一线接受了CsA±雄激素+艾曲泊帕治疗,包括SAA 6例、TD-NSAA 3例。治疗后3个月8例(88.9%)获得HR,4例(44.4%)获得CR;至随访终点,5例获得CR,而未再有新获HR者。
所有19例初治应用艾曲泊帕的SAA患者中,治疗后3个月HR率为73.6%(14/19)、CR率为36.8%(7/19)(表2)。
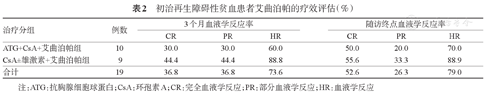
初治再生障碍性贫血患者艾曲泊帕的疗效评估(%)
初治再生障碍性贫血患者艾曲泊帕的疗效评估(%)
| 治疗分组 | 例数 | 3个月血液学反应率 | 随访终点血液学反应率 | ||||
|---|---|---|---|---|---|---|---|
| CR | PR | HR | CR | PR | HR | ||
| ATG+CsA+艾曲泊帕组 | 10 | 30.0 | 30.0 | 60.0 | 50.0 | 20.0 | 70.0 |
| CsA±雄激素+艾曲泊帕组 | 9 | 44.4 | 44.4 | 88.8 | 55.6 | 33.3 | 88.9 |
| 合计 | 19 | 36.8 | 36.8 | 73.6 | 52.6 | 26.3 | 79.0 |
注:ATG:抗胸腺细胞球蛋白;CsA:环孢素A;CR:完全血液学反应;PR:部分血液学反应;HR:血液学反应
18例应用标准IST无效的AA患者,艾曲泊帕治疗后3个月,4例获得三系HR(22.2%,4/18)、1例获得二系(红、粒系)HR、1例获得一系(红系)HR,总HR率为33.3%(6/18);至随访终点,6例获得三系HR(33.3%,6/18)、1例获得二系HR、1例获得一系HR,总HR率为44.4%(8/18)。非VSAA组(10例)与VSAA组(8例)疗效比较,艾曲泊帕治疗后3个月及随访终点时最佳HR率分别为30.0%对12.5%、50.0%对25.0%。
19例CsA±雄激素治疗无效的AA患者,艾曲泊帕治疗后3个月,6例获得三系HR(31.5%,6/19)、1例获得二系HR、4例获得一系HR,总HR率为57.9%(11/19)。至随访终点,9例获得三系HR(47.4%,9/19)、1例获得二系HR、3例获得一系HR,总HR率为68.4%(13/19)。
共计37例难治性患者中,应用艾曲泊帕治疗后3个月HR率为45.9%(17/37),10例(27.0%)获得三系HR,2例(5.4%)获得二系HR,5例(13.5%)获得一系HR;至随访终点时最佳HR率为57%(表3)。

复发/难治性再生障碍性贫血患者艾曲泊帕的疗效评估(例)
复发/难治性再生障碍性贫血患者艾曲泊帕的疗效评估(例)
| 治疗分组 | 例数 | 3个月HR | 随访终点HR | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 一系 | 二系 | 三系 | 总HR | 一系 | 二系 | 三系 | 总HR | ||
| ATG+CsA+艾曲泊帕组 | 18 | 1 | 1 | 4 | 6 | 1 | 1 | 6 | 8 |
| CsA±雄激素+艾曲泊帕组 | 19 | 4 | 1 | 6 | 11 | 3 | 1 | 9 | 13 |
| 合计 | 37 | 5 | 2 | 10 | 17 | 4 | 2 | 15 | 21 |
注:ATG:抗胸腺细胞球蛋白;CsA:环孢素A;HR:血液学反应
我们对最大稳定剂量与疗效的关系进行了分析,按中位艾曲泊帕剂量75 mg分组,19例初治SAA患者中,8例<75 mg组(50 mg 8例)3个月HR率为62.5%(5/8),11例≥75 mg组(75 mg 8例、100 mg 2例、125 mg 1例)3个月HR率为81.8%(9/11);37例难治性SAA患者中,21例≤75 mg组(50 mg 3例、75 mg 18例)3个月HR率为61.9%(13/21),16例>75 mg组(100 mg 11例、150 mg 5例)3个月HR率为25.0%(4/16)。
全部56例患者中27例(49.1%)无明显不良反应,另29例(50.9%)发生不同程度和不同类型的不良反应。17例(30.3%,17/56)发生胃肠道不良反应,主要表现为腹胀、食欲减低及腹泻,其中11例患者为轻度胃肠道不适,4例中度胃肠道不适,患者均可耐受,艾曲泊帕剂量未调整;另2例患者发生严重胃肠道不适,其中1例患者艾曲泊帕由100 mg减量至75 mg口服后症状消失,另1例患者因同时合并上肢血栓而停用艾曲泊帕后好转。3例(5.4%)发生转氨酶升高;2例(3.6%)发生胆红素升高;2例(3.6%)发生上肢静脉血栓,其中1例患者为经外周静脉穿刺中心静脉置管上肢静脉血栓,2例发生血栓时艾曲泊帕应用剂量均为100 mg/d,停用艾曲泊帕并对症处理均很快明显好转,未残留不适。6例(10.7%)发生轻度关节疼痛,7例(12.5%)发生皮肤相关改变(6例轻度皮肤瘙痒、1例轻度皮疹),均可耐受,未进行剂量调整。发生不良反应组及未发生不良反应组的艾曲泊帕中位剂量均为75 mg。
IST的目的是抑制或去除针对造血干/祖细胞的自身反应性T淋巴细胞,从而使残存造血细胞恢复自身造血。因而,采用该策略治疗AA,当异常免疫被抑制,HR的获得更多地取决于残存造血细胞的数量及质量。TPO受体激动剂艾曲泊帕作用于MPL跨膜区,可与内源性TPO协同作用刺激残存造血干/祖细胞体内扩增。2012年美国NIH一项艾曲泊帕2期单臂临床试验显示,应用艾曲泊帕治疗IST难治/复发性AA 12周可使44%的患者获得至少一系HR[4];而与一线标准IST联合使用,V/SAA的HR率明显提升至90%左右[3]。分析近年我国接受艾曲泊帕治疗AA患者疗效,57%难治及79%初治SAA患者获得HR,与欧美报告结果相似[3,4,8,9]。
本研究显示,一线标准ATG+CsA方案联合艾曲泊帕治疗我国AA患者,3个月HR率达60%,似乎与我们以往单用ATG+CsA方案治疗AA患者疗效无明显差异[10],但CR率(30.0%)则明显增高。除了提高疗效外,艾曲泊帕能够加快HR的获得,提高疗效质量。我们的结果表明,标准ATG+CsA方案难治性AA患者加用艾曲泊帕治疗仅44%患者获得HR,该结果与NIH报告结果相近,但明显低于Gill等[11]报告的70%。然而,Gill等[11]的研究样本量较小(10例),艾曲泊帕剂量为50~300 mg/d,明显大于本研究,可能是疗效差异的原因。
本研究中更为重要的提示来自于纳入的一线CsA±雄激素+艾曲泊帕患者和艾曲泊帕治疗CsA±雄激素方案无效的难治性AA患者结果。由于不同原因,SAA患者一线IST未能或不适合加用ATG,而采用CsA±雄激素+艾曲泊帕治疗的9例患者3个月时8例获得HR,4例获得CR,疗效与加用ATG方案似乎并无明显不同。考虑到这些采用一线CsA±雄激素+艾曲泊帕的患者大多为造血衰竭相对较轻的非VSAA患者,提示至少对于SAA和TD-NSAA,尤其后者或可采用非ATG方案联合艾曲泊帕进行治疗。
我们前期研究显示,SAA和TD-NSAA患者一线IST应采用ATG+CsA方案,较CsA±雄激素可获得更好疗效及疗效质量[12]。本组19例CsA±雄激素无效的难治性AA患者艾曲泊帕治疗后,13例(68%)获得HR,47%获得三系HR,表明对于一线未能采用标准治疗的难治性AA患者,艾曲泊帕不失为一个较好的补救治疗措施。
本研究显示,艾曲泊帕治疗我国患者不良反应发生率与欧美人种报道相似,常见的不良反应为胃肠道不适,其次是转氨酶升高、皮肤瘙痒及关节隐痛;本研究中仅有2例患者因不良反应停药。值得注意的是,56例患者中2例(3.6%)发生上肢静脉血栓事件,明显高于成人原发免疫性血小板减少症患者应用血小板生成素受体激动剂(TPO-RA)静脉血栓事件的年发病率(0.41%~0.67%)[13]。TPO-RA增加血栓发生的机制不详,与PLT和TPO-RA使用剂量也似乎无关[14]。本研究报告的这两例患者均为治疗无效、PLT持续明显低下患者,虽也难以认定血栓发生与艾曲泊帕使用的关系,但提示应用艾曲泊帕治疗的患者即便PLT尚未开始复升,仍需注意血栓事件的发生。
本研究为中国大陆地区首次报道艾曲泊帕在AA治疗中的疗效和安全性研究,鉴于本研究为回顾性多中心调查研究,患者纳入较分散,治疗方案、疾病严重程度相对不均一,相对于前瞻性临床研究证据明显不足,结果需慎重解读。艾曲泊帕是否会导致SAA患者克隆性进展是目前十分关注的问题,本研究参加中心监测患者染色体核型、体细胞突变等随访方案差别较大,未能获得明确结果,有待设计统一方案进行前瞻性研究。



























