
探讨IDH不同突变亚型及伴发不同基因突变在非M3型急性髓系白血病(AML)患者中的预后意义。
采用二代测序技术检测2016年6月至2018年12月就诊于郑州大学第一附属医院的389例AML患者的22种基因突变情况,通过Kaplan-Meier法及Cox回归模型分析影响预后的因素。
389例AML患者中,IDH1及IDH2的突变率分别为6.2%、8.7%,未发现IDH1与IDH2共突变的情况。IDH2突变型患者年龄偏大、骨髓原始细胞比例高、正常核型多见、常合并RUNX1突变及SRSF2突变。单因素方差分析发现,IDH1突变型组较野生型组的中位总生存(OS)及无进展生存(PFS)时间明显缩短(P值均<0.05);IDH2突变作为一个单变量对预后无显著影响,不同突变位点对预后的影响不同,IDH2R140突变对预后无显著影响,IDH2R172突变型患者较IDH2野生型患者完全缓解(CR)率明显减低、中位OS及PFS时间明显缩短(P值均<0.05)。在正常核型或年龄≥50岁的患者中,IDH不同突变亚型显示出同样的预后意义。74.1%(43/58)IDH突变患者同时携带其他基因突变,伴发基因突变数目对患者的预后无显著影响,IDH突变患者中伴NPM1突变者的CR率明显高于不伴NPM1突变者(81.8%对36.4%,P=0.014),伴DNMT3A突变者的中位OS时间短于不伴DNMT3A突变者[4.0(95%CI 3.8~4.2)个月对6.3(95%CI 2.4~10.2)个月,P=0.041]。多因素分析显示:年龄≥60岁、WBC≥100×109/L是影响患者OS及PFS的独立危险因素,2个疗程内CR、造血干细胞移植是影响患者OS及PFS的独立有利因素。
在AML(非M3型)患者中,IDH基因突变常与其他基因突变共存,IDH不同突变亚型及伴发基因突变显示出不同的预后意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性髓系白血病(AML)是具有高度异质性的血液系统恶性肿瘤,基因测序技术的发展揭示一些分子标志参与了AML的发病机制,并对患者的诊断分型、预后分层及个体化治疗产生重要的影响[1]。异柠檬酸脱氢酶(IDH)突变是成人AML中常见的基因突变,IDH1、IDH2基因在成人AML中的突变率分别为5.5%~14%、8.7%~19%[2],其对预后的影响一直存在争议。近年来的研究显示IDH不同突变亚型及伴发基因突变对AML患者的预后意义不同[2,3],鉴于此,本研究中我们对就诊于郑州大学第一附属医院的389例AML(非M3型)患者的临床特征、基因突变情况及预后影响因素进行分析。
收集2016年6月至2018年12月就诊于郑州大学第一附属医院的389例AML患者的病例资料,所有患者诊断符合WHO标准[4]。199例患者具有染色体核型结果,正常核型88例,异常核型111例。
抽取患者骨髓液2 ml,EDTA抗凝,提取骨髓单个核细胞,使用DNA提取试剂盒(中国天根生化科技公司生产)提取DNA,采用上海源奇生物医药科技有限公司生产的AML/骨髓增生异常综合征(MDS)第二代测序芯片检测NPM1、FLT3、C-KIT、CEBPA、DNMT3A、IDH1、IDH2、TET2、EZH2、RUNXl、ASXLl、PHF6、TP53、SF3BI、SRSF2、U2AF1、ZRSR2、NRAS、CBL、SETBP1、ETV6、JAK2等22种基因突变情况。
采用常规R显带技术进行核型分析。
诱导化疗采用标准剂量阿糖胞苷(100~200 mg·m-2·d-1×7 d)联合柔红霉素(60~90 mg·m-2·d-1×3 d)或去甲氧柔红霉素(8~12 mg·m-2·d-1×3 d)或米托蒽醌(6~10 mg·m-2·d-1×3 d),部分老年患者采用地西他滨(20 mg·m-2·d-1,第1~5天)联合预激方案(CAG、CHG方案,G:G-CSF 300 μg/d,第1~14天,WBC>20×109/L时停用;C:阿糖胞苷10 mg/m2,每12 h 1次,第1~14天;A:阿克拉霉素20 mg/d,第1~4天;H:高三尖杉酯碱1 mg·m-2·d-1,第1~14天),2个疗程后评估疗效,未达完全缓解(CR)的患者换用其他方案继续诱导治疗,达CR的患者按遗传学预后危险度分组治疗,分组标准参照文献[5]。预后良好组进行巩固强化治疗,预后中等组、预后不良组有合适供者的患者行造血干细胞移植,否则进行巩固强化治疗,巩固化疗方案包括中大剂量阿糖胞苷(1~2 g/m2,每12 h 1次,共6次)、标准剂量阿糖胞苷联合蒽环类/蒽醌类药物或高三尖杉酯碱(2 mg·m-2·d-1×7 d)、地西他滨联合预激方案。
采用电话、查阅病历的方法进行随访,随访截止时间为2019年12月30日。CR、部分缓解(PR)、未缓解(NR)的判定标准参照文献[5]。总生存(OS)时间定义为首次确诊至死亡或随访截止的时间。无进展生存(PFS)时间定义为首次确诊至疾病复发、进展、死亡或随访截止的时间。
采用SPSS25.0软件进行统计学分析,符合正态分布的定量资料以"均数±标准差"表示,采用t检验或方差分析,否则采用非参数秩和检验,并以"中位数(范围)"表示。计数资料组间比较采用χ2检验或Fisher确切概率法。Kaplan-Meier法绘制生存曲线,组间生存率的比较采用Log-rank法,多因素分析采用Cox回归模型。P<0.05为差异有统计学意义。
389例患者中58例(14.9%)检出IDH突变,IDH1突变24例(6.2%),其中I99M位点突变2例,R132位点突变22例;IDH2突变34例(8.7%),其中R140位点突变29例,R172位点突变5例。未发现IDH1与IDH2共突变患者。
结果见表1,与IDH2野生型组相比,IDH2突变型组高龄、骨髓原始细胞比例高、正常核型多见,常合并RUNX1突变及SRSF2突变(P值均<0.05)。
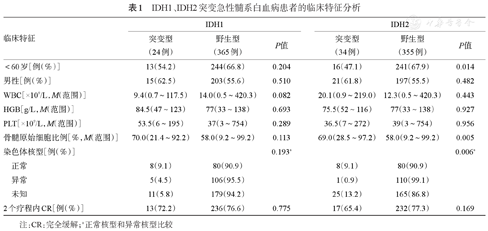
IDH1、IDH2突变急性髓系白血病患者的临床特征分析
IDH1、IDH2突变急性髓系白血病患者的临床特征分析
| 临床特征 | IDH1 | IDH2 | |||||
|---|---|---|---|---|---|---|---|
| 突变型(24例) | 野生型(365例) | P值 | 突变型(34例) | 野生型(355例) | P值 | ||
| <60岁[例(%)] | 13(54.2) | 244(66.8) | 0.204 | 16(47.1) | 241(67.9) | 0.014 | |
| 男性[例(%)] | 15(62.5) | 203(55.6) | 0.510 | 21(61.8) | 197(55.5) | 0.482 | |
| WBC[×109/L,M(范围)] | 9.4(0.7~117.5) | 14.0(0.5~420.3) | 0.082 | 20.1(0.9~219.0) | 12.3(0.5~420.3) | 0.443 | |
| HGB[g/L,M(范围)] | 84.5(47~123) | 77(33~138) | 0.693 | 75.5(52~116) | 77(33~138) | 0.927 | |
| PLT[×109/L,M(范围)] | 53.5(6~195) | 37(3~754) | 0.289 | 36.5(7~272) | 39(3~754) | 0.956 | |
| 骨髓原始细胞比例[%,M(范围)] | 70.0(21.4~92.2) | 58.0(9.2~99.2) | 0.113 | 69.0(28.5~97.2) | 58.0(9.2~99.2) | 0.005 | |
| 染色体核型[例(%)] | 0.193a | 0.006a | |||||
| 正常 | 8(9.1) | 80(90.9) | 8(9.1) | 80(90.9) | |||
| 异常 | 5(4.5) | 106(95.5) | 1(0.9) | 110(99.1) | |||
| 未知 | 11(5.8) | 179(94.2) | 25(13.2) | 165(86.8) | |||
| 2个疗程内CR[例(%)] | 13(72.2) | 236(76.6) | 0.775 | 17(65.4) | 232(77.3) | 0.169 | |
注:CR:完全缓解;a正常核型和异常核型比较
347例患者接受诱导化疗,2个疗程后有326例可评估疗效,IDH1突变型组与IDH1野生型组(72.2%对76.6%,P=0.775)、IDH2突变型组与IDH2野生型组(65.4%对77.3%,P=0.169)的CR率差异均无统计学意义。IDH2R172突变患者(5例)的CR率明显低于IDH2野生型组患者(0对77.3%,P=0.012),IDH2R140突变患者与IDH2野生型患者之间的CR率差异无统计学意义(73.9%对77.3%,P=0.797)。
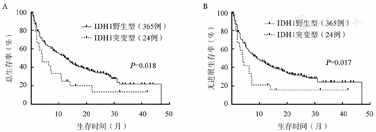
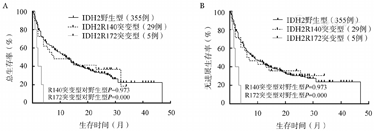
中位随访10.7(0.5~47.0)个月,单因素方差分析发现,IDH1突变型组较IDH1野生型组中位OS及PFS时间明显缩短(4.0个月对12.5个月,P=0.018;4.0个月对9.2个月,P=0.017)(图1)。IDH2突变型组与IDH2野生型组的中位OS及PFS时间差异无统计学意义(5.4个月对12.0个月,P=0.424;5.4个月对9.0个月,P=0.393),但IDH2不同的突变位点组,差异有统计学意义,R172位点突变患者的中位OS及PFS时间短于R140位点突变患者(2.0个月对7.7个月,P=0.006;2.0个月对7.0个月,P=0.008),亦明显低于IDH2野生型患者(2.0个月对12.0个月,P=0.000;2.0个月对9.0个月,P=0.000),而后两者差异无统计学意义(P=0.975,P=0.973)(图2)。


88例正常核型的患者中,IDH1突变型组(8例)较IDH1野生型组中位OS及PFS时间明显缩短(6.3个月对26.3个月,P=0.018;4.4个月对15.1个月,P=0.019),CR率明显提高,但差异无统计学意义(100%对76.4%,P=0.178)。IDH2突变型组与IDH2野生型组的CR率(71.4%对78.9%,P=0.649)、中位OS(2个月对15.0个月,P=0.476)及PFS时间(2.0个月对15.0个月,P=0.519)差异均无统计学意义。R140突变患者(6例)与野生型组的CR率(83.3%对78.9%,P=1.000)、中位OS(15.0个月对15.0个月,P=0.861)及PFS时间(14.0个月对15.0个月,P=0.819)差异均无统计学意义。2例R172突变患者均未达CR,OS时间分别为1.5、2.0个月,PFS时间分别为1.5、2.0个月,低于野生型组,因例数少,未行统计学分析。
以60岁为界将AML患者分为两组,IDH1、IDH2突变对两组的CR率、OS、PFS均无显著影响。但在年龄≥50岁的患者中,IDH1突变型组较IDH1野生型组中位OS及PFS时间均缩短(2.8个月对6.2个月,P=0.004;2.8个月对5.0个月,P=0.004),CR率差异无统计学意义(60.0%对66.5%,P=0.736)。IDH2突变型组与IDH2野生型组的CR率(55.6%对67.3%,P=0.319)、中位OS(4个月对5.3个月,P=0.927)及PFS时间(4个月对5个月,P=0.850)差异均无统计学意义。4例R172突变患者中2例无法评估疗效,其余2例均NR,OS时间分别为1.5、2.0个月,PFS时间分别为1.5、2.0个月,低于野生型组。R140突变患者(22例)与野生型患者的CR率(62.5%对67.3%,P=0.697)、中位OS(6.2个月对5.3个月,P=0.637)及PFS时间(6.2个月对5个月,P=0.719)差异均无统计学意义。
58例IDH突变患者中,43例(74.1%)伴发基因突变,其中伴1种基因突变24例,伴2种基因突变11例,伴3种基因突变8例,每例患者的平均基因突变数为2.2。伴发基因突变频率最高的为NPM1(15例),其次为NRAS(11例)、FLT3-ITD(11例)、DNMT3A(10例)、RUNX1(9例)、SRSF2(4例)、CEBPA(4例)、TET2(3例)、ASXL1(3例)、TP53(1例)、KIT(1例)、PNH6(1例)、ZRSR2(1例)、SETBP1(1例)。与伴发基因的相关性分析显示:IDH2突变患者的RUNX1突变频率及SRSF2突变频率高于IDH2野生型患者(P=0.006,P=0.001)。未发现IDH1突变与其他基因突变存在相关性(P值均>0.05)。
进一步分析伴发突变频率较高的基因(NPM1、NRAS、FLT3-ITD、DNMT3A、RUNX1)对IDH突变患者的预后影响发现,15例伴NPM1突变者的CR率明显高于阴性者(81.8%对36.4%,P=0.014),中位OS及PFS时间较阴性者均延长,但差异无统计学意义(P>0.05)。伴DNMT3A突变者的中位OS时间短于阴性者(4.0个月对6.3个月,P=0.041),CR率及中位PFS时间差异无统计学意义(P>0.05)。伴发基因突变数目对预后无显著影响:伴1种基因突变、伴2种基因突变、伴3种基因突变患者的CR率分别为82.4%(14/17)、70.0%(7/10)、75.0%(3/4),差异无统计学意义(P=0.387),中位OS及PFS时间差异均无统计学意义(P>0.05)。
将单因素分析中P<0.05的因素纳入多因素分析发现,年龄≥60岁、WBC≥100×109/L是影响患者OS及PFS的独立危险因素,2个疗程内CR、造血干细胞移植是影响患者OS及PFS的有利因素(表2)。
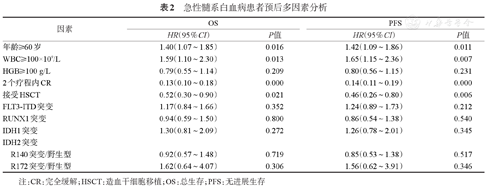
急性髓系白血病患者预后多因素分析
急性髓系白血病患者预后多因素分析
| 因素 | OS | PFS | |||
|---|---|---|---|---|---|
| HR(95%CI) | P值 | HR(95%CI) | P值 | ||
| 年龄≥60岁 | 1.40(1.07~1.85) | 0.016 | 1.42(1.09~1.86) | 0.011 | |
| WBC≥100×109/L | 1.59(1.10~2.30) | 0.013 | 1.65(1.15~2.36) | 0.007 | |
| HGB≥100 g/L | 0.79(0.55~1.14) | 0.209 | 0.80(0.56~1.15) | 0.231 | |
| 2个疗程内CR | 0.13(0.10~0.18) | 0.000 | 0.14(0.11~0.19) | 0.000 | |
| 接受HSCT | 0.52(0.30~0.90) | 0.021 | 0.46(0.26~0.80) | 0.006 | |
| FLT3-ITD突变 | 1.17(0.84~1.66) | 0.352 | 1.24(0.89~1.73) | 0.212 | |
| RUNX1突变 | 0.94(0.59~1.50) | 0.800 | 0.86(0.54~1.38) | 0.540 | |
| IDH1突变 | 1.30(0.81~2.09) | 0.272 | 1.26(0.78~2.01) | 0.345 | |
| IDH2突变 | |||||
| R140突变/野生型 | 0.92(0.57~1.48) | 0.719 | 0.85(0.53~1.38) | 0.517 | |
| R172突变/野生型 | 1.62(0.64~4.07) | 0.306 | 1.56(0.62~3.91) | 0.346 | |
注:CR:完全缓解;HSCT:造血干细胞移植;OS:总生存;PFS:无进展生存
在哺乳动物细胞中,IDH同工酶有三种形式:依赖NADP的胞质IDH1、线粒体的IDH2及依赖NAD的线粒体IDH3[6]。IDH1和IDH2是AML中常见的基因突变,二者突变均可导致对异柠檬酸的亲和力降低,对α酮戊二酸及NADPH的亲和力增强,促使α酮戊二酸转化为2-羟基戊二酸,高水平的2-羟基戊二酸可能存在潜在的致肿瘤作用[7,8,9]。
IDH1/IDH2突变患者年龄偏大、血小板计数高、骨髓原始细胞比例高、正常核型多见、常合并NPM1突变[10,11,12,13,14]。本研究结果显示,IDH2突变患者正常核型多见、高龄、骨髓原始细胞比例高、常合并RUNX1突变及SRSF2突变,但未发现与NPM1突变存在明显相关性。最近的研究显示IDH不同突变亚型与NPM1的相关性存在差异,IDH1、IDH2R140突变更易与NPM1突变共存,IDH2R172突变与NPM1突变互斥[15],且很少伴发其他基因突变[13]。本研究IDH与NPM1突变共存的15例患者中,未发现IDH2R172与NPM1共存,提示IDH2R172突变可能具有不同的生物学意义[16]。
研究发现IDH不同突变亚型对AML患者的预后意义不同,Zhou等[2]和Xu等[3]发现在AML患者中,IDH1突变与较差的预后相关,而IDH2突变可改善预后。另有部分研究者认为IDH1、IDH2突变对AML患者的预后无明显影响[10,11,17]。也有一些证据表明在分子低风险组(NPM1+/FLT3-ITD-)的正常核型患者中,IDH1突变预示着较差的生存期[12,18]。本研究发现在AML患者中,特别是在正常核型或年龄≥50岁的患者中,IDH1突变与不良预后相关,IDH2突变对预后的影响取决于突变的位置,IDH2R140突变对预后无明显影响,IDH2R172突变与不良预后相关,不仅CR率明显减低、中位OS及PFS时间也明显缩短。亦有文献报道IDH2不同突变位点的预后价值存在差异,Green等[13]发现IDH2R140突变是影响复发和OS率的独立有利预后因素,IDH2R172突变与不良预后相关。Xu等[3]的荟萃分析发现IDH2R140突变可改善年轻患者的OS,IDH2R172的预后价值具有明显的异质性。此外,也有一些研究报道了IDH2R172突变患者预后良好[19]。考虑到本研究中IDH2R172突变仅有5例,其预后价值需要进一步扩大样本量加以明确。
IDH突变常与NPM1、FLT3-ITD、DNMT3A等基因突变共存[15,20]。本研究中最常见的伴发基因突变依次为NPM1、NRAS、FLT3-ITD、DNMT3A、RUNX1,分析发现伴发基因突变数目对患者的预后无显著影响,不同伴发基因突变对预后的影响不尽相同。伴NPM1突变者的CR率明显高于阴性者(P=0.014),中位OS及PFS时间均有延长趋势,但差异无统计学意义,这与DiNardo等[20]的研究结果类似,提示NPM1突变可能在一定程度上削弱IDH突变对预后的不良影响。本研究还发现伴DNMT3A突变者的中位OS时间较阴性者缩短,但CR率与PFS差异无统计学意义。有文献报道DNMT3A突变的存在可对IDH突变AML患者的表观遗传学产生影响[21],Papaemmanuil等[19]发现与DNMT3A单突变组及IDH2R140单突变组相比,二者共突变组的预后较差。目前有关IDH与其他基因共突变的发生机制及临床意义尚不清楚,未来需要进一步研究。
综上所述,本研究发现IDH基因突变常伴其他基因突变,不同突变亚型及伴发基因突变对AML患者的预后意义不同。但由于本研究病例数较少,且是单中心、回顾性研究,未来需要更多的大样本、多中心、前瞻性研究进一步明确。



























