
探索真实世界门诊治疗再生障碍性贫血(AA)患者的诊断流程、治疗及疗效。
评估2018年1月至2019年12月门诊治疗176例AA患者的诊断流程、治疗方案及疗效。
患者出现症状至首次就诊中位时间7(5~120)个月,就诊原因包括出血(52.3%)、贫血(51.7%)、感染(6.8%)。诊断流程中168例(95.5%)患者完成髂骨骨髓穿刺(骨穿),仅22例(17.1%)完善了多部位骨穿(胸骨分类);骨髓活检完成率85.1%(143/168);只有59.5%(100/168)和58.9%(99/168)完成了骨髓流式免疫分型及染色体核型分析;86例(48.5%)完成阵发性睡眠性血红蛋白尿(PNH)克隆筛查;造血祖细胞培养检查完成率最低,仅45例(26.8%)。环孢素A(CsA)联合雄激素及左旋咪唑为最常见治疗方案,总计77例(43.8%),其次为CsA联合雄激素45例(25.6%),单用CsA者24例(13.6%),单用雄激素者16例(9.1%),14例(7.9%)患者确诊后选择中药或未治疗。根据门诊复诊频率将176例患者分为复诊规律组(每年≥4次)130例(73.9%)和复诊欠规律组(每年<4次)46例(26.1%)。复诊规律组6个月有效率较高(52.5%对28.0%,P=0.005),12个月高质量缓解率更好(40.7%对16.7%,P=0.027),24个月复发率更低(4.4%对36.4%,P=0.001)。
真实世界治疗的AA患者诊断流程需重视多部位骨穿检查并完成PNH克隆筛查、流式免疫分型、染色体核型分析及造血祖细胞培养检查;门诊规律复诊患者可获得高质量缓解,复发率低,推荐每年至少复诊4次。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
再生障碍性贫血(AA)是东亚、东南亚国家高发血液病,亚洲国家人群的发病率是西方国家的2~3倍。我国AA整体年发病率为0.74/10万,其中非重型AA(NSAA)发病率4倍于重型AA(SAA)[1,2],我国有较大的NSAA患者群体。NSAA起病慢、初始病情轻,因此NSAA患者诊断及治疗多在门诊进行。若NSAA诊断治疗不规范,一半以上患者会疾病进展为输血依赖型NSAA或SAA[3]。因此,门诊初始规范诊断及治疗对于提高NSAA疗效、改善预后有重要意义。真实世界中门诊治疗NSAA患者的现状,目前尚无系统报道。本研究中我们收集176例门诊初诊NSAA患者的临床资料,分析真实世界中门诊诊疗的NSAA患者临床诊断流程、治疗模式及疗效评价,为规范门诊诊治NSAA提供科学指导。
收集2018年1月至2019年12月中国医学科学院血液病医院门诊诊治的176例AA患者临床资料。诊断标准参考AA诊断与治疗中国专家共识(2017年版)[4]。排除标准:①重型或极重型AA;②合并其他系统或脏器功能异常需长期住院治疗的患者;③病历资料不完整的患者。
参考既往文献[5,6,7,8,9],将疗效分为完全缓解(CR)、良好部分缓解(VGPR)、部分缓解(PR)、无缓解(NR)和复发。CR标准:HGB达到同年龄段正常值、中性粒细胞计数(ANC)>1.5×109/L、并且PLT>100×109/L;VGPR标准:HGB>100 g/L、ANC>1.0×109/L且PLT>80×109/L。PR标准:输血依赖者治疗后脱离输血依赖,或≥1系血细胞计数正常或增加1倍以上,或基线HGB小于60 g/L者增幅超过30 g/L,或基线ANC<0.5×109/L者增幅超过0.5×109/L,或基线PLT<20×109/L者增幅超过20×109/L。CR、VGPR和PR为总有效(OR),CR和VGPR为高质量血液学缓解;NR指不符合上述缓解标准;复发:获得缓解且疗效维持时间至少3个月,患者再次出现任何一系细胞下降至基线或最高值的一半且低于正常值低限,或再次出现血制品输注依赖。上述血常规检测要求连续2次间隔>4周,且检测前1周未加用G-CSF。
①单用环孢素A(CsA):CsA 3~5 mg·kg-1·d-1;②单用雄激素:达那唑400~600 mg/d,或司坦唑醇4~10 mg/d或十一酸睾酮120~160 mg/d;③CsA联合雄激素:CsA 3~5 mg·kg-1·d-1联合达那唑400~600 mg/d或司坦唑醇4~10 mg/d或十一酸睾酮120~160 mg/d;④CsA、左旋咪唑联合雄激素:CsA 3~5 mg/kg每日1次与左旋咪唑50 mg每日3次隔日交替,联合达那唑400~600 mg/d或司坦唑醇4~10 mg/d或十一酸睾酮120~160 mg/d;⑤中药:口服中药制剂或中成药物。
门诊挂号就诊视为1次复诊,将176组患者根据复诊频次分为复诊规律组(每年≥4次)和复诊欠规律组(每年<4次)。末次随访时间为2020年5月31日,中位随访33.5(6~60)个月。
应用SPSS 20.0统计软件进行数据处理。计量资料用中位数表示,计数资料采用例数(%)表示。正态分布的计量数据两组间比较采用t检验,不服从正态分布的数据采用Mann-WhitneyU检验进行比较。计数资料采用卡方检验或Fisher精确概率法进行组间比较。P<0.05为差异有统计学意义。
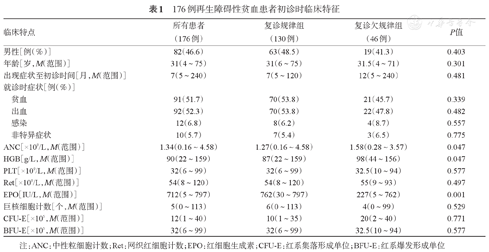
见表1。176例NSAA患者中,男82例,女94例,男女比0.87∶1,初诊中位年龄31(4~75)岁,出现症状至初诊的中位时间7(5~120)个月。复诊规律组130例,男女比0.97∶1,诊断时的中位年龄31(5~75)岁,出现症状至初诊的中位时间7(5~24)个月。复诊欠规律组46例,男女比0.70∶1,诊断时中位年龄31.5(4~71)岁,出现症状至初诊的中位时间12(5~120)个月。
176例再生障碍性贫血患者初诊时临床特征
176例再生障碍性贫血患者初诊时临床特征
| 临床特点 | 所有患者(176例) | 复诊规律组(130例) | 复诊欠规律组(46例) | P值 | |
|---|---|---|---|---|---|
| 男性[例(%)] | 82(46.6) | 63(48.5) | 19(41.3) | 0.403 | |
| 年龄[岁,M(范围)] | 31(4~75) | 31(6~75) | 31.5(4~71) | 0.301 | |
| 出现症状至初诊时间[月,M(范围)] | 7(5~240) | 7(5~120) | 12(5~240) | 0.481 | |
| 就诊时症状[例(%)] | |||||
| 贫血 | 91(51.7) | 70(53.8) | 21(45.7) | 0.339 | |
| 出血 | 92(52.3) | 70(53.8) | 22(47.8) | 0.482 | |
| 感染 | 12(6.8) | 8(6.2) | 4(8.7) | 0.557 | |
| 非特异症状 | 10(5.7) | 7(5.4) | 3(6.5) | 0.775 | |
| ANC[×109/L,M(范围)] | 1.34(0.16~4.58) | 1.27(0.16~4.58) | 1.58(0.28~3.57) | 0.047 | |
| HGB[g/L,M(范围)] | 90(22~159) | 87(22~159) | 98(44~156) | 0.047 | |
| PLT[×109/L,M(范围)] | 32(6~99) | 32(6~99) | 32.5(10~94) | 0.577 | |
| Ret[×109/L,M(范围)] | 54(8~120) | 54(8~120) | 55(9~93) | 0.497 | |
| EPO[IU/L,M(范围)] | 712(5~797) | 762(30~797) | 227(5~762) | 0.001 | |
| 巨核细胞计数[个,M(范围)] | 5(0~113) | 6(0~113) | 4(0~99) | 0.529 | |
| CFU-E[×105,M(范围)] | 12(1~40) | 10(1~35) | 20(2~40) | 0.771 | |
| BFU-E[×105,M(范围)] | 32(6~99) | 32(6~99) | 32.5(10~94) | 0.577 | |
注:ANC:中性粒细胞计数;Ret:网织红细胞计数;EPO:红细胞生成素;CFU-E:红系集落形成单位;BFU-E:红系爆发形成单位
齿龈出血、紫癜、鼻衄等出血症状以及乏力、头晕、耳鸣等贫血症状是患者就诊的主要原因,92例(52.3%)患者就诊时已有程度不一的出血表现,91例(51.7%)患者有明显贫血症状,26例(14.8%)患者就诊前有红细胞或血小板输注史,仅12例(6.8%)患者就诊时合并感染。10例(5.7%)患者因体检或偶然发现血象异常就诊。
所有患者就诊时均有PLT减低,142例(72.4%)合并HGB减低,97例(55.1%)合并ANC减低。
首次就诊患者中168例(95.5%)完成髂骨骨髓穿刺(骨穿),但仅有22例(17.1%)有多部位骨穿(胸骨分类);143例(85.1%)患者完善了骨髓活检,增生极度低下、减低、活跃者分别为69例(48.3%)、47例(32.8%)和37例(25.9%)。行骨穿检查的患者中,150例(89.3%)行CD41免疫组织化学染色评估巨核细胞数量,正常巨核细胞中位数为5(0~99)个;骨髓免疫分型及染色体核型分析完成率较低,仅有100例(59.5%)患者有骨髓免疫分型检查,99例(58.9%)患者有染色体核型分析;骨髓造血祖细胞培养检查完成率最低,只有45例(26.8%)。PNH克隆筛查者有86例(48.5%)。52例(29.5%)患者检测了红细胞生成素(EPO)水平,其中50例(96.2%)出现EPO升高。全部患者门诊真实世界主要诊断流程完成率见图1。
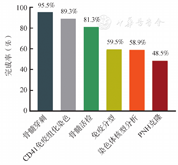

PNH:阵发性睡眠性血红蛋白尿
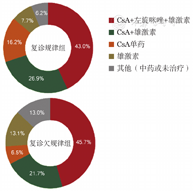
176例NSAA患者中,CsA、左旋咪唑联合雄激素为最常见治疗方案[77例(43.8%)],复诊规律组与欠规律组分别为56例(43.0%)、21例(45.7%)。45例(25.6%)患者接受CsA联合雄激素治疗方案,复诊规律组与欠规律组分别为35例(26.9%)、10例(21.7%);而单用CsA、单用雄激素的患者分别有24例(13.6%)、16例(9.1%),其中复诊规律组内单用CsA及单用雄激素的患者分别为21例(16.2%)、10例(7.7%),复诊欠规律组内单用CsA及单用雄激素的患者分别为3例(6.5%)、6例(13.1%);8例(4.5%)患者选择中药治疗,两组各4例,分别占3.1%、8.7%。6例(3.4%)患者在诊断后1年内未接受治疗,复诊规律组4例,欠规律组2例,分别占3.1%、4.3%(图2)。

见表2。143例患者可评价6个月治疗疗效,97例患者达到OR(67.8%),其中达PR、VGPR、CR者分别为69例(48.2%)、11例(7.7%)、17例(11.9%)。复诊规律组6个月达到OR者86例,复诊欠规律组仅20例,前者6个月OR率更高(72.9%对44.0%,P=0.005)。
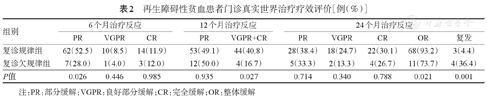
再生障碍性贫血患者门诊真实世界治疗疗效评价[例(%)]
再生障碍性贫血患者门诊真实世界治疗疗效评价[例(%)]
| 组别 | 6个月治疗反应 | 12个月治疗反应 | 24个月治疗反应 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| PR | VGPR | CR | PR | VGPR+CR | PR | VGPR | CR | OR | 复发 | |
| 复诊规律组 | 62(52.5) | 10(8.5) | 14(11.9) | 53(49.1) | 44(40.8) | 28(38.4) | 18(24.7) | 22(30.1) | 68(93.2) | 3(4.4) |
| 复诊欠规律组 | 7(28.0) | 1(4.0) | 3(12.0) | 12(50.0) | 4(16.7) | 5(33.3) | 2(13.3) | 4(26.7) | 11(73.7) | 4(36.4) |
| P值 | 0.026 | 0.446 | 0.985 | 0.935 | 0.027 | 0.714 | 0.340 | 0.788 | 0.021 | 0.001 |
注:PR:部分缓解;VGPR:良好部分缓解;CR:完全缓解;OR:整体缓解
132例患者可评价12个月治疗疗效,113例患者达到OR(85.6%),其中达PR、VGPR、CR的患者分别为65例(49.2%)、17例(12.9%)、31例(23.5%)。复诊规律组12个月VGPR及CR率分别为13.0%(14例)、27.8%(30例);而复诊欠规律组12个月VGPR及CR率分别为12.5%(3例)、4.2%(1例)。相比之下,复诊规律组12月达到高质量缓解率(CR+VGPR)的比例更高(40.8%对16.7%,P=0.027)。
88例患者可评价24个月治疗疗效,79例患者达到OR(89.8%),其中达PR、VGPR、CR者分别为33例(37.5%)、20例(22.7%)和26例(29.5%)。复诊规律组24个月内达OR者68例(93.2%),而复诊欠规律组仅为11例(73.7%)。达到缓解的79例患者中,7例(8.9%)复发,复诊欠规律组复发率明显高于复诊规律组(36.4%对4.4%,P=0.001)。
AA是最经典的骨髓衰竭症,可发生于各年龄组,一般认为该疾病有10~25岁及60岁以上两个发病高峰,男女发病率差异并无统计意义[10,11,12]。本研究人群中,诊断AA时患者的中位年龄为31岁,可能与门诊治疗的患者身体状态更好、合并症更少有关。出现症状至首次就诊的中位时间为7个月,出血及贫血症状是患者就诊的主要原因,而血小板减低程度比贫血、粒细胞减低更严重,与AA患者造血组织增生减低、巨核细胞减少或缺如的骨髓改变一致。约30%的患者初次骨穿时骨髓增生活跃,但随着疾病进展,仍会出现骨髓增生减低、全血细胞减少加重,因此多部位以及多次骨穿在AA诊断中非常重要,但是我们真实世界研究发现不足20%的患者完善了多部位骨穿。
AA分为先天性和获得性两种,前者罕见,包括范可尼贫血、先天性纯红细胞再生障碍、先天性角化不良等,绝大部分AA属于获得性,根据有无继发因素,分为原发获得性与继发性AA[13,14]。因此,对于初诊患者,先天性AA以及继发因素的筛查不可或缺,彗星试验和丝裂霉素试验是重要筛查手段。通过对门诊AA患者诊断资料分析发现,90%以上患者完善了骨穿,80%以上患者行骨髓活检,但骨髓细胞流式免疫分型、细胞遗传学检查完成率均不足60%,PNH克隆筛查的患者不足50%。提示我国目前对于AA的诊断筛查仍不够规范,需在骨穿基础上完善PNH克隆、细胞遗传学以及免疫分型检查,并充分筛查继发因素,做好鉴别诊断。根据诊疗指南推荐[4,5],一些重要的鉴别诊断检查包括风湿免疫抗体、甲状腺功能、乙肝病毒及微小病毒B19、T细胞免疫功能检测(T淋巴细胞亚群、细胞因子、大颗粒淋巴细胞白血病)、骨髓活检、PNH克隆鉴定、细胞遗传学(荧光原位杂交检测7号、8号及20号染色体异常)、血清铁蛋白、叶酸和维生素B12水平等也非常重要。
造血干细胞移植、免疫抑制剂及促造血药物是治疗AA的主要方案[4,5,15]。Zhu等[16]总结发现当前我国针对AA的初始治疗以CsA单药或联合雄激素为主,90%以上的患者病程中接受成分血输注或抗感染等支持治疗,只有约20%的SAA/输血依赖NSAA患者按照指南推荐接受了抗胸腺免疫球蛋白联合CsA治疗。鉴于大多数门诊治疗的患者为NSAA,本研究中CsA联合雄激素及左旋咪唑为最常用方案,仅20%患者选择CsA或雄激素单药。但仍有10%患者未及时接受治疗或仅选择中药治疗,提示对AA患者治疗规范的宣教有待加强,临床医师在门诊确诊AA后需及时明确疾病类型及严重程度,建议患者尽早开始免疫抑制治疗或促造血治疗。
AA是一种慢性血液系统疾病,现有治疗方案可使50%以上的初治患者达到缓解[16,17,18,19,20]。但药物减量或停用过程易复发,药物减量过快会增加复发风险,一般建议逐渐缓慢减量,疗效达平台期后持续服药至少6~12个月[5,15]。在本研究中,我们发现每年复诊次数≥4次的患者6个月有效率更高、12个月高质量缓解率更好,而且24个月复发率低,提示定期复查、遵医嘱调整治疗患者临床获益更大。因此,我们推荐AA患者应当定期规律复诊,建议门诊治疗的患者在用药3个月、6个月、9个月、1年作为随访观察点,待疗效达到平台期后逐渐延长复诊间隔。
通过本研究,我们应当充分认识到真实世界中AA门诊诊断及治疗的不足,规范诊疗过程急需加强,使中国NSAA患者的门诊管理更加标准化,进一步改善患者预后。本研究也存在一些局限性。首先,本研究为单中心、回顾性分析,可能存在选择性偏倚,但我们选择研究期间的连续病例,尽可能减少选择偏倚。其次,本研究样本量偏小,需进一步扩大样本量、延长随访时间,使研究结果更能反映真实世界的诊疗、长期预后以及生存。



























