
探讨多参数流式细胞术(MFC)与实时定量聚合酶链反应技术(RQ-PCR)两种方法检测费城染色体阳性(Ph+)急性B淋巴细胞白血病(B-ALL)患者异基因造血干细胞移植(allo-HSCT)前微小残留病(MRD)的预后意义。
回顾性分析2014年7月至2018年2月在北京大学血液病研究所接受allo-HSCT的280例Ph+ B-ALL患者,同时用MFC和RQ-PCR法(检测BCR-ABL融合基因表达)检测移植前MRD。
RQ-PCR与MFC检测MRD具有相关性(rs=0.435,P<0.001)。MFC、RQ-PCR法检测移植前MRD的阳性率分别为25.7%(72/280)、60.7%(170/280)。移植前MFC-MRD阳性组患者移植后白血病3年累积复发率(CIR)明显高于MFC-MRD阴性组(23.6%对8.6%,P<0.001)。RQ-PCR检测BCR/ABL融合基因阳性组(RQ-PCR MRD阳性组)的3年CIR、非复发死亡(NRM)、无白血病生存(LFS)、总生存(OS)与BCR/ABL融合基因阴性组(RQ-PCR MRD阴性组)相比差异均无统计学意义(P>0.05)。移植前RQ-PCR MRD≥1%组比<1%组具有更高的3年CIR(23.1%对11.4%,P=0.032)、更低的LFS率(53.8%对74.4%,P=0.015)与OS率(57.7%对79.1%,P=0.009)。多因素分析显示,移植前MFC-MRD阳性是影响移植后CIR的危险因素(HR=2.488,95%CI 1.216~5.088,P=0.013),移植前RQ-PCR MRD≥1%是影响LFS(HR=2.272,95%CI 1.225~4.215,P<0.001)、OS(HR=2.472,95%CI 1.289~4.739,P=0.006)的危险因素。MFC检测MRD预测复发的敏感性、特异性、阳性预测值(PPV)、阴性预测值(NPV)分别为48.50%、77.56%、23.62%、87.16%。以RQ-PCR MRD≥1%预测复发的敏感性、特异性、PPV、NPV分别为23.00%、88.59%、17.15%、91.84%。移植前MFC-MRD阳性或RQ-PCR MRD≥1%二者任一成立为指标预测移植后复发的敏感性、特异性、PPV、NPV分别为54.29%、73.88%、45.70%、91.87%。
MFC和RQ-PCR法检测移植前MRD水平均可预测Ph+ B-ALL患者移植预后。移植前MFC-MRD阳性是移植后复发的危险因素。联合使用两种方法(移植前MFC-MRD阳性状态或RQ-PCR MRD≥1%成立)可提高预测移植后复发的敏感性、阳性预测值与阴性预测值,有助于更好筛选出高危患者。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
异基因造血干细胞移植(allo-HSCT)是目前治愈急性白血病有效甚至唯一的手段[1]。然而,微小残留病(MRD)的持续存在是白血病复发、移植失败的主要根源。多项研究显示,移植前通过多参数流式细胞术(MFC)与实时定量聚合酶链反应(RQ-PCR)技术检测MRD已经成为急性白血病移植后复发的独立预后因素[2,3,4]。对于所有B-ALL患者,MFC检测MRD已经成为普遍适用的敏感监测方法,部分伴有特异融合基因的白血病类型,RQ-PCR是MFC检测MRD预测预后的有效补充[5]。对于Ph染色体阳性的急性B淋巴细胞白血病(Ph+ B-ALL)患者,RQ-PCR检测BCR-ABL水平是评估预后的重要因素[6]。本中心一项回顾性研究显示,MFC与RQ-PCR检测移植后MRD对预测Ph+B-ALL患者预后具有良好的相关性与互补性[7]。然而,对于移植前MRD,尚不明确MFC与RQ-PCR检测的MRD预测Ph+ B-ALL患者移植预后有何联系与区别。因此,我们回顾性分析了本单位280例接受allo-HSCT的Ph+ B-ALL患者的病历资料,旨在比较MFC与RQ-PCR两种方法检测移植前MRD水平对移植预后预测的差异。
回顾性分析北京大学血液病研究所2014年7月至2018年2月期间接受allo-HSCT的280例Ph+ B-ALL患者,其中男162例,女118例,中位年龄27(3~63)岁。所有患者在治疗前均签署知情同意书。本研究获得北京大学人民医院伦理委员会批准。
单倍型移植(haplo-HSCT)采用改良Bu-Cy+ATG方案(白消安+环磷酰胺+抗胸腺细胞球蛋白),人类白细胞抗原(HLA)匹配的同胞供者移植(MSDT)应用Bu-Cy方案(白消安+环磷酰胺)[8]。移植物来源均为骨髓联合外周血。
所有患者在移植前均应用TKI(主要为伊马替尼)进行诱导/巩固治疗。移植后伊马替尼的应用指证包括:①无论BCR-ABL转录物水平如何,患者外周血中性粒细胞绝对计数(ANC)>1.0×109/L(在未应用粒细胞集落刺激因子情况下),PLT>50.0×109/L。②连续2次检测骨髓中BCR-ABL转录物水平阳性且转录物水平增加,或者初次植入后BCR-ABL转录物水平≥10-2。其他开始治疗的标准包括患者可以耐受口服伊马替尼而无肠道移植物抗宿主病(GVHD)或威胁生命的感染。所有患者在移植后均应用了TKI治疗。成人(>17岁)患者伊马替尼的初始剂量为400 mg/d,儿童(<17岁)患者初始剂量为260 mg·m-2·d-1。
采集新鲜骨髓标本(RQ-PCR法选用EDTA抗凝,MFC法选择肝素或EDTA抗凝),在移植前30 d内、移植后30、60、90、135、180、270、360 d行MRD检测,随后至少每半年评估1次。
本研究利用一管八色抗体组合(CD10、CD19、CD20、CD34、CD38、CD45、CD58和CD123抗体)检测MRD[3],抗体均为美国Becton Dickinson公司产品。检测异常细胞占总CD45+白细胞数的百分比。质量控制流程参见文献[3]。
RQ-PCR法检测BCR-ABL融合基因水平参照文献[9]。BCR-ABL融合基因>0被定义为RQ-PCR MRD阳性。BCR-ABL和ABL1的引物和探针序列与文献[9]一致。
本研究的主要观察终点为白血病累积复发(CIR),次要观察终点为非复发死亡(NRM)、无白血病生存(LFS)以及总生存(OS)。NRM、复发、LFS和OS的定义见文献[10]。急性GVHD根据受累器官的类型与严重程度进行定义和分级[11]。慢性GVHD根据国际标准[12]进行诊断和分级。
DLI的适应证包括:①用于治疗血液学复发;②对移植后MFC或RT-PCR法检测MRD持续阳性,但处于CR状态的患者进行干预治疗;③移植失败;④对抗病毒治疗和利妥昔单抗无反应的巨细胞病毒或EB病毒感染。
随访资料来自门诊、住院病历及电话随访。随访截止日期为2019年12月31日。
采用SPSS 22.0进行数据处理和分析。患者特征采用两个独立样本的非参数检验或者独立样本t检验。OS、LFS、NRM和CIR率的计算采用Kaplan-Meier法,两组生存曲线比较采用Log-rank检验采用Spearman法进行相关性分析,ROC曲线性评估预测复发的敏感性、特异性、阳性预测值(PPV)及阴性预测值(NPV),P<0.10的参数纳入Cox多因素分析。以P<0.05为差异有统计学意义。
280例Ph+ B-ALL患者总体和两种MRD检测方法阳性、阴性分组的临床特征见表1。RQ-PCR MRD<1%(254例)、RQ-PCR MRD≥1%(26例)两组患者的临床特征见表2。
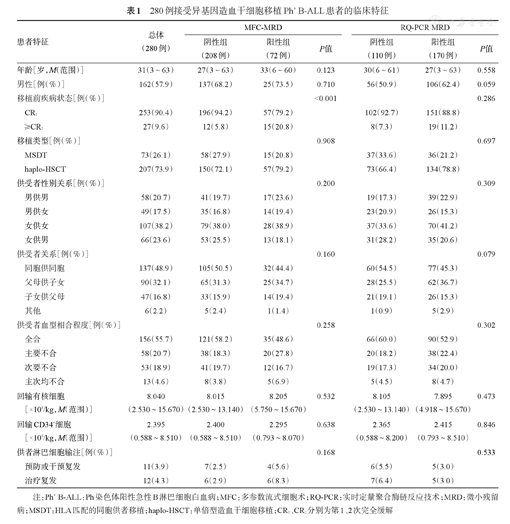
280例接受异基因造血干细胞移植Ph+ B-ALL患者的临床特征
280例接受异基因造血干细胞移植Ph+ B-ALL患者的临床特征
| 患者特征 | 总体(280例) | MFC-MRD | RQ-PCR MRD | |||||
|---|---|---|---|---|---|---|---|---|
| 阴性组(208例) | 阳性组(72例) | P值 | 阴性组(110例) | 阳性组(170例) | P值 | |||
| 年龄[岁,M(范围)] | 31(3~63) | 27(3~63) | 33(6~60) | 0.123 | 30(6~61) | 27(3~63) | 0.558 | |
| 男性[例(%)] | 162(57.9) | 137(68.2) | 25(73.5) | 0.710 | 56(50.9) | 106(62.4) | 0.059 | |
| 移植前疾病状态[例(%)] | <0.001 | 0.286 | ||||||
| CR1 | 253(90.4) | 196(94.2) | 57(79.2) | 102(92.7) | 151(88.8) | |||
| ≥CR2 | 27(9.6) | 12(5.8) | 15(20.8) | 8(7.3) | 19(11.2) | |||
| 移植类型[例(%)] | 0.908 | 0.697 | ||||||
| MSDT | 73(26.1) | 58(27.9) | 15(20.8) | 37(33.6) | 36(21.2) | |||
| haplo-HSCT | 207(73.9) | 150(72.1) | 57(79.2) | 73(66.4) | 134(78.8) | |||
| 供受者性别关系[例(%)] | 0.200 | 0.309 | ||||||
| 男供男 | 58(20.7) | 41(19.7) | 17(23.6) | 19(17.3) | 39(22.9) | |||
| 男供女 | 49(17.5) | 35(16.8) | 14(19.4) | 23(20.9) | 26(15.3) | |||
| 女供女 | 107(38.2) | 79(38.0) | 28(38.9) | 37(33.6) | 70(41.2) | |||
| 女供男 | 66(23.6) | 53(25.5) | 13(18.1) | 31(28.2) | 35(20.6) | |||
| 供受者关系[例(%)] | 0.160 | 0.079 | ||||||
| 同胞供同胞 | 137(48.9) | 105(50.5) | 32(44.4) | 60(54.5) | 77(45.3) | |||
| 父母供子女 | 90(32.1) | 65(31.3) | 25(34.7) | 28(25.5) | 62(36.7) | |||
| 子女供父母 | 47(16.8) | 33(15.9) | 14(19.4) | 21(19.1) | 26(15.3) | |||
| 其他 | 6(2.2) | 5(2.4) | 1(1.4) | 1(0.9) | 5(2.9) | |||
| 供受者血型相合程度[例(%)] | 0.258 | 0.302 | ||||||
| 全合 | 156(55.7) | 121(58.2) | 35(48.6) | 66(60.0) | 90(52.9) | |||
| 主要不合 | 58(20.7) | 38(18.3) | 20(27.8) | 20(18.2) | 38(22.4) | |||
| 次要不合 | 53(18.9) | 41(19.7) | 12(16.7) | 19(17.3) | 34(20.0) | |||
| 主次均不合 | 13(4.6) | 8(3.8) | 5(6.9) | 5(4.5) | 8(4.7) | |||
| 回输有核细胞[×108/kg,M(范围)] | 8.040(2.530~15.670) | 8.015(2.530~13.140) | 8.205(5.750~15.670) | 0.532 | 8.105(2.530~13.140) | 7.895(4.918~15.670) | 0.473 | |
| 回输CD34+细胞[×106/kg,M(范围)] | 2.395(0.588~8.510) | 2.400(0.588~8.510) | 2.295(0.793~8.070) | 0.638 | 2.365(0.588~8.200) | 2.415(0.793~8.510) | 0.846 | |
| 供者淋巴细胞输注[例(%)] | 0.168 | 0.533 | ||||||
| 预防或干预复发 | 11(3.9) | 7(2.5) | 4(5.6) | 6(5.5) | 5(3.0) | |||
| 治疗复发 | 12(4.3) | 6(2.9) | 6(8.3) | 7(6.4) | 5(3.0) | |||
注:Ph+ B-ALL:Ph染色体阳性急性B淋巴细胞白血病;MFC:多参数流式细胞术;RQ-PCR:实时定量聚合酶链反应技术;MRD:微小残留病;MSDT:HLA匹配的同胞供者移植;haplo-HSCT:单倍型造血干细胞移植;CR1、CR2分别为第1、2次完全缓解
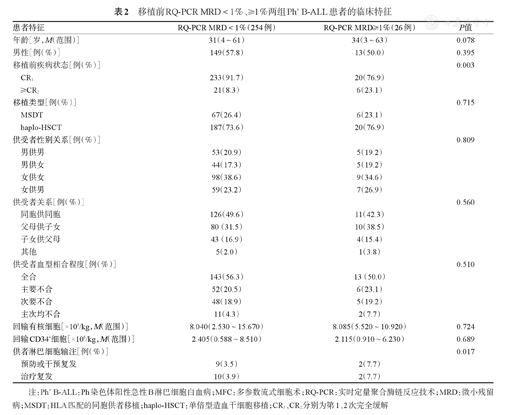
移植前RQ-PCR MRD<1%、≥1%两组Ph+ B-ALL患者的临床特征
移植前RQ-PCR MRD<1%、≥1%两组Ph+ B-ALL患者的临床特征
| 患者特征 | RQ-PCR MRD<1%(254例) | RQ-PCR MRD≥1%(26例) | P值 | |
|---|---|---|---|---|
| 年龄[岁,M(范围)] | 31(4~61) | 34(3~63) | 0.078 | |
| 男性[例(%)] | 149(57.8) | 13(50.0) | 0.395 | |
| 移植前疾病状态[例(%)] | 0.003 | |||
| CR1 | 233(91.7) | 20(76.9) | ||
| ≥CR2 | 21(8.3) | 6(23.1) | ||
| 移植类型[例(%)] | 0.715 | |||
| MSDT | 67(26.4) | 6(23.1) | ||
| haplo-HSCT | 187(73.6) | 20(76.9) | ||
| 供受者性别关系[例(%)] | 0.809 | |||
| 男供男 | 53(20.9) | 5(19.2) | ||
| 男供女 | 44(17.3) | 5(19.2) | ||
| 女供女 | 98(38.6) | 9(34.6) | ||
| 女供男 | 59(23.2) | 7(26.9) | ||
| 供受者关系[例(%)] | 0.560 | |||
| 同胞供同胞 | 126(49.6) | 11(42.3) | ||
| 父母供子女 | 80(31.5) | 10(38.5) | ||
| 子女供父母 | 43(16.9) | 4(15.4) | ||
| 其他 | 5(2.0) | 1(3.8) | ||
| 供受者血型相合程度[例(%)] | 0.510 | |||
| 全合 | 143(56.3) | 13(50.0) | ||
| 主要不合 | 52(20.5) | 6(23.1) | ||
| 次要不合 | 48(18.9) | 5(19.2) | ||
| 主次均不合 | 11(4.3) | 2(7.7) | ||
| 回输有核细胞[×108/kg,M(范围)] | 8.040(2.530~15.670) | 8.085(5.520~10.920) | 0.724 | |
| 回输CD34+细胞[×106/kg,M(范围)] | 2.405(0.588~8.510) | 2.115(0.910~6.230) | 0.689 | |
| 供者淋巴细胞输注[例(%)] | 0.017 | |||
| 预防或干预复发 | 9(3.5) | 2(7.7) | ||
| 治疗复发 | 10(3.9) | 2(7.7) | ||
注:Ph+ B-ALL:Ph染色体阳性急性B淋巴细胞白血病;MFC:多参数流式细胞术;RQ-PCR:实时定量聚合酶链反应技术;MRD:微小残留病;MSDT:HLA匹配的同胞供者移植;haplo-HSCT:单倍型造血干细胞移植;CR1、CR2分别为第1、2次完全缓解
所有患者移植后均获得中性粒细胞植入,中位植入时间为14(9~26)d;280例患者中267例(95.4%)获得血小板植入,中位植入时间为15(6~312)d;Ⅱ~Ⅳ度急性GVHD的发生率为20.0%(95%CI 15.3%~24.7%),慢性GVHD发生率为38.6%(95%CI 32.8%~44.3%)。至随访截止,中位随访时间为901(24~2575)d。移植后3年CIR、NRM、LFS、OS率分别为12.5%(95%CI 8.6%~16.3%)、15.0%(95%CI 10.8%~19.1%)、72.5%(95%CI 67.3%~77.7%)、77.1%(95%CI 72.2%~82.0%)。
在移植前,我们应用RQ-PCR和MFC对280例患者进行移植前30 d内MRD评估。结果提示,RQ-PCR检测BCR-ABL融合基因水平与MFC检测MRD具有相关性(rs=0.435,P<0.001),对于RQ-PCR与MFC检测均为阳性的样本,两者检测的MRD值也具有相关性(rs=0.745,P<0.001)。MFC、RQ-PCR法检测的移植前MRD阳性患者分别为72例(25.7%)、170例(60.7%)。在RQ-PCR法判定为MRD阳性的170例患者样本中,有61例(35.9%)经MFC分析判定为MRD阴性。而RQ-PCR法判定为MRD阴性的110例患者样本中,有99例(90.0%)经MFC分析鉴定为MRD阴性。26例RQ-PCR MRD≥1%的患者中,15例为MFC-MRD阳性。
根据MFC检测的移植前MRD状态(MFC-MRD)将患者分为MFC-MRD阳性组(72例)与MFC-MRD阴性组(208例)。MFC-MRD阳性组移植后3年CIR明显高于阴性组[23.6%(95%CI 13.7%~33.4%)对8.6%(95%CI 4.8%~12.4%),P<0.001]。MFC-MRD阴性组、阳性组的Ⅱ~Ⅳ度急性GVHD发生率分别为20.2%(95%CI 14.7%~25.6%)、19.4%(95%CI 10.2%~28.6%)(P=0.891),慢性GVHD发生率分别为41.3%(95%CI 34.6%~48.1%)、30.6%(95%CI 19.8%~41.2%)(P=0.106),移植后3年NRM率分别为16.8%(95%CI 11.7%~21.9%)、9.7%(95%CI 2.8%~16.6%)(P=0.183),LFS率分别为74.5%(95%CI 68.6%~80.5%)、66.7%(95%CI 55.8%~77.6%)(P=0.145),OS率分别为78.8%(95%CI 73.3%~84.3%)、72.2%(95%CI 61.8%~82.6%)(P=0.268)。将表3中单因素分析(P<0.10)的因素纳入多因素分析,结果显示,影响CIR的危险因素有移植前MFC-MRD阳性(HR=2.488,95%CI 1.216~5.088,P=0.013)与移植前状态>CR1(HR=2.182,95%CI 1.133~4.203,P=0.020)。
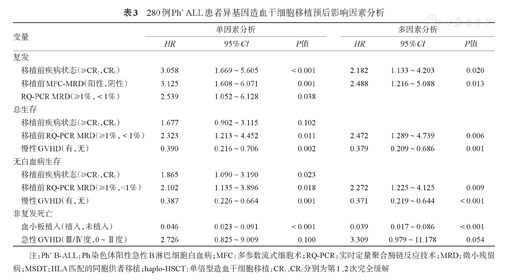
280例Ph+ ALL患者异基因造血干细胞移植预后影响因素分析
280例Ph+ ALL患者异基因造血干细胞移植预后影响因素分析
| 变量 | 单因素分析 | 多因素分析 | |||||
|---|---|---|---|---|---|---|---|
| HR | 95%CI | P值 | HR | 95%CI | P值 | ||
| 复发 | |||||||
| 移植前疾病状态(≥CR2,CR1) | 3.058 | 1.669~5.605 | <0.001 | 2.182 | 1.133~4.203 | 0.020 | |
| 移植前MFC-MRD(阳性,阴性) | 3.125 | 1.608~6.071 | 0.001 | 2.488 | 1.216~5.088 | 0.013 | |
| RQ-PCR MRD(≥1%,<1%) | 2.539 | 1.052~6.128 | 0.038 | ||||
| 总生存 | |||||||
| 移植前疾病状态(≥CR2,CR1) | 1.677 | 0.902~3.115 | 0.102 | ||||
| 移植前RQ-PCR MRD(≥1%,<1%) | 2.323 | 1.213~4.452 | 0.011 | 2.472 | 1.289~4.739 | 0.006 | |
| 慢性GVHD(有,无) | 0.390 | 0.216~0.706 | 0.002 | 0.379 | 0.209~0.686 | 0.001 | |
| 无白血病生存 | |||||||
| 移植前疾病状态(≥CR2,CR1) | 1.865 | 1.090~3.190 | 0.023 | ||||
| 移植前RQ-PCR MRD(≥1%,<1%) | 2.102 | 1.135~3.896 | 0.018 | 2.272 | 1.225~4.125 | 0.009 | |
| 慢性GVHD(有,无) | 0.387 | 0.226~0.664 | 0.001 | 0.371 | 0.219~0.644 | <0.001 | |
| 非复发死亡 | |||||||
| 血小板植入(植入,未植入) | 0.046 | 0.023~0.091 | <0.001 | 0.039 | 0.017~0.086 | <0.001 | |
| 急性GVHD(Ⅲ/Ⅳ度,0~Ⅱ度) | 2.726 | 0.825~9.009 | 0.100 | 3.309 | 0.979~11.178 | 0.054 | |
注:Ph+ B-ALL:Ph染色体阳性急性B淋巴细胞白血病;MFC:多参数流式细胞术;RQ-PCR:实时定量聚合酶链反应技术;MRD:微小残留病;MSDT:HLA匹配的同胞供者移植;haplo-HSCT:单倍型造血干细胞移植;CR1、CR2分别为第1、2次完全缓解
根据RQ-PCR检测移植前BCR-ABL融合基因状态将患者分为RQ-PCR MRD阳性组(170例)与RQ-PCR MRD阴性组(110例)。RQ-PCR MRD阳性组、阴性组的3年CIR[11.7%(95%CI 6.9%~16.6%)对13.6%(95%CI 7.2%~20.1%),P=0.644]、NRM率[15.3%(95%CI 9.8%~20.7%)对14.5%(95%CI 7.9%~21.1%),P=0.864]、LFS率[72.9%(95%CI 66.3%~76.6%)对71.8%(95%CI 63.3%~80.3%),P=0.837]、OS率[76.5%(95%CI 70.1%~82.9%)对78.2%(95%CI 70.5%~86.0%),P=0.740]、Ⅱ~Ⅳ度急性GVHD发生率[20.6%(95%CI 14.5%~26.7%)对19.1%(95%CI 11.7%~26.4%),P=0.760]、慢性GVHD发生率[38.8%(95%CI 31.5%~46.1%)对38.2%(95%CI 29.1%~47.3%),P=0.914]差异均无统计学意义。
按照移植前BCR-ABL融合基因水平将患者分为RQ-PCR MRD<0.01%(132例)、0.01%~<0.1%(62例)、0.1%~<1%(60例)、≥1%(26例)四组。结果显示,RQ-PCR MRD≥1%组患者的3年CIR(23.1%)高于<0.01%组(12.1%,P=0.072)、0.01%~<0.1%组(9.7%,P=0.039),0.1%~<1%组(11.7%,P=0.096),其余三组各组间CIR差异无统计学意义(P>0.05)。
以移植前BCR-ABL融合基因水平(RQ-PCR MRD)1%为界值,将全部患者分为RQ-PCR MRD<1%组(254例)、RQ-PCR MRD≥1%两组(26例)。RQ-PCR MRD≥1%较BCR/ABL<1%组具有更高的CIR[23.1%(95%CI 6.6%~39.6%)对11.4%(95%CI 7.5%~15.3%),P=0.032]、更低的LFS率[53.8%(95%CI 34.3%~73.4%)对74.4%(95%CI 69.0%~79.8%),P=0.015]与OS率[57.7%(95%CI 38.3%~77.1%)对79.1%(95%CI 74.1%~84.1%),P=0.009]。将表3中单因素分析P<0.10的因素纳入多因素分析后提示,移植前RQ-PCR MRD≥1%是影响LFS(HR=2.272,95%CI 1.225~4.215,P<0.001)与OS(HR=2.472,95%CI 1.289~4.739,P=0.006)的危险因素。
MFC法检测MRD预测移植后复发的敏感性(48.50%)略低于RQ-PCR法(57.50%),特异性(77.56%)、PPV(23.62%)均高于RQ-PCR法(42.31%,11.77%),NPV与RQ-PCR相仿(87.16%对88.00%)。当以RQ-PCR MRD≥1%为标准预测移植后复发时,敏感性、特异性、PPV、NPV分别为23.00%、88.59%、17.15%、91.84%。将MFC-MRD阳性、RQ-PCR MRD≥1%两种指标联合应用,预测移植后复发的敏感性、特异性、PPV、NPV分别为54.29%、73.88%、45.70%、91.87%。
移植前MRD与B-ALL患者的移植预后密切相关[2,4,13,14]。在本研究中,我们回顾性分析了280例接受allo-HSCT的Ph+ B-ALL患者,比较了MFC与RQ-PCR两种方法检测移植前MRD水平对移植预后预测的差异。研究发现,在allo-HSCT模式下,MFC和RQ-PCR检测的移植前MRD水平均可预测Ph+ B-ALL患者移植预后,两种方法联合使用可提高预测移植后复发的敏感性,有助于筛选出高危患者进行干预,改善临床疗效。
移植前MFC检测的MRD不易受到移植后再生期骨髓重建与再生期前体B细胞的干扰,减少了MRD检测的假阴性与假阳性[15]。在本研究中,移植前MFC-MRD阳性Ph+ B-ALL患者的CIR明显增高,MFC-MRD阳性状态是移植后复发的危险因素,与文献[2,13,16]的结果相符。我们研究显示,基于移植前RQ-PCR MRD水平分层时RQ-PCR MRD≥1%组较其他分组方式具有更高的复发风险。这与文献[4]报道的BCR-ABL水平分层与预后相关的研究结果相符。同样BCR-ABL转录本水平≥1%也符合本中心在移植前对Ph+ B-ALL患者干预治疗的条件。然而,我们并未发现移植前单纯BCR-ABL MRD状态对移植预后的影响,与文献[14,17]结果存在差异。鉴于本研究haplo-HSCT患者占比较高(73.9%),考虑这种差异可能是由于不同的移植模式和供者选择条件下,移植前MRD对移植的预后影响不同有关。
近期,本中心回顾性分析了202例Ph+ B-ALL患者,比较移植前MRD在不同移植模式下对移植预后的影响。结果显示,相比于HLA相合同胞供者移植(MSDT),haplo-HSCT移植前MRD状态对移植预后无显著影响;对于Ph+ B-ALL患者,尤其是移植前MRD阳性的患者而言,haplo-HSCT组的CIR显著低于MSDT组[18]。此外,Mariotti等[19]报道的一项多中心研究结果显示auto-HSCT后复发的霍奇金淋巴瘤患者再次接受haplo-HSCT具有较低的CIR,本中心一项研究结果显示haplo-HSCT在根除AML患者移植前MRD方面优于MSDT[20],提示haplo-HSCT可能较MSDT具有更强的移植物抗白血病(GVL)效应。
对于Ph+ B-ALL患者而言,RQ-PCR与MFC检测的MRD对复发和生存的预测呈现出不同的预测作用。传统上认为通过RQ-PCR检测MRD的灵敏度较MFC更高,检测阈值可达10-5~10-6。但临床上,由于RQ-PCR检测的灵敏度过高,使得RQ-PCR MRD对移植后复发预测的特异性与PPV均较低,特别是在GVL作用较强的haplo-HSCT模式下。RQ-PCR在预测复发时假阴性与假阳性使得复发高危的患者出现漏诊,也容易让一些无需干预的患者过度治疗,增加化疗药物毒副作用。因此,结合临床治疗方式选择合适的监测方法和界值,才能更好地指导临床。本研究结果显示,移植前MFC MRD阳性与RQ-PCR MRD≥1%均为对移植预后进行精准危险分层的较好指标。近年来,Zhao等[7]、Thörn等[21]学者应用RQ-PCR检测BCR-ABL基因水平与MFC对接受移植的Ph+ B-ALL患者进行MRD检测,均证实PCR与MFC两种方法具有互补性。MFC MRD与RQ-PCR MRD≥1%为条件的MRD检测结果在预测预后上亦可互相补充。当联合应用MFC-MRD阳性或RQ-PCR MRD≥1%为条件来预测复发时,其预测的敏感性、PPV以及NPV较单一方法时得到提升,减少了移植后复发预测的假阴性与假阳性,有助于在Ph+ B-ALL患者中更加精准分辨出复发高危人群,在移植前对高危人群进行个体化干预治疗,采用诸如博纳吐单抗[22]和嵌合抗原受体T细胞输注[23]等策略尽量使移植前MFC-MRD转阴、RQ-PCR MRD水平降低至1%以下,从而改善移植预后。
综上所述,本研究对RQ-PCR与MFC检测Ph+ B-ALL患者移植前MRD的预后预测作用进行了分析对比。MFC和RQ-PCR检测的MRD均可作为Ph+ B-ALL患者MRD监测的有效指标。移植前MFC-MRD阳性是移植后复发的危险因素。联合使用两种方法(移植前MFC-MRD阳性或RQ-PCR MRD≥1%)可提高预测移植后复发的敏感性、PPV与NPV,有助于在Ph+ B-ALL患者中更好地筛选出高危患者以便及时给予适当干预,改善临床疗效。































