
分析复发/难治性急性B淋巴细胞白血病(R/R B-ALL)自体CD19嵌合抗原受体T细胞(CAR-T细胞)制备过程中,培养体系中残留白血病细胞导致CD19 CAR转入白血病细胞的特征和体外杀伤研究。
①收集30例接受CD19 CAR-T细胞治疗的R/R B-ALL患者及6例健康志愿者外周血单个核细胞(PBMC);②流式细胞术分析R/R B-ALL患者PBMC经CD3磁珠分选后及体外培养过程中体系白血病细胞残留情况;③患者及健康志愿者PBMC CD3+ T细胞转染CD19 CAR及CD22 CAR慢病毒,制备CD19 CAR-T、CD22 CAR-T细胞;④复苏Nalm-6细胞株,CD19 CAR慢病毒转染Nalm-6细胞,制备CD19 CAR-Nalm-6细胞,同时转染患者原代ALL细胞;⑤流式细胞术检测转染率;⑥CCK-8法检测细胞增殖;⑦乳酸脱氢酶(LDH)法检测CD19 CAR-T、CD22 CAR-T细胞对Nalm-6细胞及CD19 CAR-Nalm-6细胞杀伤活性。
①30例接受CD19 CAR-T细胞治疗的R/R B-ALL患者中,2例CD3+ T细胞中发现3.32%、2.04%的白血病细胞残留,随体外培养时间延长,在培养第4天,白血病细胞完全消失。②体外培养中CD19 CAR-Nalm-6细胞增殖率高于Nalm-6细胞。③效靶比为1∶1且共培养24、48、72 h,CD19 CAR-T细胞对Nalm-6细胞的杀伤活性高于CD19 CAR-Nalm-6细胞;与CD19 CAR-T细胞相比,CD22 CAR-T细胞对CD19 CAR-Nalm-6细胞的杀伤活性更高。④相同效靶比情况,单独应用CD22 CAR-T细胞对CD19 CAR-Nalm-6细胞的杀伤活性高于CD19 CAR-T联合CD22 CAR-T细胞。
CD19 CAR-T细胞制备过程中培养体系残留白血病细胞可能会导致CD19 CAR被引入白血病细胞中而导致CD19 CAR-T细胞治疗失败,在细胞制备过程中需要检测培养体系中白血病细胞的残留情况。CD22 CAR-T细胞治疗可作为上述情况的挽救治疗措施之一。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
成人急性B淋巴细胞白血病(B-ALL)是最常见的成人急性白血病之一,预后较差[1,2]。采用抗CD19嵌合抗原受体T细胞(CAR-T细胞)治疗复发/难治性(R/R)B-ALL可获得70%~90%的应答率[3,4]。但很多患者仍面临疾病复发,B淋巴细胞表面CD19表达丢失或降低是CD19 CAR-T治疗失败或缓解后复发的重要因素,其机制尚不明确,可能受多种因素影响[5,6,7]。我们前期观察到1例难治性B-ALL患者经自体CD19 CAR-T细胞治疗缓解后14 d复发,其外周血CD19 CAR-T细胞消失的同时CD19 CAR的DNA异常增高,发现其CD19 CAR误转染入白血病细胞,予自体CD22 CAR-T细胞治疗达到完全缓解[8]。本研究我们应用流式细胞术检测R/R B-ALL患者自体CAR-T制备过程中外周血单个核细胞(PBMC)中白血病细胞的残留情况,并体外研究CD19 CAR-T、CD22 CAR-T细胞对CD19 CAR-Nalm-6细胞的杀伤活性,探讨CD22 CAR-T细胞是否可作为CD19 CAR误转染入白血病细胞的一个挽救治疗措施。
Nalm-6细胞株购自美国模式培养物集存库(ATCC),无内毒素质粒提取试剂盒购自北京天根生化科技有限公司;Lenti-Pac慢病毒颗粒包装试剂盒购自上海伯易生物科技有限公司;CD3磁珠分选试剂盒购自德国美天旎生物技术有限公司;CARTEST-19购自上海近岸科技有限公司,CARTEST-22检测试剂盒购自美国Acro公司;LDH细胞毒性检测试剂盒、ELISA检测试剂盒购自上海碧云天生物技术有限公司;CCK-8细胞增殖-毒性检测试剂盒购自日本同仁化学研究所;第二代CD19质粒和CD22质粒购自美国Creative Biolabs公司。
选择30例2018年11月至2020年6月期间于天津市第一中心医院血液科,入组"人源化CD19 CAR-T治疗复发/难治B细胞淋巴瘤/急性B淋巴细胞白血病"临床试验(ChiCTR1800019622)的R/R B-ALL患者,采集患者PBMC进行本研究,患者入组时骨髓白血病细胞比例均高于20%。
淋巴细胞分离液提取30例患者及6例健康志愿者(本中心实验室人员)PBMC,CD3磁珠分选富集CD3+ T细胞。获得的细胞用含有IL-2、谷氨酰胺的T细胞专用培养基培养。每天采用流式细胞术检测30例患者CD3+ T细胞体系中CD19+白血病细胞残留至培养第4天,转染CD19 CAR慢病毒;健康志愿者组培养第4天接种转染CD19 CAR和CD22 CAR慢病毒;Nalm-6细胞培养至对数生长期,转染CD19 CAR慢病毒;上述细胞培养第12天收获。30例患者入组时液氮冻存的骨髓标本经淋巴细胞分离液获得单个核细胞,检测CD19+细胞比例,作为原代CD19+ ALL细胞,转染CD19 CAR。
按CARTEST-19和CARTEST-22检测试剂盒说明书进行操作,流式细胞术检测CD19 CAR-T、CD22 CAR-T、CD19 CAR-Nalm-6及CAR19 CAR-ALL细胞的CD19 CAR转染率;流式细胞术检测培养体系中CD19 CAR-T、CD19 CAR-Nalm-6细胞及CAR19 CAR-ALL细胞免疫表型变化。设3个复孔,实验重复5次,每组、每个时间点样本量等于总体样本量。
CD3+ T细胞及Nalm-6细胞在CD19 CAR转染后,Nalm-6细胞与CD19 CAR-Nalm-6细胞共培养,CD19 CAR-Nalm-6细胞采用PE抗体标记CD19 CAR,呈红光;Nalm-6细胞采用FITC抗体标记,呈现绿光;CD19表达位点被占据则呈现黄色光。采用共聚焦显像技术观察CD19 CAR-T细胞与Nalm-6细胞和CD19 CAR-Nalm-6细胞作用情况。
转染CD19 CAR后,在培养第12天,按CCK-8细胞增殖-毒性检测试剂盒说明书,于培养第4、7、12天采用酶标仪检测450 nm处吸光度(A)值,计算CD19 CAR-T细胞及CD19 CAR-Nalm-6细胞增殖能力。
CD19 CAR-T和CD22 CAR-T细胞培养第12天收获作为效应细胞,CD19 CAR-Nalm-6细胞和Nalm-6细胞为靶细胞,效靶比1∶1。按LDH细胞毒性检测试剂盒说明书,检测490 nm处A值,计算其杀伤率。每组设3复孔,实验重复3次。


实验数据均采用SPSS 17.0软件进行统计学分析,数据表示为平均数±标准差,组间比较采用独立样本的t检验,多组间比较采用单因素方差分析,不同时间点的比较采用重复测量方差分析。P<0.05为差异有统计学意义。
30例患者入组时外周血和骨髓白血病细胞比例及基本特征见表1。2例R/R B-ALL患者(例2、例4)PBMC经CD3磁珠分选后CD3+ T细胞中可检测到白血病细胞。体外培养第1天,2例患者CD3+ T细胞中检测到3.32%和2.04%的CD19+白血病细胞;体外培养第2天,2例患者CD3+ T细胞中检测到1.11%和0.65%的CD19+白血病细胞;体外培养第3天,仅例2 CD3+ T细胞中检测到0.40%的CD19+白血病细胞;培养第4天,2例患者CD3+ T细胞中均未检测到CD19+白血病细胞。
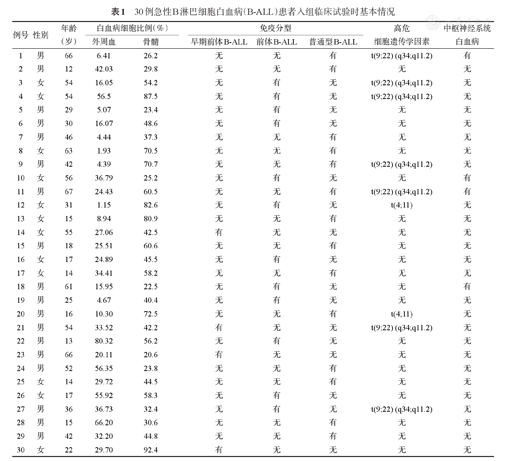
30例急性B淋巴细胞白血病(B-ALL)患者入组临床试验时基本情况
30例急性B淋巴细胞白血病(B-ALL)患者入组临床试验时基本情况
| 例号 | 性别 | 年龄(岁) | 白血病细胞比例(%) | 免疫分型 | 高危细胞遗传学因素 | 中枢神经系统白血病 | |||
|---|---|---|---|---|---|---|---|---|---|
| 外周血 | 骨髓 | 早期前体B-ALL | 前体B-ALL | 普通型B-ALL | |||||
| 1 | 男 | 66 | 6.41 | 26.2 | 无 | 无 | 有 | t(9;22) (q34;q11.2) | 有 |
| 2 | 男 | 12 | 42.03 | 29.8 | 无 | 无 | 有 | 无 | 无 |
| 3 | 女 | 54 | 16.05 | 54.2 | 无 | 有 | 无 | t(9;22) (q34;q11.2) | 无 |
| 4 | 女 | 54 | 56.5 | 87.5 | 无 | 有 | 无 | t(9;22) (q34;q11.2) | 无 |
| 5 | 男 | 29 | 5.07 | 23.4 | 无 | 有 | 无 | 无 | 无 |
| 6 | 男 | 30 | 16.07 | 48.6 | 无 | 有 | 无 | 无 | 无 |
| 7 | 男 | 46 | 4.44 | 37.3 | 无 | 无 | 有 | 无 | 无 |
| 8 | 女 | 63 | 1.93 | 70.5 | 无 | 无 | 有 | 无 | 无 |
| 9 | 男 | 42 | 4.39 | 70.7 | 无 | 无 | 有 | t(9;22) (q34;q11.2) | 无 |
| 10 | 女 | 56 | 36.79 | 25.2 | 无 | 有 | 无 | 无 | 有 |
| 11 | 男 | 67 | 24.43 | 60.5 | 无 | 无 | 有 | t(9;22) (q34;q11.2) | 有 |
| 12 | 女 | 31 | 1.15 | 82.6 | 无 | 有 | 无 | t(4;11) | 无 |
| 13 | 女 | 15 | 8.94 | 80.9 | 无 | 无 | 有 | 无 | 无 |
| 14 | 女 | 55 | 27.06 | 42.5 | 有 | 无 | 无 | 无 | 无 |
| 15 | 男 | 18 | 25.51 | 60.6 | 无 | 无 | 有 | 无 | 无 |
| 16 | 女 | 17 | 24.89 | 45.5 | 无 | 有 | 无 | 无 | 无 |
| 17 | 女 | 14 | 34.41 | 58.2 | 无 | 无 | 有 | 无 | 无 |
| 18 | 男 | 61 | 15.95 | 22.5 | 无 | 有 | 无 | 无 | 有 |
| 19 | 男 | 25 | 4.67 | 40.4 | 无 | 有 | 无 | 无 | 无 |
| 20 | 男 | 16 | 10.30 | 72.5 | 无 | 无 | 有 | t(4;11) | 无 |
| 21 | 男 | 54 | 33.52 | 42.2 | 有 | 无 | 无 | t(9;22) (q34;q11.2) | 无 |
| 22 | 男 | 13 | 80.32 | 56.2 | 无 | 有 | 无 | 无 | 无 |
| 23 | 男 | 66 | 20.11 | 20.6 | 有 | 无 | 无 | 无 | 无 |
| 24 | 男 | 52 | 56.35 | 23.8 | 无 | 无 | 有 | 无 | 无 |
| 25 | 女 | 14 | 29.72 | 44.5 | 无 | 无 | 有 | 无 | 无 |
| 26 | 女 | 17 | 55.92 | 58.3 | 无 | 有 | 无 | 无 | 无 |
| 27 | 男 | 36 | 36.73 | 32.4 | 无 | 有 | 无 | t(9;22) (q34;q11.2) | 无 |
| 28 | 男 | 15 | 66.20 | 30.6 | 无 | 无 | 有 | 无 | 无 |
| 29 | 男 | 42 | 32.20 | 44.8 | 无 | 无 | 有 | 无 | 无 |
| 30 | 女 | 22 | 29.70 | 92.4 | 有 | 无 | 无 | 无 | 无 |
CD19 CAR-T细胞转染率为(72.3±6.0)%,CD22 CAR-T细胞转染率为(57.2±4.2)%,CD19 CAR-Nalm-6细胞转染率为(46.5±3.8)%。
30例B-ALL患者原代白血病细胞经CD19 CAR慢病毒转染后,5例(16.67%)培养体系检测到CD19-CD10+CD22+细胞,其CD19 CAR转染率为(7.50±1.67)%,CD19表达阳性。
共聚焦显像技术提示CD19 CAR-Nalm-6的CD19 CAR占据了Nalm-6细胞(蓝色箭头示)与CD19 CAR-Nalm-6细胞自身的CD19表达位点(白色箭头示),导致流式细胞术无法检出细胞CD19表达(图1)。
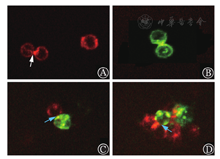

A:示CD19 CAR-Nalm-6细胞自身CD19表达位点被CD19 CAR占据(白色箭头所示);B:示Nalm-6细胞强表达CD19;C~D:示Nalm-6细胞CD19表达位点被CD19 CAR-Nalm-6细胞CD19 CAR占据(蓝色箭头所示)
Nalm-6细胞培养第0、4、7、14天增殖率分别为(6.51±1.70)%、(15.82±2.02)%、(30.8±3.19)%、(202.5±15.13)%,CD19 CAR-Nalm-6细胞培养第0、4、7、14天增殖率分别为(6.55±1.93)%、(15.46±2.69)%、(60.16±5.72)%、(302.51±25.90)%,CD19 CAR-Nalm-6细胞较Nalm-6细胞增殖迅速。
CD19 CAR-T和CD22 CAR-T细胞单独作用的杀伤活性:在24、48和72 h时,CD19 CAR-T细胞对Nalm-6细胞的杀伤活性高于CD22 CAR-T细胞,CD22 CAR-T细胞对CD19 CAR-Nalm-6细胞的杀伤活性高于CD19 CAR-T细胞,CD19 CAR-T细胞对Nalm-6细胞杀伤活性明显高于CD19 CAR-Nalm-6细胞,CD22 CAR-T细胞对Nalm-6及CD19 CAR-Nalm-6细胞的杀伤活性差异无统计学意义(表2)。CD19 CAR-T和CD22 CAR-T细胞联合作用的杀伤活性:培养24、48、72 h时,CD19 CAR-T细胞联合CD22 CAR-T细胞对Nalm-6细胞的杀伤活性不高于CD19 CAR-T细胞单独应用,而高于CD22 CAR-T细胞单独应用(表2)。CD19 CAR-T联合CD22 CAR-T细胞对CD19 CAR-Nalm-6细胞的杀伤活性,低于CD22 CAR-T单独应用,但高于CD19 CAR-T细胞单独应用(表2)。
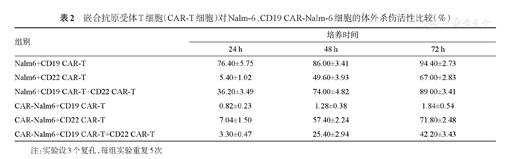
嵌合抗原受体T细胞(CAR-T细胞)对Nalm-6、CD19 CAR-Nalm-6细胞的体外杀伤活性比较(%)
嵌合抗原受体T细胞(CAR-T细胞)对Nalm-6、CD19 CAR-Nalm-6细胞的体外杀伤活性比较(%)
| 组别 | 培养时间 | ||
|---|---|---|---|
| 24 h | 48 h | 72 h | |
| Nalm6+CD19 CAR-T | 76.40±5.75 | 86.00±3.41 | 94.40±2.73 |
| Nalm6+CD22 CAR-T | 5.40±1.02 | 49.60±3.93 | 67.00±2.83 |
| Nalm6+CD19 CAR-T+CD22 CAR-T | 36.20±3.49 | 74.00±4.82 | 89.00±3.41 |
| CAR-Nalm6+CD19 CAR-T | 0.82±0.23 | 1.28±0.38 | 1.84±0.54 |
| CAR-Nalm6+CD22 CAR-T | 7.04±1.50 | 57.40±2.24 | 71.80±2.48 |
| CAR-Nalm6+CD19 CAR-T+CD22 CAR-T | 3.30±0.47 | 25.40±2.94 | 42.20±3.43 |
注:实验设3个复孔,每组实验重复5次
CAR-T治疗是近20年来发展起来极具前景的肿瘤过继免疫细胞治疗方法[9,10,11],对R/R B-ALL表现出令人满意的疗效[5,12,13]。尽管CD19 CAR-T在B-ALL中取得了高响应,但复发问题仍不能忽视,其中大部分与B淋巴细胞表面CD19抗原的明显丢失相关[7,14]。抗原丢失是一种新型的肿瘤逃逸机制,其机理仍在研究中,可能是由多因素造成的。获得性突变的融合和CD19的可变剪接可使白血病细胞能够抵抗CAR-T免疫疗法[7]。在一些患者中,不同机制导致的CD19蛋白阻断引起的可识别CD19抗原缺乏,也可导致CD19阴性复发[6,15,16]。如何预防和治疗由CD19抗原减少或丢失引起的复发,成为亟需解决的问题。
先前研究报告1例B-ALL患者在接受CD19 CAR-T治疗缓解并进行造血干细胞移植后9个月复发[14]。该白血病细胞异常表达CD19 CAR基因,且被证实CD19 CAR基因被引入了单个白血病细胞中,导致最终CD19阴性复发。其复发机制在于CD19 CAR基因的转入,与自体白血病细胞表面的CD19表位结合,使其CD19不表达,从而不能被CD19 CAR-T细胞所识别。我们最近报道1例CD19 CAR-T治疗缓解后2周CD19+复发病例,在外周血CD19 CAR-T比例为0的同时CD19 CAR的DNA水平异常增高。我们发现患者第1次CD19 CAR-T细胞制备过程中磁珠分选后的CD3+ T细胞存在1.41%的白血病细胞残留,因此本例患者存在CD19 CAR被意外转入白血病细胞的可能性[8]。这提示我们在转染CD19 CAR时,CD3+ T细胞中白血病的零残留是极其重要的。我们检测了30例接受CD19 CAR-T细胞治疗的R/R B-ALL患者外周血单个核细胞经过CD3磁珠分选后的培养体系,有2例患者存在3.32%和2.04%的白血病细胞残留,并在随后的培养中比例逐渐减低至消失。
CD19阴性的复发白血病患者预后非常差,迫切需要找到安全有效的治疗方法。CD22同样在B淋巴细胞上表达,成为R/R B-ALL另外1个治疗靶点[17]。针对患有R/R B-ALL的成人和儿童患者的CD22 CAR-T治疗可达到微小残留病阴性CR,而在大多数患者只引发轻度或中度细胞因子释放综合征和神经毒性[18,19,20]。Gardner等[14]报道中,患者尽管接受了CD22 CAR-T治疗,但是仍死于相关并发症。本团队报道的患者复发后接受CD22 CAR-T细胞治疗后再次获得CR,CD22 CAR-T治疗1周后外周血CD19 CAR的DNA拷贝数下降,提示CD22 CAR-T细胞治疗可以作为挽救治疗措施。因此,我们选择Nalm-6细胞株,将CD19 CAR转染入Nalm-6细胞,通过体外研究CD19 CAR-T、CD22 CAR-T细胞对CD19 CAR-Nalm-6细胞的杀伤活性,探索CD22 CAR-T细胞治疗是否可以作为上述情况的一个挽救或联合治疗措施。
CD19 CAR Nalm-6细胞和体系中的Nalm-6细胞在CD19表达阴性的同时,CD22的表达并未受到影响,是CD22 CAR-T细胞治疗有效的理论依据[17,20]。本实验亦证实CD22 CAR-T细胞对CD19 CAR Nalm-6细胞具有较强的杀伤活性。与文献[14]中CD19 CAR-T治疗缓解后CD19阴性复发情况有所不同,本团队报道中患者为CD19阳性复发。我们前期研究发现CD19 CAR-Nalm-6细胞在转染率为(46.50±3.78)%的情况下, CD19的表达几乎检测不到,而在培养体系中加大Nalm-6细胞的比例后,又检测到了CD19表达[21]。我们将成功将CD19 CAR转入原代白血病细胞中,在转染率为(7.50±1.67)%的情况下,体系中CD19+CD22+细胞占比90%以上。患者体内被转入CD19 CAR基因的白血病细胞占比较低可能是患者CD19阳性复发的原因。因此,我们进一步对CD22 CAR-T与CD19 CAR-T细胞的联合作用进行了研究,结果显示,对于CD19阴性的CD19 CAR Nalm-6细胞,CD22 CAR-T对其有较明显的杀伤作用,但是相同效靶比情况下CD22 CAR-T联合CD19 CAR-T的杀伤效果并不优于CD22 CAR-T单独应用的效果。这提示我们对于CD19 CAR转染入白血病细胞的问题,CD22 CAR-T细胞治疗可作为主要的挽救治疗措施,为了降低副作用,临床上或可不联合CD19 CAR-T细胞治疗。
CD19复发包括多种已知甚至未知的情况,本研究中的CD19 CAR-Nalm-6模型只能局限地代表CD19 CAR被引入肿瘤细胞的一种情况。体外实验结果提示CD22 CAR-T对转入CD19 CAR的白血病细胞有极强的杀伤作用,但实际治疗过程中存在的免疫微环境、个体差异等无疑会影响治疗结果,因此,CD22 CAR-T细胞治疗是否能挽救CD19 CAR-T细胞治疗失败的病人需要我们进一步更深入的研究。总之,我们在CAR-T细胞的制备过程中应注意进一步提高磁珠分选CD3+一个方面CD22 CAR-T治疗可作为CD19CAR-T治疗复发的一个挽救治疗措施。细胞的纯度、避免混入白血病细胞;另外一个方面CD22 CAR-T治疗有望成为CD19 CAR-T治疗复发的一个挽救治疗措施。



























