
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
伴第11号染色体长臂异常的Burkitt样淋巴瘤(Burkitt-like lymphoma with 11q aberration, BLL-11q)是2016年WHO淋巴组织病变分类修订版中新提出的一个暂定亚型[1]。此类淋巴瘤具有生发中心表型,尽管具有与Burkitt淋巴瘤(BL)相似的形态学和免疫表型特征,却缺乏MYC基因重排,而代之以特征性的第11号染色体长臂近端拷贝数扩增和端粒区丢失,最小拷贝数增加区域为11q23.2-23.3,最小拷贝数缺失区域为11q端粒端11q24.1。此类淋巴瘤罕见,与BL相比,染色体核型更为复杂,基因突变谱也大相径庭[1,2,3,4,5]。目前BLL-11q应归于BL、弥漫大B细胞淋巴瘤(DLBCL)还是高级别B细胞淋巴瘤(HGBCL)尚无定论。现报道本院2021年1月和3月收治的2例患者,并进行文献复习。
例1,男,22岁,因"发现颈部左侧肿物2个月"入院,否认发热、盗汗、体重减轻等全身症状。无特殊既往史和家族史。体格检查:美国东部肿瘤协作组体能状态(ECOG-PS)评分0分,颈部左侧触及一肿大淋巴结,直径2 cm,质硬,无压痛。血常规、乳酸脱氢酶、β2微球蛋白、肝肾功能、EBV-DNA、HBV五项、HIV抗体、骨髓常规、骨髓活检、免疫球蛋白重排、流式细胞术检查及脑脊液常规、生化、形态学检查等均未见异常。全身PET-CT显示:颈部左侧颌下一直径约2.5 cm肿大淋巴结影,SUVmax 25.1。颈部左侧淋巴结穿刺活检,HE染色低倍镜下见弥漫性淋巴样病变细胞增生浸润,淋巴结结构破坏;高倍镜下病变细胞中等大小,单一形态,星空现象,且伴有较多的核碎片簇状聚集;免疫组化:肿瘤细胞CD20(+)、PAX-5(+),表达生发中心标志CD10、BCL6,同时CD38(+)、p53(60%+)、C-MYC(40%+)、Ki-67(90%+)。MUM1、BCL2、LMO2、原位杂交EBER均为阴性。荧光原位杂交(FISH):采用IGH/BCL2融合探针、BCL6分裂探针、C-MYC分裂探针、p53探针未见异常;采用11q23.3/11q24.3探针:镜下见部分肿瘤细胞内显示两红一绿或三红一绿信号,所占比例约30%,提示11q24.3缺失,故诊断为BLL-11q(图1)。燃石利清靶向测序芯片(广州燃石医学检验所有限公司产品)测得该患者血清中突变基因包括:KMT2D p.G5001E(VAF 36.06%)、EP300 p.S1977G(VAF 8.20%)和TET2 p.I1873T(VAF 11.08%)。采用利妥昔单抗联合Hyper CVAD方案(环磷酰胺、长春地辛、脂质体多柔比星、地塞米松)联合鞘内注射3个疗程后达完全缓解(CR),目前持续治疗中。
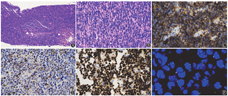

A:弥漫性淋巴样病变细胞增生浸润,淋巴结结构破坏(HE染色,×100);B:病变细胞中等大小,单一形态,星空现象,且伴有较多的核碎片簇状聚集(HE染色,×400);C:肿瘤细胞CD10染色阳性(×400);D:C-MYC染色40%阳性(×400);E:Ki-67染色90%阳性(×400);F:采用11q23.3/11q24.3探针,镜下见部分肿瘤细胞内为两红一绿或三红一绿信号,所占比例约30%
例2,男,14岁,因"双侧鼻塞、涕中带血5个月余"入院,否认发热、盗汗、体重减轻等全身症状。无特殊既往史和家族史。体格检查:ECOG-PS评分0分,鼻黏膜充血,鼻中隔稍偏曲,浅表未及肿大淋巴结。血常规、乳酸脱氢酶、β2微球蛋白、肝肾功能、EBV-DNA、HBV五项、HIV抗体、骨髓常规、骨髓活检、免疫球蛋白重排、流式细胞术检查及脑脊液常规、生化、形态学检查等均未见异常。全身PET-CT显示:鼻咽部5.7 cm×3.1 cm软组织肿物,密度均匀,SUVmax 17.3。鼻咽部肿物切除活检,HE染色病变形态有一定异质性,部分区病变细胞呈中等大小,核碎片散在聚集;部分区病变细胞呈DLBCL形态,星空现象明显;部分区病变细胞完全呈DLBCL形态。免疫组化:肿瘤细胞CD20(+)、PAX-5(+),表达生发中心标志CD10和BCL6,同时C-MYC(>40%+)、CD38(弱+)、Ki-67(>85%+)。MUM1、BCL2、LMO2、原位杂交EBER均为阴性。FISH:采用IGH/BCL2融合探针、BCL6分裂探针、C-MYC分裂探针、p53探针未见异常;采用11q23.3/11q24.3探针:荧光显微镜下见染色体11q23.3呈多个红色信号的比例>50%,染色体11q24.3呈单个绿色信号的比例>50%,提示染色体11q23.3的拷贝数扩增,染色体11q24.3的拷贝数缺失(图2)。燃石利清靶向测序芯片测得该患者肿瘤组织中突变基因包括:PTEN p.Y46S(VAF 28.28%),CCND1 cn_amp(VAF 3.3%),GNA13 p.F325V(VAF 24.36%),GNA13 c.561+2T>G(VAF 33.49%),PIK3CA p.V344G(VAF 26.02%),DDX3X p.F357fs(VAF 50.15%)。采用利妥昔单抗联合Hyper CVAD方案联合鞘内注射3个疗程后达CR,目前持续治疗中。
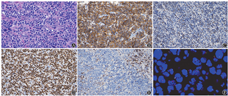

A:肿瘤细胞形态有异质性,部分区病变细胞呈中等大小,核碎片散在聚集;部分区病变细胞呈DLBCL形态,星空现象明显;部分区病变细胞完全呈DLBCL形态(HE染色,×400);B:肿瘤细胞CD10染色阳性(×200);C:C-MYC染色>40%阳性(×200);D:Ki-67染色90%阳性(×200);E:BCL2染色阴性(×200);F:采用11q23.3/11q24.3探针,镜下见11q23.3呈多个红色信号的比例>50%,11q24.3呈单个绿色信号的比例>50%
BLL-11q罕见,既往报道中占BL患者不足10%[2]。Gonzalez-Farre等[4]在95例既往诊断为BL、不典型BL或高级别B细胞淋巴瘤,非特指型(HGBCL-NOS)的患者中筛查,11q异常发生率为8%,均出现于<40岁的青年患者中。Horn等[5]对35例MYC重排阴性的既往诊断为BL、DLBCL-BL或HGBCL-NOS的患者进行11q异常FISH检测,发现11q异常阳性者占52%,其中MYC重排阴性的BL中75%(12/16)存在11q异常,MYC重排阴性的HGBCL中21%(3/14)存在11q异常,而在MYC重排阴性的既往诊断为DLBCL的患者中,仅2%(1/62)存在11q异常。但值得一提的是,仍有极少数MYC重排阳性的侵袭性淋巴瘤伴随11q异常[5,6]。
BLL-11q男性多见,好发于儿童及青少年,中位发病年龄在15~20岁[1,2,3,4],但也有高至82岁的BLL-11q的病例报道[7]。BLL-11q病因不明,与EBV感染无关,有报道BLL-11q在器官移植后免疫缺陷的患者中常见,占移植后BL的43%(3/7),且均为EBV阴性(3/5)[8]。BLL-11q以单个淋巴结起病为主,最常见累及的部位包括头颈部淋巴结、腹腔淋巴结、腹股沟淋巴结等,少数病例也有结外器官(肠道、阑尾、骨)累及[2,3,4]。绝大部分BLL-11q病灶局限,Gonzalez-Farre等[4]报道的11例患者中,仅3例分期为Ⅲ~Ⅳ期。
病理形态上,BLL-11q与BL相似,肿瘤细胞弥漫性生长,中等大小,单一形态,核圆、核仁小,胞质嗜碱,吞噬细胞"星空现象"多见[1,2,3,4]。但与BL相比,BLL-11q核碎片现象更为明显,在一个包含33例患者的双盲研究中,"核碎片"现象预测潜在的11q异常的特异性达到91%[5]。
BLL-11q呈现与BL相似的生发中心免疫表型,表达CD10、BCL6,不表达BCL2、MUM1,Ki-67指数大于90%。但BLL-11q EBV均为阴性,C-MYC蛋白水平显著低于BL,仅呈局灶弱阳性。40%~70%的BLL-11q表达生发中心标志LMO2,而LMO2表达罕见于BL。此外,少数BLL-11q患者表达CD56,Rymkiewicz等[9]利用流式细胞术发现CD16/CD56阳性仅存在于BLL-11q中(BLL-11q 60%,BL 0%),并提出CD16/CD56阳性不伴CD38高表达是鉴别CD10+侵袭性淋巴瘤中BLL-11q的有效手段。
细胞遗传学特征方面,BLL-11q拷贝数变异(CNA)多,中位CNA数6.5~7.1,与BL相似,但复杂核型更常见。BLL-11q缺乏MYC重排,也没有BCL2和BCL6重排,典型的细胞遗传学改变为11q23拷贝数增加合并11q端粒端11q24.1缺失。但并非所有BLL-11q均具有这两种异常。Wagener等[3]和Gonzalez-Farre等[4]报道的26例BLL-11q中,20例呈现典型的11q23拷贝数增加合并11q端粒端11q24.1缺失;4例仅有11q端粒端11q24.1缺失,无11q23拷贝数增加;1例为复杂11q改变;1例呈现11q23.3-q25拷贝数中性的杂合性缺失。其他常见的细胞遗传学异常包括12号染色体三体(最小拷贝数增加区域12q13.11-q24.32)、6q12.1-q21缺失、7q端粒端7q.34拷贝数增加、13q32.3-q34缺失、5q21.3-q32拷贝数增加等。
BLL-11q与BL的基因突变谱显著不同。对15例BLL-11q患者标本进行全外显子测序显示,此类淋巴瘤最常见的突变基因包括GNA13(47%)、TTN(47%)、FAT4(40%)、PKD1L2(33%)、NFRKB(27%)、DDX3X(27%)、TENM3(27%)等[3];另一项针对11例BLL-11q患者标本的靶向测序结果则提示BTG2(40%)、ETS1(30%)、EP300(30%)、DDX3X(30%)、GNA13(30%)为常见突变基因。除了GNA13和DDX3X之外,BLL-11q突变谱缺乏BL中常见的突变基因如MYC、ID3、TCF3、TP53、SMARCA4、CCND3等,却与GCB来源的其他淋巴瘤存在部分重叠,例如常出现BTG2、DDX3X、ETS1、EP300、GNA13及表观遗传学调控基因EP300、KMT2D、EZH2等异常[4]。
尽管BLL-11q基因异常众多,但其发病机制仍不清楚。研究者进一步探索了是否存在位于11q最小扩增区域或最小缺失区域的驱动基因。2014年Salaverria等[2]对16例BLL-11q患者进行突变检测,发现4例BLL-11q患者存在位于最小缺失区域11q24.1-ter的ETS1基因的点突变。ETS1是转录因子,参与众多基因转录调控,影响干细胞发育、细胞衰老和死亡以及肿瘤的发生。2019年Wagener等[3]对15例BLL-11q进行全外显子测序,也发现2例患者具有ETS1突变,此外他们还发现4例患者存在同样位于最小缺失区域11q24.1-ter的NFRKB基因突变。此4例中3例为无义突变,导致NFRKB基因转录提前终止。比较既往基因表达谱数据也证实,BLL-11q患者NFRKB基因表达水平显著低于BL患者。NFRKB是INO80染色质重塑复合物,在转录调控中发挥作用。分析INO80染色质重塑复合物中的所有基因发现,15例BLL-11q患者中有5例存在相关基因突变。ChIP-seq数据库提示NFRKB可结合位于最小拷贝数增加区域11q23.2-23.3的5个过表达基因(BLL-11q对BL)IL10RA、ZNF259、PAFAH1B2、CEP164、SIDT2的转录起始位点,但不能与位于最小缺失区域11q24.1-ter的任何基因结合,提示NFRKB基因缺失可能通过改变核小体构象、提高基因转录水平等导致BLL-11q出现最小扩增区域,而位于INO80染色质重塑复合物的基因突变也可能是导致BLL-11q发病的驱动基因。
BLL-11q罕见,缺乏规范的治疗方案,目前大多数中心仍倾向于采取BL样治疗。Sevilla等[10]报道对MYC重排阴性的HGBCL采用R-CHOP样治疗预后显著差于采用更高化疗强度(如BL样方案)的MYC重排阳性的HGBCL患者。Salaverria等[2]则发现,同样采用BL样治疗,BLL-11q预后优于BL。后续报道采用BL样方案,几乎所有患者均可获得CR,5年总生存率也可达到80%以上[4,9,11]。
本报道中2例患者均为青少年,病灶局限,肿瘤细胞具有典型的病理形态、生发中心样免疫表型和特征性的11q染色体异常,靶向测序存在GNA13、DDX3X、KMT2D、EP300等BLL-11q常见基因突变,经利妥昔单抗联合HyperCVAD方案治疗后中期评估均获得CR,符合BLL-11q特征。此类淋巴瘤目前虽被称为Burkitt样淋巴瘤,但越来越多的证据表明它与BL及其他类型的侵袭性B细胞淋巴瘤均存在遗传学上的本质差异,是一种独立类型的淋巴瘤。临床上,对于形态学具有BL或BL/DLBCL特征且呈生发中心样免疫表型、Ki-67指数高的患者,如无MYC重排,需加做11q23.3/11q24.3 FISH探针检查,排查BLL-11q的可能性,提高诊断准确率。


























