
制备一种靶向LMP1抗原的嵌合抗原受体T细胞(CAR-T细胞),研究其对EB病毒(EBV)阳性淋巴瘤的免疫治疗作用。
应用分子克隆技术构建二代LMP1 CAR表达质粒,通过慢病毒包装体系包装病毒后感染人T细胞,获得LMP1 CAR-T细胞,体外实验验证LMP1 CAR-T细胞对感染EBV后的LMP1阳性淋巴瘤细胞的特异性细胞毒性作用。
①LMP1蛋白表达于EBV阳性的淋巴瘤细胞表面;②成功构建了二代LMP1 CAR慢病毒载体,感染人T细胞,获取LMP1 CAR-T细胞,感染效率大于80%;③LMP1 CAR-T细胞可特异性杀伤LMP1阳性淋巴瘤细胞,当效靶比按4∶1共培养48 h后,LMP1 CAR-T细胞对Raji细胞的杀伤作用增强,对Ramos细胞无明显杀伤作用;④与LMP1阳性淋巴瘤细胞按1∶1共培养5 h后,LMP1 CAR-T细胞处理组CD107a+ T细胞比例显著高于Vector-T细胞组[(13.25±2.94)%对(1.55±0.05)%,t=3.972,P=0.017],脱颗粒效果增强;⑤与LMP1阳性淋巴瘤细胞共培养后,LMP1 CAR-T细胞组CD69+、CD25+ T细胞比例显高于Vector-T细胞组[(7.40±0.41)%对(3.48±0.47)%,t=6.268,P=0.003;(73.00±4.73)%对(57.67±2.60)%,t=2.842,P=0.047],活化效应增强。⑥与LMP1阳性淋巴瘤细胞共培养后,LMP1 CAR-T细胞组细胞因子分泌增强,高于Vector-T细胞组[IFN-γ:(703±73)ng/L对(422±87)ng/L,t=2.478,P=0.068;TNF-α:(215±35)ng/L对(125±2)ng/L,t=2.536,P=0.064]。
该研究证实EBV阳性淋巴瘤细胞表面可特异表达LMP1蛋白,成功构建了LMP1 CAR慢病毒载体并感染人T细胞,成功获得LMP1 CAR-T细胞。体外实验证实:与LMP1阳性淋巴瘤细胞共培养后,LMP1 CAR-T细胞脱颗粒效果增强,活化效应增强,高效分泌细胞因子,可特异杀伤LMP1阳性淋巴瘤细胞,具有潜在的临床应用前景。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
EB病毒(EBV)是一种双链DNA病毒,属于人类疱疹病毒,人群感染率高达90%[1],是WHO发布的Ⅰ级致癌物[2]。该病毒感染人体后,可引发EBV相关的恶性疾病[3]。LMP1蛋白是一种六次跨膜的Ⅱ型跨膜蛋白,有386个氨基酸分子[4],是一种EBV慢性潜伏感染时特异性表达的膜抗原,在移植后淋巴细胞增殖性疾病、霍奇金淋巴瘤、非霍奇金淋巴瘤、T/NK T细胞淋巴瘤、Burkitt淋巴瘤、胃腺癌及鼻咽癌中均可表达[5,6]。
迄今为止,针对EBV感染相关的疾病治疗方法众多,包括抗病毒药物,免疫佐剂,回输EBV特异性细胞毒性T细胞等[7]。但这些治疗手段疗效十分有限,仍需探索新的治疗方法。嵌合抗原受体T细胞(CAR-T细胞)免疫疗法是近年来一项新兴的免疫疗法[8]。该治疗方法通过基因重组的方式,将识别肿瘤相关抗原的单链抗体、铰链与跨膜区、胞内信号域与共刺激分子进行重组,通过慢病毒转染体系包装,感染患者自身的T细胞,获得表达抗肿瘤抗原的单链抗体的T细胞,经过大规模扩增后再回输至患者体内,可以实现靶向消除肿瘤的目的[9]。
本研究中,针对EBV阳性淋巴瘤靶向特异表达的LMP1抗原,我们制备了LMP1 CAR-T细胞进行研究,通过体外试验,初步验证了LMP1 CAR-T细胞抗EBV阳性淋巴瘤的作用。
Burkitt淋巴瘤细胞系Raji细胞为本实验室保存,人B淋巴细胞瘤细胞系Ramos细胞购买于国家生物医学实验细胞资源库,均培养于含10%胎牛血清的RPMI 1640培养基中。健康成人外周血标本取自天津市血液中心,人T细胞通过RossetteSep T细胞富集试剂、Ficoll淋巴细胞分离液富集纯化后,培养于含5%胎牛血清和50 IU IL-2的KBM581培养基中。以上细胞都培养在37 ℃、5%CO2环境中。
蛋白电泳凝胶试剂盒购于中国达科为生物工程有限公司;4%多聚甲醛购于中国碧云天公司;人IFN-γ、TNF-α ELISA试剂盒购于德国Novus公司;APC抗人Fab抗体、PE抗人CD107a抗体、APC抗人CD3抗体、PE抗人CD19抗体、PE抗人CD69抗体、PE抗人CD25抗体购于美国Biolegend公司;PE鼠抗人IgG Fc抗体购于美国Jackson Immuno公司;抗人LMP1[H3]IgG1购于英国Absolute Antibody公司;RossetteSep T细胞富集试剂购于美国Stem Cell公司;人T细胞激活因子CD3/CD28磁珠购于美国Gibco公司;细胞因子IL-2购自美国R&D公司;DMEM、RPMI 1640培养基购于美国Gibco公司;KBM581培养基购于美国Corning公司。
使用蛋白电泳凝胶试剂盒配胶,取Raji和Ramos细胞各1×106于1.5 ml EP管中,裂解煮沸后上样,经电泳、湿转、封闭后,再孵育一抗、二抗,最后化学显影。
使用4%多聚甲醛常温固定10 min,再用抗人LMP1 IgG1抗体室温孵育40 min,之后使用PE标记的抗人IgG Fc 4 ℃孵育30 min,用流式细胞仪检测LMP1表达。
通过中国专利库,查询得到靶向LMP1抗原的人源scFv核苷酸序列(专利号:CN 109400712 A),按照先可变区轻链后重链顺序排列,进一步优化CAR结构中anti-LMP1 scFv结构,通过分子克隆技术构建二代LMP1 CAR载体。
LMP1 CAR质粒、Vector(pCDH-GFP)质粒与慢病毒包装质粒PMD2.0G、JA3、JA4共同转染HEK-293T细胞,待48 h后收集病毒上清,将病毒超速离心浓缩后,分装冻存-80 ℃冰箱备用。
浓缩后的病毒感染经CD3/CD28磁珠刺激活化的T细胞,4 d后使用抗人IgG F(ab')2抗体标记T细胞表面scFv,应用流式细胞仪检测CAR的表达效率。
LMP1 CAR-T、Vector-T细胞按照效靶比4∶1和8∶1分别与LMP1阳性的Raji细胞或LMP1阴性的Ramos细胞37 ℃、5% CO2共培养24、48 h,由于Raji与Ramos细胞稳定表达CD19抗原,且CD19抗原阳性率都高于99%,使用流式细胞术检测靶细胞中CD19阳性残余细胞比例作为肿瘤细胞残余比例。
LMP1 CAR-T、Vector-T细胞按照效靶比1∶1分别与LMP1阳性的Raji细胞或LMP1阴性的Ramos细胞37 ℃、5% CO2共培养5 h,流式细胞术检测T细胞中CD107a+ T细胞比例,通过CD107a+/CD3+比例反映T细胞激活率。
LMP1 CAR-T、Vector-T细胞按照效靶比1∶1分别与LMP1阳性的Raji细胞或LMP1阴性的Ramos细胞37 ℃、5% CO2共培养8、48 h,流式细胞术检测T细胞中CD69阳性或CD25阳性细胞比例,反映T细胞活化率。
LMP1 CAR-T、Vector-T细胞按照效靶比4∶1分别与LMP1阳性的Raji细胞或LMP1阴性的Ramos细胞共培养,培养条件为37 ℃,5% CO2,共培养48 h后,收集上清,使用ELISA试剂盒检测上清内IFN-γ、TNF-α表达情况。
采用GraphPad Prism 8软件进行统计学分析。结果以均数±标准差表示,组间比较采用独立样本t检验分析。
LMP1抗原结构见图1A,Western blot及流式细胞术结果证实EBV阳性Raji细胞表达LMP1蛋白,而EBV阴性Ramos细胞不表达LMP1蛋白(图1B、1C)。
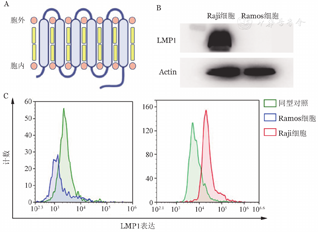

A:LMP1蛋白结构示意图;B:Western blot检测LMP1蛋白表达;C:流式细胞术检测LMP1蛋白表达
LMP1 CAR载体示意图见图2A。分选的健康人外周血CD3+ T细胞用抗人CD3/CD28磁珠刺激培养,24 h后感染慢病毒体系包装的二代LMP1 CAR表达载体,从而获得LMP1 CAR-T细胞,通过使用IgG Fab抗体标记LMP1 CAR-T细胞表面表达的抗LMP1抗原的scFv,测得LMP1 CAR表达载体的感染效率可达到80%。培养12 d后LMP1 CAR-T细胞可扩增至100倍(图2B)。
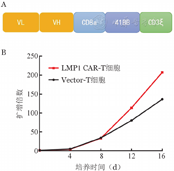

A:LMP1 CAR结构示意图;B:LMP1 CAR-T细胞体外扩增曲线
LMP1 CAR-T、Vector-T细胞分别与Raji细胞或Ramos细胞以效靶比4∶1和8∶1共培养24、48 h,流式细胞术检测共培养体系中残余靶细胞比例,以此反映LMP1 CAR-T细胞的杀伤能力。结果显示,与Raji细胞共培养24 h,Vector-T细胞对Raji细胞无明显杀伤作用,而LMP1 CAR-T细胞具有明显的杀伤作用。与Raji细胞共培养48 h,与Vector-T细胞相比,LMP1 CAR-T细胞杀伤作用更加显著。而与Ramos细胞共培养时,LMP1 CAR-T细胞与Vector-T细胞不能有效杀伤肿瘤细胞(图3)。结果表明,LMP1 CAR-T细胞对Raji细胞具有特异性杀伤作用,而对Ramos细胞无杀伤作用。
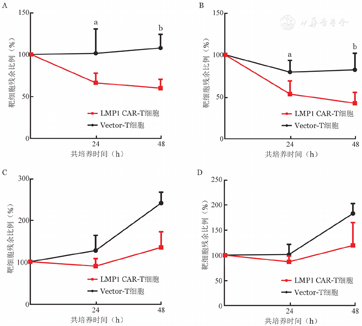

A:效靶比4∶1与Raji细胞共培养;B:效靶比8∶1与Raji细胞共培养;C:效靶比4∶1与Ramos细胞共培养;D:效靶比8∶1与Ramos细胞共培养
将LMP1 CAR-T细胞与Raji或Ramos细胞按效靶比1∶1共培养5 h,流式细胞术检测CD107a+ T细胞在T细胞中的比例。结果显示,在Raji细胞中,LMP1 CAR-T细胞处理组CD107a+ T细胞比例显著高于Vector-T细胞组[(13.25±2.94)%对(1.55±0.05)%,t=3.972,P=0.017];而在Ramos细胞中,LMP1 CAR-T细胞组CD107a+ T细胞比例高于Vector-T细胞组[(9.44±1.92)%对(0.97±0.18)%,t=4.401,P=0.046],但仍低于LMP1 CAR-T细胞与Raji细胞共培养组。提示与特异性抗原的靶细胞共培养5 h后,LMP1 CAR-T细胞显著提高T细胞激活率,脱颗粒效果增强,有利于更好地发挥抗肿瘤的效果。
将LMP1 CAR-T细胞、Vector-T细胞分别与LMP1阳性Raji细胞、LMP1阴性Ramos细胞按效靶比1∶1共培养8 h,检测早期活化标志CD69+ T细胞比例;共培养48 h,检测晚期活化标志CD25+ T细胞比例。结果显示,LMP1 CAR-T细胞与Raji细胞共培养后,CD69+、CD25+ T细胞比例显著高于Vector-T细胞组[(7.40±0.41)%对(3.48±0.47)%,t=6.268,P=0.003;(73.00±4.73)%对(57.67±2.60)%,t=2.842,P=0.047]。与Ramos细胞共培养后,LMP1 CAR-T细胞组与Vector-T细胞组CD69+、CD25+ T细胞比例差异无统计学意义[(1.99±0.43)%对(1.89±0.48)%,t=0.155,P=0.884;(58.00±3.51)%对(50.00±1.00)%,t=2.191,P=0.094]。提示,与特异性抗原的靶细胞共培养后,活化的LMP1 CAR-T细胞比例增高。
将LMP1 CAR-T细胞、Vector-T细胞分别与LMP1阳性Raji细胞、LMP1阴性Ramos细胞按效靶比4∶1共培养48 h后,ELISA法检测细胞因子IFN-γ、TNF-α的表达情况。结果显示,在Raji细胞共培养体系中,LMP1 CAR-T细胞组IFN-γ、TNF-α表达水平均高于Vector-T细胞组[(703±73)ng/L对(422±87)ng/L,t=2.478,P=0.068;(215±35)ng/L对(125±2)ng/L,t=2.536,P=0.064],在0.07的水平上有统计学意义;而在Ramos细胞共培养体系中,LMP1 CAR-T细胞组与Vector-T细胞组IFN-γ、TNF-α表达水平差异无统计学意义[(220±57)ng/L对(169±28)ng/L,t=0.799,P=0.469;(82±32)ng/L对(55±12)ng/L,t=0.769,P=0.485]。反映出与LMP1阳性淋巴瘤细胞共培养时,LMP1 CAR-T细胞抗肿瘤活性增强。
自EBV首次通过电镜从非洲Burkitt淋巴瘤细胞中发现至今已经60余年[10],临床治疗上EBV阳性的淋巴瘤还是以化疗与放疗联合治疗为主,联合治疗霍奇金淋巴瘤的5年生存率为80%~90%,但该方式易导致严重长期毒性,包括继发性恶性肿瘤、心肺毒性、甲状腺功能减低、不孕症等不良反应,且对于治疗后复发的患者预后不佳[11]。近年来,免疫检查点抑制剂在临床上逐见成效,如PD-1可有效改善患者免疫抑制的情况[12],体外扩增患者来源的EBV特异性T细胞再回输的治疗方式也同样有效,特别是针对淋巴细胞增殖性疾病[13]。然而,这些治疗方法仍然无法满足全面、有效治疗的需求。
CAR-T细胞免疫治疗是一种可以实现靶向抗肿瘤的治疗方式[14]。EBV感染人体后,感染的B细胞和扁桃体上皮细胞在慢性潜伏期均可表达EBV相关遗传物质[15],此前已有针对鼻咽癌的LMP1 CAR-T研究[16],此外,还有针对鼻咽癌的LMP2a CAR-T[17]、针对EBV感染的gp-350 CAR-T[18]等研究(表1)。这些CAR-T细胞都取得不错的抗肿瘤效果,但与靶向病毒颗粒蛋白gp350相比,靶向潜伏膜蛋白的CAR-T细胞治疗安全性更好。

靶向EB病毒(EBV)阳性疾病的嵌合抗原受体T细胞(CAR-T细胞)治疗策略
基于以上研究背景,本研究的创新之处在于将EBV感染后特异性表达的LMP1抗原作为靶点,结合CAR-T靶向治疗的治疗方式,验证靶向EBV阳性的淋巴瘤的治疗作用。
综上,我们成功构建了LMP1 CAR表达载体,LMP1 CAR的表达效率达到80%以上,制备出LMP1 CAR-T细胞,并通过将LMP1 CAR-T细胞与LMP1阳性淋巴瘤细胞共培养的方式,证实了LMP1 CAR-T细胞可被特异性激活、高效分泌细胞因子,对LMP1阳性淋巴瘤具有明显抗肿瘤能力,且对LMP1抗原阴性淋巴瘤无明显特异杀伤能力,表现出一定的安全性,为未来临床治疗EBV阳性淋巴瘤提供新的治疗思路。
所有作者声明无利益冲突



























