
比较不同扩增体系NK细胞生物学特性的差异以及治疗异基因造血干细胞移植后(allo-HSCT)白血病复发的疗效。
分别采用CD3/CD52单抗扩增法和饲养层细胞扩增法诱导供者来源NK细胞大量扩增,检测扩增前后NK细胞表型、因子分泌、细胞毒的变化规律;选取16例allo-HSCT后复发白血病患者,8例输注CD3/CD52单抗扩增NK细胞,8例输注饲养层细胞扩增NK细胞,观察患者的治疗反应和长期生存情况。
①与CD3/CD52单抗扩增体系相比,饲养层细胞扩增体系NK细胞纯度较高、NK细胞表面活化性受体DNAM-1及NKp30表达较高、抑制性受体CTLA-4表达较低,而两种NK细胞NKG2D/CD25/CD69/Trail/PD-1/TIM-3/TIGIT表达差异无统计学意义。②两种扩增体系NK细胞Ki-67指数均明显增加,以饲养层细胞扩增NK细胞尤为明显;饲养层细胞扩增NK细胞穿孔素及颗粒酶B表达水平均明显高于CD3/CD52单抗扩增NK细胞。③16例allo-HSCT后复发白血病患者NK细胞输注过程中均未观察到明显不良反应。NK细胞输注后中位随访时间为2554(917~2583)d,CD3/CD52单抗扩增组中3例患者无白血病存活,5例死亡;饲养层细胞扩增组中6例患者长期存活,2例死亡。5例患者在NK细胞输注前存在移植物抗宿主病,NK细胞输注后移植物抗宿主病未加重甚至缓解。
CD3/CD52单抗扩增与饲养层细胞扩增体系NK细胞的生物学特性具有明显差异;NK细胞输注对allo-HSCT后复发白血病患者的疗效仍需要进一步验证。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
异基因造血干细胞移植(allo-HSCT)是白血病的有效治疗手段,移植后复发是影响移植疗效的主要原因。目前,移植后白血病复发的常规治疗方法包括化疗及供者淋巴细胞输注(DLI),但DLI可使移植物抗宿主病(GVHD)的发生风险增加[1]。因此,探讨新的复发后治疗方法是提高白血病患者移植疗效的关键。
自然杀伤(NK)细胞是构成机体重要的天然免疫屏障之一,无需致敏即可杀伤肿瘤细胞或感染的细胞,通过分泌穿孔素、颗粒酶等介导靶细胞杀伤[2,3],另一方面可通过分泌IFN-γ、TNF-α等活化适应性免疫系统而发挥协同免疫防御作用[4]。除此之外,抗体依赖的细胞介导细胞毒性作用(ADCC)也是NK细胞效应功能发挥的重要途径。
NK细胞效应功能强度受NK细胞活化性受体与抑制性受体的平衡、NK细胞的成熟度及对细胞因子的响应体内外多种因素调控。内源性NK细胞往往受疾病及自身HLA分子抑制等多方面影响,数量及效应功能受损,但研究证明来自健康供者的NK细胞具有杀伤肿瘤细胞功能[5]。然而,若输注的NK细胞数量少、疗程短,患者仍面临肿瘤复发的风险。目前,CD3/CD52单抗法和K562饲养层细胞法是临床应用较多的两种NK细胞体外扩增方法[6,7]。本研究比较了以上两种扩增体系NK细胞的生物学特性,并回顾性分析比较了两种扩增体系NK细胞过继性输注治疗allo-HSCT后白血病复发患者的安全性及初步疗效。
NK细胞扩增前采外周血检测表型及功能,体外扩增2周后检测扩增后NK细胞表型及功能各项指标。
外周血来源的单个核细胞及扩增后的NK细胞,加入膜表面抗体标记,避光孵育30 min,溶血并PBS洗涤后上机检测。抗体选择见表1。
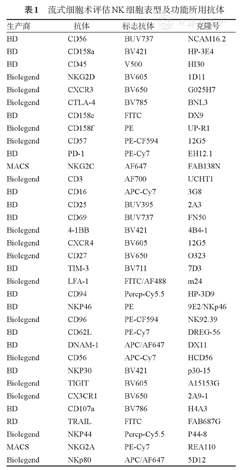
流式细胞术评估NK细胞表型及功能所用抗体
流式细胞术评估NK细胞表型及功能所用抗体
| 生产商 | 抗体 | 标志抗体 | 克隆号 |
|---|---|---|---|
| BD | CD56 | BUV737 | NCAM16.2 |
| BD | CD158a | BV421 | HP-3E4 |
| BD | CD45 | V500 | HI30 |
| Biolegend | NKG2D | BV605 | 1D11 |
| Biolegend | CXCR3 | BV650 | G025H7 |
| Biolegend | CTLA-4 | BV785 | BNL3 |
| BD | CD158e | FITC | DX9 |
| Biolegend | CD158f | PE | UP-R1 |
| Biolegend | CD57 | PE-CF594 | 12G5 |
| BD | PD-1 | PE-Cy7 | EH12.1 |
| MACS | NKG2C | AF647 | FAB138N |
| Biolegend | CD3 | AF700 | UCHT1 |
| BD | CD16 | APC-Cy7 | 3G8 |
| BD | CD25 | BUV395 | 2A3 |
| BD | CD69 | BUV737 | FN50 |
| Biolegend | 4-1BB | BV421 | 4B4-1 |
| Biolegend | CXCR4 | BV605 | 12G5 |
| Biolegend | CD27 | BV650 | O323 |
| BD | TIM-3 | BV711 | 7D3 |
| Biolegend | LFA-1 | FITC/AF488 | m24 |
| BD | CD94 | Percp-Cy5.5 | HP-3D9 |
| BD | NKP46 | PE | 9E2/NKp46 |
| Biolegend | CD96 | PE-CF594 | NK92.39 |
| BD | CD62L | PE-Cy7 | DREG-56 |
| BD | DNAM-1 | APC/AF647 | DX11 |
| Biolegend | CD56 | APC-Cy7 | HCD56 |
| BD | NKP30 | BV421 | p30-15 |
| Biolegend | TIGIT | BV605 | A15153G |
| Biolegend | CX3CR1 | BV650 | 2A9-1 |
| BD | CD107a | BV786 | H4A3 |
| RD | TRAIL | FITC | FAB687G |
| Biolegend | NKP44 | Percp-Cy5.5 | P44-8 |
| MACS | NKG2A | PE-Cy7 | REA110 |
| Biolegend | NKp80 | APC/AF647 | 5D12 |
对于NK细胞扩增前后细胞增殖及细胞毒的评估,则在膜表面抗体标记后,按照Cytofix/Cytoperm试剂盒(美国Becton Dickinson公司产品)说明固定破膜后标记细胞内免疫因子。抗体选择见表1。
16例患者纳入本研究。8例患者输注CD3/CD52扩增NK细胞,均为2011年2月至2014年2月在北京大学血液病研究所进行allo-HSCT且移植后白血病复发患者;8例患者输注K562饲养层扩增NK细胞,为2016年8月至2018年6月在北京大学血液病研究所进行allo-HSCT且移植后白血病复发患者。所有患者均签署知情同意书。
全部采用常规的改良BU/CY(白消安/环磷酰胺)方案,HLA配型不合患者移植预处理方案中加用抗胸腺细胞球蛋白(ATG)[9]。
采用环孢素A(CsA)联合霉酚酸酯(MMF)及短程甲氨蝶呤(MTX)方案。
连续3 d中性粒细胞绝对计数(ANC)≥0.5×109/L为粒细胞植活,PLT≥20×109/L连续7 d且脱离血小板输注为血小板植活[12]。
多参数流式细胞术(MFC)和实时荧光定量PCR(RT-PCR)用来检测MRD[13]。MRD阳性:①MFC连续两次阳性或者WT1连续两次阳性抑或是在同一标本中MFC或WT1阳性各1次;②移植后出现基因重排或突变。MRD缓解:在NK细胞输注后达到MRD阴性状态并维持至少1个月[14]。对于骨髓中原始细胞>5%定义为血液学复发。
通过查阅住院/门诊病历及电话随访方式获取患者生存资料。
采用GraphPad Prism8分析数据,采用非配对t检验进行单因素分析,P<0.05为差异有统计学意义。
CD3/CD52单抗扩增组NK细胞在CD45阳性淋巴亚群中的中位占比为18.9%,而饲养层细胞扩增的NK细胞中位数比例为85.0%,纯度更高。通过对不同体系扩增前后NK细胞活化性受体的表达评估,我们发现滋养层扩增的NK细胞的活化性受体DNAM-1及NKp30的表达都明显高于CD3/CD52单抗扩增组(P=0.016,P=0.006),而NKG2D、Trail占NK细胞的百分比在两组间差异无统计学意义(P>0.05)(图1、图2)。CD25及CD69分别被认为是NK细胞早期活化和晚期活化的重要指标[15]。在我们的队列中,CD25及CD69占NK细胞百分比在CD3/CD52单抗扩增组及饲养层扩增组均无明显差别(P>0.05),提示两种扩增NK细胞尽管在活化性受体表达方面存在差异,但两者综合的活化程度相当(图1、图2)。
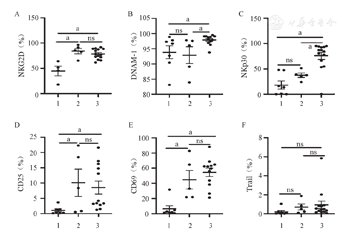

1、2、3分别为扩增前组、CD3/CD52单抗扩增组、饲养层细胞扩增组。ns:差异无统计学意义;aP<0.05

1、2、3分别为扩增前组、CD3/CD52单抗扩增组、饲养层细胞扩增组。ns:差异无统计学意义;aP<0.05
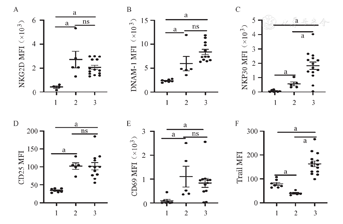
两种体系扩增的NK细胞抑制性受体CTLA4、PD-1、TIM-3的平均荧光强度(MFI)较扩增前均明显上调(P<0.001,P=0.003,P=0.001),然而Tigit的平均荧光强度无明显变化(P>0.05)(图3)。饲养层细胞扩增组NK细胞CTLA4(占NK细胞百分比)的表达明显低于CD3/CD52单抗扩增组(P<0.001),而其他抑制性受体(PD-1、TIM-3、Tigit)在两组间无论是平均荧光强度还是在NK细胞中占比差异均无统计学意义(P>0.05)。提示体外扩增诱导NK细胞活化的同时可能一定程度上伴随功能耗竭。


1、2、3分别为扩增前组、CD3/CD52单抗扩增组、饲养层细胞扩增组。ns:差异无统计学意义;aP<0.05
NK细胞向组织脏器中的迁移依赖于其表面的各种黏附性分子及趋化性受体的表达。为此,我们评估了不同扩增体系对NK细胞表面黏附性分子及趋化性受体表达的影响,结果显示在饲养层细胞扩增组NK细胞中CXCR3、CD96的比例明显高于CD3/CD52单抗扩增组(P=0.004,P=0.037),CX3CR1及4-1BB在NK细胞的表达比例在饲养层扩增组更低,CXCR4、CD94、CD27及CD62L的比例在两种扩增体系NK细胞间差异均无统计学意义(P>0.05),提示从黏附分子和趋化受体表达角度,两种扩增方法各有利弊(图4)。
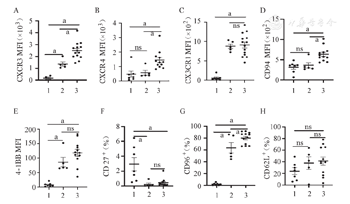

1、2、3分别为扩增前组、CD3/CD52单抗扩增组、饲养层细胞扩增组。MFI:平均荧光强度;ns:差异无统计学意义;aP<0.05
我们通过检测扩增NK细胞的Ki-67指标评估其不同体系的扩增能力。结果显示,饲养层扩增NK细胞的增殖潜能明显高于CD3/CD52单抗扩增NK细胞(P=0.033),穿孔素及颗粒酶B的表达水平也明显高于抗体扩增NK细胞(图5)。
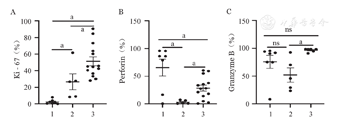

1、2、3分别为扩增前组、CD3/CD52单抗扩增组、饲养层细胞扩增组。MFI:平均荧光强度;ns:差异无统计学意义;aP<0.05。Perforin:穿孔素;Granzyme B:颗粒酶B
CD3/CD52单抗扩增组中男5例、女3例,4例接受同胞HLA全相合allo-HSCT,4例接受haplo-HSCT,7例患者移植时处于完全缓解状态,1例移植前为复发状态。至2021年6月随访终止时,中位随访时间为2 554 d,共有3例患者死亡。
饲养层扩增组中男4例、女4例,5例接受同胞HLA全相合allo-HSCT,3例接受haplo-HSCT,8例患者移植时均处于完全缓解状态。患者首次接受供者来源NK细胞输注的中位时间是移植后482 d。至2021年6月随访终止时,中位随访时间1 015.5(917~1 068)d,共有2例患者死亡。
患者主要临床特点和NK细胞治疗前情况见表2。
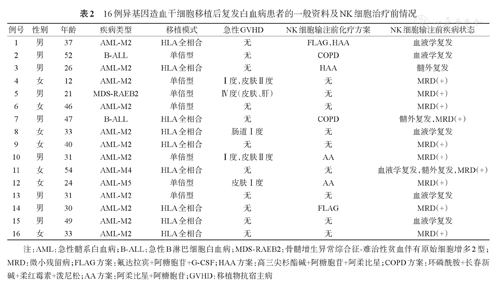
16例异基因造血干细胞移植后复发白血病患者的一般资料及NK细胞治疗前情况
16例异基因造血干细胞移植后复发白血病患者的一般资料及NK细胞治疗前情况
| 例号 | 性别 | 年龄 | 疾病类型 | 移植模式 | 急性GVHD | NK细胞输注前化疗方案 | NK细胞输注前疾病状态 |
|---|---|---|---|---|---|---|---|
| 1 | 男 | 37 | AML-M2 | HLA全相合 | 无 | FLAG,HAA | 血液学复发 |
| 2 | 男 | 52 | B-ALL | 单倍型 | 无 | COPD | 血液学复发 |
| 3 | 男 | 26 | AML-M2 | HLA全相合 | 无 | HAA | 髓外复发 |
| 4 | 女 | 12 | AML-M2 | 单倍型 | Ⅰ度,皮肤Ⅱ度 | 无 | MRD(+) |
| 5 | 男 | 21 | MDS-RAEB2 | 单倍型 | Ⅳ度(皮肤、肝) | 无 | MRD(+) |
| 6 | 女 | 46 | AML-M2 | 单倍型 | 无 | 无 | MRD(+) |
| 7 | 男 | 47 | B-ALL | HLA全相合 | 无 | COPD | 髓外复发,MRD(+) |
| 8 | 女 | 33 | AML-M2 | HLA全相合 | 肠道Ⅰ度 | 无 | 血液学复发 |
| 9 | 女 | 40 | AML-M2 | HLA全相合 | 无 | 无 | MRD(+) |
| 10 | 男 | 31 | AML-M2 | 单倍型 | Ⅰ度,皮肤Ⅱ度 | AA | MRD(+) |
| 11 | 女 | 54 | AML-M4 | HLA全相合 | 无 | 无 | 血液学复发,髓外复发,MRD(+) |
| 12 | 女 | 24 | AML-M5 | 单倍型 | 皮肤Ⅰ度 | AA | MRD(+) |
| 13 | 男 | 31 | AML-M2 | 单倍型 | 无 | 无 | 血液学复发 |
| 14 | 男 | 30 | AML-M2 | HLA全相合 | 无 | FLAG | MRD(+) |
| 15 | 男 | 49 | AML-M2 | HLA全相合 | 无 | 无 | 血液学复发 |
| 16 | 女 | 33 | AML-M2 | HLA全相合 | 无 | 无 | MRD(+) |
注:AML:急性髓系白血病;B-ALL:急性B淋巴细胞白血病;MDS-RAEB2:骨髓增生异常综合征-难治性贫血伴有原始细胞增多2型;MRD:微小残留病;FLAG方案:氟达拉宾+阿糖胞苷+G-CSF;HAA方案:高三尖杉酯碱+阿糖胞苷+阿柔比星;COPD方案:环磷酰胺+长春新碱+柔红霉素+泼尼松;AA方案:阿柔比星+阿糖胞苷;GVHD:移植物抗宿主病
两组患者在NK细胞输注后均未观察到发热、血象下降、脏器功能损害等不良反应。
饲养层细胞扩增组平均接受NK细胞输注次数为1.25次,CD3/CD52单抗扩增组为2.4次。两组共观察到血液学复发5例(伴髓外复发1例),单纯MRD持续阳性8例,单纯髓外复发1例,髓外复发合并MRD阳性1例。患者NK细胞中位输注次数为1次,移植后接受NK细胞输注治疗的中位时间为移植后434(103~1 225)d。NK细胞输注后中位随访时间为2 554(917~2 583)d,复发患者缓解率为16.7%(1/6),MRD阳性患者转阴率为54.5%(6/11),无白血病生存(LFS)率为43.75%(7/16),总生存(OS)率为56.25%(9/16)。对于持续缓解的患者,NK细胞治疗后有6例患者接受化疗联合DLI,4例行2次移植。
饲养层扩增组8例患者中6例有治疗反应,其中HLA全相合移植4例,haplo-HSCT 2例,输注过程均无明显不良反应,其中5例患者至今无白血病长期生存,1例患者因血液复发死亡。CD3/CD52单抗扩增组8例患者中4例有治疗反应,其中HLA全相合移植2例,haplo-HSCT 2例,输注过程均无明显不良反应,其中3例患者至今无白血病长期生存,1例因重症肺炎导致呼吸衰竭而死亡。
而对NK细胞回输治疗无反应患者中,CD3/CD52单抗扩增组8例患者中4例无治疗反应(1例为持续MRD阳性,3例为血液学复发),经化疗、DLI等治疗均未得到缓解,4例均死亡(死于中枢神经系统感染、重度GVHD合并TMA各1例,血液学复发2例)。在饲养层细胞扩增组8例患者中有2例无治疗反应(均为MRD持续阳性),经化疗后分子学及血液学复发指标均未得到缓解,其中1例NK细胞输注后MRD仍持续阳性,但后续再行DLI治疗后MRD转阴,至今无白血病生存;另一例患者死于髓外复发。
CD3/CD52单抗扩增组、饲养层扩增组NK细胞输注后MRD转阴率分别为50%(2/4)、50%(3/6)。
滋养层扩增组的例11在接受NK细胞治疗前有重度慢性GVHD(累及肺、皮肤、口腔等器官);另有3例在移植后分别表现为皮肤、口腔及指甲、皮肤及肺部急性GVHD表现,输注后症状缓解。
在CD3/CD52单抗扩增组,我们观察到3例患者GVHD症状在NK细胞输注后缓解,提示NK细胞可能有抗GVHD的功能。NK细胞治疗情况及疗效见表3。

16例异基因造血干细胞移植后复发白血病患者的NK细胞治疗情况及随访结果
16例异基因造血干细胞移植后复发白血病患者的NK细胞治疗情况及随访结果
| 例号 | NK细胞输注次数 | NK细胞输注量(×109/L) | 疗效评估 | 随访时间(d) | 随访结果 |
|---|---|---|---|---|---|
| 1 | 2 | 6.20 | 无效 | 2 560 | 死亡(中枢神经系统感染) |
| 2 | 1 | 4.76 | 无效 | 2 560 | 死亡(重度GVHD/TMA) |
| 3 | 5 | 6.62 | 有效 | 2 583 | 存活 |
| 4 | 1 | 4.19 | 有效 | 2 540 | 存活 |
| 5 | 3 | 6.02 | 有效 | 2 540 | 存活 |
| 6 | 1 | 0.36 | 无效 | 2 554 | 死亡(血液学复发) |
| 7 | 5 | 10.31 | 有效 | 2 554 | 死亡(重症肺炎) |
| 8 | 1 | 6.44 | 无效 | 2 552 | 死亡(血液学复发) |
| 9 | 1 | 6.18 | 有效 | 1 068 | 存活 |
| 10 | 2 | 7.02 | 有效 | 1 064 | 存活 |
| 11 | 1 | 7.10 | 有效 | 1 019 | 存活 |
| 12 | 1 | 4.40 | 无效 | 917 | 存活 |
| 13 | 1 | 7.32 | 有效 | 1 012 | 死亡(血液学复发) |
| 14 | 2 | 3.14 | 无效 | 994 | 死亡(血液学复发) |
| 15 | 1 | 3.82 | 有效 | 917 | 存活 |
| 16 | 1 | 2.48 | 有效 | 1 047 | 存活 |
注:GVHD:移植物抗宿主病;TMA:血栓性微血管病
NK细胞是机体天然免疫屏障的重要组成,是抗病毒和抗肿瘤的主力军之一[7]。除此之外,供者KIR不相合的NK细胞输注至受者体内,可通过抑制受者来源的抗原提呈细胞及T细胞,降低移植物抗宿主病的发生。因此,过继性输注NK细胞的免疫疗法已成为了潜在抗肿瘤的有效治疗方式。然而,由于外周血NK细胞比例低,获取数量少,使得NK细胞治疗疗效受限。体外细胞扩增体系的发展使得NK细胞可在短期(2~3周)内获取,并且输注的NK细胞在动物及人体中均显示发挥抗肿瘤效应的同时不增加GVHD的发生率[5]。但是,不同扩增体系产出的NK细胞生物学特性和临床疗效存在较大差异[16,17]。Masuyama等[6]首次通过CD3/CD52单抗体外刺激外周血单个核细胞后联合自体血浆及IL-2,在无饲养层细胞体系中实现了NK细胞的量级扩增,且抗肿瘤功能增强。尽管该无饲养层体系扩增NK细胞比例相对较高,但培养14 d后的扩增细胞中CD8+T细胞及CD4+T细胞比例中位值分别为60%、15%。随着体外扩增体系的完善,体外饲养层细胞扩增体系扩增NK细胞效率更佳[14]。然而体外饲养层细胞扩增体系需要大量且持续的因子刺激,当输注至体内后,细胞因子刺激骤失将导致输注后NK细胞代谢加快。本研究首次对CD3/CD52单抗扩增NK细胞与K562饲养层扩增NK细胞的生物学差异进行探讨,结果显示,以K562饲养层扩增的NK细胞纯度较高、T细胞含量较低。两种不同扩增体系NK细胞活化性受体表达及KI-67均明显高于扩增前NK细胞,说明NK细胞扩增同时伴随着功能活化,尤以饲养层扩增组NK细胞的增殖水平及活化性受体DNAM-1及NKP30的表达水平更高,而抑制性受体CTLA4表达明显低于CD3/CD52单抗扩增组,抑制性受体PD-1、Tigit及Tim-3的表达在两组间无明显差异。以上结果提示饲养层扩增的NK细胞的抗肿瘤能力可能更强。值得注意的是,两组扩增后NK细胞的活化性受体明显增加,抑制性受体相较于扩增前组也明显上调,这与Judge等[18]的报道一致,可能是扩增NK细胞为了防止过度活化的适应性调控。
既往有研究前瞻性评估不同体系扩增的NK细胞在治疗AML中的疗效,结果提示过继性NK细胞输注在治疗低白血病负荷中有优势[8,14],然而尚未有研究报道不同体系扩增的NK细胞在治疗AML中的疗效差异。在本研究中,两种不同扩增体系NK细胞在生物学特性上存在差异,两种扩增体系NK细胞输注对移植后血液学复发白血病患者均无显著疗效;而对持续MRD阳性患者来说,在CD3/CD52单抗扩增组和饲养层扩增组,分别有50%(2/4)、50%(3/6)的MRD阳性患者NK细胞治疗后转阴,提示NK细胞治疗可能有清除体内MRD作用,并且以饲养层扩增NK细胞效果更好,这可能与饲养层扩增的NK细胞活化性受体表达更高有关;与此同时,本研究结果表明饲养层扩增NK细胞趋化型因子受体CXCR3与CXCR4的表达均明显高于CD3/CD52单抗扩增NK细胞,提示饲养层扩增NK细胞的迁移速度与向骨髓的趋化能力更高,也更有利于扩增NK细胞向肿瘤部位的迁移[19]。同时,Denman等[20]的研究表明装载IL-21的K562细胞作为饲养层细胞体外扩增NK细胞的端粒酶更长,提示滋养层扩增NK细胞可能体内存活时间更长。
在本研究中,两种扩增体系NK细胞治疗移植后复发白血病患者并未引起或加重GVHD,且两组均有部分患者的急慢性GVHD症状在NK细胞输注后得以缓解,提示NK细胞输注治疗的安全性良好。既往研究表明NK细胞在抗白血病细胞的同时具有抗GVHD效应[5],这得益于NK细胞对效应性T细胞的功能和数量制约:一方面NK细胞可杀伤供者来源的T细胞,同时可通过杀伤不成熟的树突状细胞减少抗原提呈[21,22]。与此同时,异基因来源的NK细胞不损伤患者的靶器官,因此不会发生GVHD和细胞因子风暴(CRS)。
本研究结果初步显示,CD3/CD52单抗扩增与饲养层细胞扩增体系NK细胞的表型和功能具有明显差异,两种扩增体系NK细胞在治疗移植后持续MRD阳性均有效。本研究为回顾性研究且队列样本数少,因此NK细胞输注对allo-HSCT后复发白血病患者的疗效仍需要进一步验证。
本研究所用NK细胞产品由北京赛傲生物技术有限公司提供



























