
探讨典型和不典型免疫表型慢性淋巴细胞白血病(CLL)在免疫表型、遗传学及分子生物学方面的差异及遗传学异常与基因突变的相关性。
依据英国马斯登皇家医院免疫分型积分系统对2014年11月至2021年5月期间南京医科大学第一附属医院收治的488例初诊CLL患者进行分类,其中积分4~5分为典型免疫表型CLL(tCLL)(382例),积分3分为不典型免疫表型CLL(aCLL)(106例)。采用多参数流式细胞术对所有CLL患者外周血标本进行免疫表型检测,荧光原位杂交(FISH)技术检测359例CLL患者的遗传学异常,二代测序(NGS)技术检测330例CLL患者基因突变情况。
aCLL患者CD10、CD22、CD49d、CD81和FMC7阳性表达率显著高于tCLL患者(P值分别为0.020、<0.001、<0.001、0.027和<0.001),CD5、CD23、CD148和CD200的阳性表达率显著低于tCLL患者(P值分别为<0.001、0.017、0.041和<0.001)。aCLL患者+12阳性率显著高于tCLL患者(P<0.001),del(13q14)阳性率显著低于tCLL患者(P<0.001),同时aCLL患者NOTCH1突变发生率高于tCLL患者(P=0.038),其余基因突变发生率在两组间的差异均无统计学意义(P值均>0.05)。生存分析显示,tCLL和aCLL患者总生存(OS)率与无治疗生存(TFS)率的差异无统计学意义(P值均>0.05)。
tCLL与aCLL患者的抗原表达特征、细胞遗传学及体细胞突变均存在差异,有助于tCLL与aCLL的诊断和鉴别诊断。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)是一种淋巴细胞克隆性增殖的恶性血液病,具有典型的形态学和免疫学表型特征。但随着对CLL研究的深入,发现CLL在疾病诊断、发病形式、治疗反应及预后等方面有很大异质性。NCCN指南提出,典型的CLL免疫表型为CD19+CD5+CD23+CD10-CD20dimslgdim,但也存在小部分以slgbright或CD23-/dim或CD20bright为特征的不典型免疫表型。越来越多的学者对具有不典型免疫表型的CLL进行研究。有研究根据Moreau Score(MS)积分系统,将积分<4或CD23-定义为不典型免疫表型CLL(atypical chronic lymphocytic leukemia,aCLL)[1]。与典型免疫表型CLL(typical chronic lymphocytic leukemia,tCLL)相比,aCLL患者WBC和淋巴细胞绝对计数更高,而PLT较低[2]。推测tCLL和aCLL的发生发展和转归可能存在异质性。近年来,随着二代测序(next generation sequencing, NGS)技术逐渐应用于临床,发现了参与CLL发生发展的众多基因突变,涉及NOTCH信号通路、B细胞受体信号通路、细胞凋亡、表观遗传学调控、炎症因子通路、DNA损伤修复与细胞周期调控、RNA代谢等。目前研究多集中于aCLL与tCLL在形态学、免疫表型及遗传学等方面的研究,而分子生物学相关研究尚无报道。本研究回顾性分析488例CLL患者的免疫表型特征,探索aCLL和tCLL细胞遗传学和基因突变的差异、相关性及患者预后的差异。
收集2014年11月至2021年5月南京医科大学第一附属医院(江苏省人民医院)血液科收治的488例初诊CLL患者的临床资料。根据英国马斯登皇家医院(RMH)免疫标志积分系统,积分4~5分为tCLL(382例),积分3分为aCLL(106例)。男330例(67.6%),女158例(32.4%),中位年龄61(22~88)岁,所有患者均符合CLL诊断标准[3]。积分3分病例常规采用荧光原位杂交(FISH)检测t(11;14),免疫组织化学(IHC)检测CyclinD1、SOX11,均为阴性后排除套细胞淋巴瘤(mantle cell lymphoma, MCL);通过组织病理学和FISH检测t(14;18)排除滤泡淋巴瘤(follicular lymphoma, FL)。一些具有不典型形态的淋巴浆细胞性淋巴瘤(lymphoplasmacytic lymphoma, LPL)多为CD23-,结合MYD88 L265P的突变位点等特征进行综合判断并排除。极少数CD5+边缘区B细胞淋巴瘤(marginal zone B-cell lymphoma, MZL)通常表现为CD23-CD200-,结合临床和组织病理学特点排除。根据形态学特点和诊断标准排除CD5+幼稚淋巴细胞白血病(prolymphocytic leukemia, PLL)。
应用多参数FCM分析CLL细胞表面不同抗原的表达情况(美国Beckman Navios流式细胞仪)。应用的单克隆靶向抗体包括:CD5(ECD)、CD10(PE)、CD19(A750)、CD148(PE)、CD20(PC7)、CD22(PB)、CD200(APC)、CD79b(PC5.5)、CD23(APC)、IgM(PB)、CD45(KO)、CD49d(PE)、FMC7(FITC)、CD35(FITC)、CD38(ECD)、CD25(PC5.5)、CD11c(PC7)、CD103(APC)、CD81(FITC)、CD160(PE)、CD19(PC5.5)、Kappa(FITC)、Lambda(PE)(美国Beckman公司)。具体检测步骤参照文献[4],应用Kaluza软件分析免疫表型特点,抗原表达率以≥20%为阳性。
共485例CLL进行染色体核型分析;共359例CLL采用GLP D13S319、LSI TP53探针、LSI MBY探针、LSI ATM DNA探针、CEP +12 DNA探针、LSI IGH探针(美国Vysis公司),运用I-FISH技术分别检测del(13q14)、del(17p13)、del(6q23)、del(11q23)、+12和IGH重排,于Olympus BX60荧光显微镜下观察间期细胞荧光杂交信号,具体步骤详见说明书。以上细胞遗传学异常分别以大于10%、5%、8%、8%、5%、8%为阳性标准。
采用IGVH基因引物和IGH体细胞超突变凝胶检测分析试剂盒(InVivoScribe公司)检测IGVH基因突变,具体参照文献[5]。应用IMGT/V-QUEST数据库对测序结果进行比对分析,以VH碱基突变率≥2%作为体细胞突变标准。
收集患者初诊时骨髓单个核细胞1.0×107,采用DNA提取试剂盒(北京TIANGEN公司)提取基因组DNA,以至少100 ng DNA进行扩增建库,应用Illumina MiSeq测序仪对40个基因外显子热点区域测序,平均测序深度1000×,使用TMAP(torrent mapping alignment program)软件分析测序结果。检测基因包括:ARID1A、ATP6AP1、ATP6V1B2、ATM、BIRC3、BRAF、BTK、BCL2、CARD11、CDKN1B、CHD2、CXCR4、CCND1、CREBBP、EGR2、EP300、EZH2、FOXO1、FAT1、FBXW7、IGLL5、KMT2D、KLF2、KRAS、MAP2K1、MYD88、NFKBIE、NOTCH1、NOTCH2、TP53、PLCG2、PTPRD、POT1、RPS15、RRAGC、SAMHD1、SF3B1、TET2、TNFRSF14、XPO1。
采用SPSS 19.0进行数据分析,计数资料用例数(百分比)描述,计量资料用M(范围)描述。计量资料的比较采用t检验,率的比较采用χ2检验,总生存(OS)率与无治疗生存(TFS)率采用Kaplan-Meier法进行生存分析,采用Log-rank检验进行生存率比较,所有统计学分析采用双侧检验,P<0.05为差异有统计学意义。
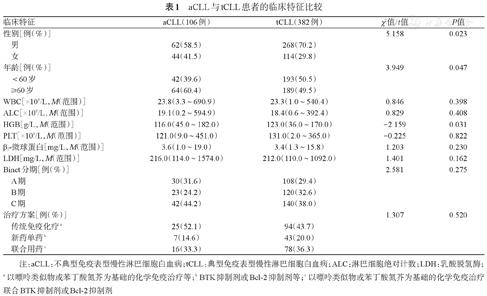
488例CLL患者中,aCLL 106例(21.7%),tCLL 382例(78.3%)。aCLL患者的中位年龄为65(33~88)岁,tCLL患者的中位年龄为59(22~86)岁。与aCLL患者相比,tCLL患者男性比例较高(P=0.023),≥60岁比例较低(P=0.047),HGB较高(P=0.031)。两组患者WBC、淋巴细胞绝对计数、PLT、β2-微球蛋白(β2-MG)、LDH及Binet分期等的差异均无统计学意义(P值均>0.05)(表1)。
aCLL与tCLL患者的临床特征比较
aCLL与tCLL患者的临床特征比较
| 临床特征 | aCLL(106例) | tCLL(382例) | χ2值/t值 | P值 | |
|---|---|---|---|---|---|
| 性别[例(%)] | 5.158 | 0.023 | |||
| 男 | 62(58.5) | 268(70.2) | |||
| 女 | 44(41.5) | 114(29.8) | |||
| 年龄[例(%)] | 3.949 | 0.047 | |||
| <60岁 | 42(39.6) | 193(50.5) | |||
| ≥60岁 | 64(60.4) | 189(49.5) | |||
| WBC[×109/L,M(范围)] | 23.8(3.3~690.9) | 23.3(1.0~540.4) | 0.846 | 0.398 | |
| ALC[×109/L,M(范围)] | 19.1(0.2~594.9) | 18.4(0.6~392.4) | 0.829 | 0.408 | |
| HGB[g/L,M(范围)] | 116.0(45.0~182.0) | 123.0(36.0~170.0) | -2.159 | 0.031 | |
| PLT[×109/L,M(范围)] | 121.0(9.0~451.0) | 131.0(2.0~365.0) | -0.225 | 0.822 | |
| β2-微球蛋白[mg/L,M(范围)] | 3.6(1.0~19.0) | 3.4(1.3~15.8) | 1.203 | 0.230 | |
| LDH[mg/L,M(范围)] | 216.0(114.0~1574.0) | 212.0(110.0~1092.0) | 1.401 | 0.162 | |
| Binet分期[例(%)] | 2.581 | 0.275 | |||
| A期 | 30(31.6) | 108(29.4) | |||
| B期 | 23(24.2) | 120(32.6) | |||
| C期 | 42(44.2) | 140(38.0) | |||
| 治疗方案[例(%)] | 1.307 | 0.520 | |||
| 传统免疫化疗a | 25(52.1) | 94(43.7) | |||
| 新药单药b | 7(14.6) | 43(20.0) | |||
| 联合用药c | 16(33.3) | 78(36.3) | |||
注:aCLL:不典型免疫表型慢性淋巴细胞白血病;tCLL:典型免疫表型慢性淋巴细胞白血病;ALC:淋巴细胞绝对计数;LDH:乳酸脱氢酶;a以嘌呤类似物或苯丁酸氮芥为基础的化学免疫治疗等;b BTK抑制剂或Bcl-2抑制剂等;c以嘌呤类似物或苯丁酸氮芥为基础的化学免疫治疗联合BTK抑制剂或Bcl-2抑制剂
488例aCLL和tCLL患者进行了23个抗原表达分析,aCLL患者CD10、CD22、CD49d、CD81和FMC7的阳性表达率显著高于tCLL患者(P值分别为0.020、<0.001、<0.001、0.027和<0.001),而aCLL患者CD5、CD23、CD148和CD200的阳性表达率显著低于tCLL(P值分别为<0.001、0.017、0.041和<0.001)(图1)。
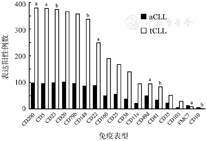

aCLL:不典型免疫表型慢性淋巴细胞白血病;tCLL:典型免疫表型慢性淋巴细胞白血病;与aCLL相比,a P<0.001,b P<0.05
359例患者进行FISH检测,aCLL中+12及IGH重排阳性率显著高于tCLL组(P<0.001和P=0.002),而aCLL中del(13q14)阳性率显著低于tCLL组(P<0.001)。两组del(17p13)、del(11q23)及del(6q23)的阳性表达率差异均无统计学意义(P>0.05)。485例患者进行染色体核型分析,22例aCLL(20.8%)和89例tCLL(23.5%)存在复杂核型(CP)异常(P>0.05)(表2)。
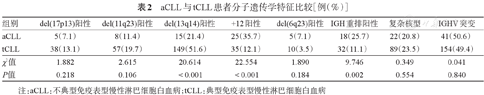
aCLL与tCLL患者分子遗传学特征比较[例(%)]
aCLL与tCLL患者分子遗传学特征比较[例(%)]
| 组别 | del(17p13)阳性 | del(11q23)阳性 | del(13q14)阳性 | +12阳性 | del(6q23)阳性 | IGH重排阳性 | 复杂核型 | IGHV突变 |
|---|---|---|---|---|---|---|---|---|
| aCLL | 5(7.1) | 8(11.4) | 15(21.4) | 25(35.7) | 5(7.1) | 18(25.7) | 22(20.8) | 41(50.6) |
| tCLL | 38(13.1) | 57(19.7) | 149(51.6) | 35(12.1) | 10(3.5) | 32(11.1) | 89(23.5) | 154(49.4) |
| χ2值 | 1.882 | 2.615 | 20.614 | 22.554 | 1.890 | 9.746 | 0.349 | 0.041 |
| P值 | 0.218 | 0.106 | <0.001 | <0.001 | 0.184 | 0.002 | 0.554 | 0.840 |
注:aCLL:不典型免疫表型慢性淋巴细胞白血病;tCLL:典型免疫表型慢性淋巴细胞白血病
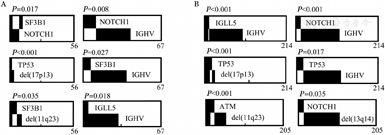
81例aCLL患者和312例tCLL患者检测IGHV突变,两组突变率的差异无统计学意义(P=0.840)。采用NGS对330例初诊CLL患者(aCLL 78例,tCLL 252例)进行40个基因外显子热点区域测序。aCLL基因突变率为53.8%(42/78),其中5.1%(4/78)携带三个及以上基因突变,突变频率最高的基因依次为NOTCH1(15.4%)、SF3B1(10.3%)和IGLL5(7.7%)(图2)。tCLL基因突变率为62.7%(158/252),其中8.7%(22/252)携带三个及以上基因突变,突变频率最高的基因依次为ATM(11.1%)、TP53(9.5%)和NOTCH1(7.5%)(图2)。aCLL组的NOTCH1突变率显著高于tCLL组(P=0.038),两组间其余基因突变率的差异均无统计学意义(P值均>0.05)。进一步选取突变发生率最高的6个基因,分析其基因突变与遗传学异常及IGHV突变状态是否存在关联。结果显示,aCLL中,SF3B1和NOTCH1突变与IGHV无突变型相关(P值分别为0.027和0.008)(图3A)。tCLL中,TP53突变和NOTCH1突变与IGHV无突变型相关(P值分别为0.017和<0.001)(图3B)。aCLL和tCLL患者IGLL5突变均与IGHV突变型相关(P值分别为0.018和<0.001),两组患者中TP53突变在del(17p13)异常的患者中更为常见(图3)。在aCLL中,SF3B1突变与NOTCH1突变相关(P=0.017)(图3A)。
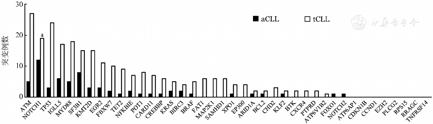

所有基因仅列出一级变异。aCLL:不典型免疫表型慢性淋巴细胞白血病;tCLL:典型免疫表型慢性淋巴细胞白血病;与aCLL相比,a P=0.038

黑色表示阳性或突变,白色表示阴性或无突变,横坐标表示纳入统计的例数。aCLL:不典型免疫表型慢性淋巴细胞白血病;tCLL:典型免疫表型慢性淋巴细胞白血病
随访时间截至2021年7月1日,79例aCLL随访患者中,有48例(60.8%)患者因出现治疗指征(参照国际CLL工作组指南判定)而接受治疗,其中15例患者诊断时即满足治疗指征,33例在观察等待过程中出现治疗指征,另外31例(39.2%)患者随访期内未接受治疗,8例因感染或疾病进展等死亡。整组患者的中位无治疗生存(TFS)时间为38.0(95%CI 31.8~44.2)个月,中位OS时间为54.0(95%CI 46.0~62.0)个月。337例tCLL随访患者中,有215例(63.8%)患者因出现治疗指征(参照国际CLL工作组指南判定)接受治疗,其中62例患者诊断时即满足治疗指征,153例患者在观察等待过程中出现治疗指征,另外122例(36.2%)患者随访期内未接受治疗,28例因感染或疾病进展等死亡。整组患者的中位TFS时间为58.9(95%CI 38.8~79.0)个月,中位OS时间为73.9(95%CI 49.2~98.6)个月。根据治疗方案进一步将aCLL和tCLL分别分为传统免疫化疗组、新药单药组、联合用药组,对其进行生存分析,差异均无统计学意义(P值均>0.05)。在传统免疫化疗组中,aCLL患者的中位OS时间为52.5(95%CI 45.9~59.1)个月,低于tCLL患者的中位OS时间59.0(95%CI 58.0~60.0)个月,差异无统计学意义(P=0.059)。
既往CLL诊断主要依赖细胞形态学,FAB组织基于形态学特征将CLL分成三种亚型:经典型、幼稚淋巴细胞白血病(外周血涂片中有10%~55%幼稚淋巴细胞)及不典型形态的CLL(特征是细胞形态比经典型更大,细胞质更丰富或带有裂隙的淋巴细胞)。资料显示,具有不典型形态学的CLL发生率为10.0%~36.0%[6],本中心aCLL占21.7%。随着多参数FCM应用于CLL的诊断,如今主要通过免疫表型特征分析诊断CLL。本组病例结果显示,aCLL中最常见的表型特征为CD5、CD23阴性及FMC7阳性,与文献[7,8]报道一致。Ting等[9]发现,aCLL中CD200阳性表达率显著高于MCL,本研究显示aCLL中CD200和CD148的阳性表达率显著低于tCLL,同时发现CD10、CD22、CD49d和CD81阳性表达率显著高于tCLL,因此这些免疫标记可以对两者进行鉴别诊断。虽然有学者认为在aCLL中CD38高表达[10],但本研究中两组患者CD38阳性表达率的差异无统计学意义。
CLL常伴随的del(17p)、del(11q)、del(13q)、+12等细胞遗传学异常参与了疾病的发生、发展。文献报道,与tCLL相比,aCLL+12异常比例更高[6,10],而tCLL仅伴del(13q)异常的患者比例明显高于aCLL[11]。本研究发现,aCLL中有25例(35.7%)患者存在+12异常,显著高于tCLL(P<0.001),del(13q)异常发生率显著低于tCLL(P<0.001)。有学者发现,+12与较差的预后相关,del(13q)异常多存在于tCLL且与良好预后相关[10]。
近年来,高通量测序技术的发展极大地促进了CLL分子异常的研究,NOTCH1和SF3B1被认为是最常发生于CLL的分子突变。本研究中突变频率最高的基因是ATM,占10.0%,其次是NOTCH1(9.4%)和TP53(8.2%),与文献报道的初诊CLL中ATM、NOTCH1、TP53的突变率10.0%~20.0%、4.7%~12.3%、4.0%~10.0%一致[12,13,14]。NOTCH1基因位于9号染色体长臂,NOTCH1突变导致其蛋白高表达,进而促进NOTCH1信号通路激活,参与了CLL细胞的生存、抗凋亡及耐药。有学者认为CLL细胞NOTCH1表达水平较其他类型淋巴瘤高,将NOTCH1突变纳入CLL预后不良的重要指标之一,且与Richter转化存在密切联系[15,16,17]。本研究发现,aCLL中NOTCH1突变发生率较tCLL更高,差异有统计学意义(P=0.038),且NOTCH1突变与IGHV无突变型存在明显相关性。本研究提示,在aCLL或tCLL中,IGLL5突变常与IGHV突变同时发生,与Kasar等[18]得出的结论类似,此外,IGLL5突变是低风险CLL患者的独特分子特征。
综上所述,既往aCLL与tCLL的差异研究主要局限于形态学、免疫表型以及遗传学,尚无两者分子学异常差异的研究报道。我们结合NGS比较了两组患者基因突变的差异,进而探索了遗传学异常和基因突变的相关性。本研究发现,与tCLL相比,aCLL常伴随CD49d阳性、+12异常、NOTCH1突变,较少出现del(13q),这些特征不仅有助于aCLL和tCLL的鉴别诊断,同时也有助于对两者的生物学特征进行深入挖掘。我们根据用药情况对两组患者的OS时间和TFS时间进行分析,发现aCLL和tCLL的差异无统计学意义(P值均>0.05)。Criel等[19]的研究发现,与tCLL相比,aCLL的OS时间更短,预后更差,分析其原因可能如下:地域人群和分类方式等不同造成生存差异,本研究通过免疫表型将CLL分为aCLL和tCLL,而Criel等[19]通过形态学分类;由于新药时代来临,临床广泛使用包括BTK抑制剂、BCL-2抑制剂等靶向药物,极大地改善了CLL患者的生存率导致两者差异减小;本研究观察的时间较短。在后续研究中,我们将进一步扩大样本量并进行长期随访,深入研究aCLL和tCLL在预后方面的差异。
所有作者声明无利益冲突



























