
优化小鼠CD3+T细胞体外刺激活化体系及最佳感染时间,构建小鼠CD19嵌合抗原受体T细胞(mCD19 CAR-T),并验证其在体内外的杀伤效果。
磁珠分选纯化小鼠的脾脏CD3+T细胞,在可溶性抗CD3/CD28抗体、佛波酯+离子霉素、包被抗CD3/CD28抗体3种不同条件下刺激培养,分别于8、24、48和72 h流式细胞术检测细胞活性情况;用包含小鼠CD19抗体的scFv质粒转染Plat-E细胞,包装逆转录病毒后感染活化的CD3+T细胞,制备鼠特异性的CD19嵌合抗原受体T细胞(mCD19 CAR-T)。mCD19 CAR-T细胞在体外与B淋巴瘤细胞株A20细胞共培养,利用流式细胞术检测其对A20细胞的靶向杀伤效果;建立淋巴瘤小鼠模型,体内输注mCD19 CAR-T细胞,检测CAR-T细胞的体内杀伤和分布情况。
包被抗CD3/CD28抗体的刺激活化效果最佳,且在刺激后24~48 h具有较好的细胞活性;抗mCD19的逆转录病毒感染CD3+ T细胞效率[(32.27±7.56)%]稳定,制备的mCD19 CAR-T细胞可特异性杀伤A20肿瘤细胞,48 h时A20细胞凋亡率为24.3%;体内检测发现输注mCD19 CAR-T细胞第6天即可检测到脾脏中CD19+细胞比例[(1.83±0.58)%]显著降低,到建模后第12天骨髓和脾脏中CD19+细胞清除更为显著,与A20细胞组相比差异具有统计学意义[脾脏:(0.36±0.04)%对(47.00±13.46)%,P<0.001;骨髓:(1.82±0.29)%对(37.30±1.44)%,P<0.0001]。且mCD19 CAR-T细胞在外周血、脾脏和骨髓中均有分布,GFP+CD3+ CAR-T细胞比例分别为(2.90±1.12)%、(4.96±0.80)%、(13.55±1.56)%,以骨髓中占比最高。
获得优化的CD3+ T细胞活化刺激体系和最佳感染时间,稳定构建了抗mCD19 CAR-T细胞,并在体内外验证其具备良好的杀伤能力。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
嵌合抗原受体T细胞(CAR-T细胞)指通过载体将CAR基因转入T细胞,使其具有非主要组织相容性复合体(MHC)限制性活化、特异性杀伤肿瘤细胞功能的T细胞。CAR结构主要由单链抗体可变区(ScFv)、铰链跨膜区和胞内信号传导结构域组成[1]。以CD19为靶点的CAR-T细胞在复发/难治的血液系统恶性肿瘤中已被广泛应用。截至2021年底,FDA先后批准多款CD19 CAR-T细胞产品Kymriah、Yescarta、Breyanzi和Tecartus分别用于治疗儿童急性淋巴细胞白血病、非霍奇金淋巴瘤(NHL)[2,3]和复发/难治套细胞淋巴瘤(MCL)[4]。目前,CAR-T细胞疗法被认为是最具有前景的肿瘤治疗方式之一[5]。
现有研究报道经CAR-T细胞治疗后约57%的复发/难治NHL患者达到了完全缓解,但大约60%的患者在1年内出现复发[6]。2021年Chong等[7]报道复发/难治弥漫大B细胞淋巴瘤(R/R DLBCL)经CD19 CAR-T治疗后5年的无进展生存率仅为31%。上述数据表明,虽然CD19 CAR-T细胞显著提高了复发/难治B细胞淋巴瘤患者的短期缓解率,但是长期疗效并不令人满意,肿瘤复发仍是CAR-T细胞应用中亟待解决的难题。现有研究发现CAR-T细胞在体外不能得到有效扩增是其治疗后复发的影响因素[8],因此提高T细胞体外扩增效率以及获取最佳活化感染时间是降低CAR-T输注后复发的策略之一。
本研究运用可溶性抗CD3/CD28抗体、佛波酯+离子霉素和包被抗CD3/CD28抗体不同条件来刺激活化小鼠T细胞,获取最佳体外扩增体系和感染时间,构建mCD19 CAR-T细胞,并通过体外和体内实验验证其对CD19+靶细胞的杀伤效果,为后续探索CAR-T细胞输注后机体免疫应答的相关研究奠定基础。
携带鼠CD19抗体基因和绿色荧光蛋白(GFP)的逆转录病毒质粒mCD19、携带人CD19抗体基因和GFP的逆转录病毒质粒hCD19及包装用Plat-E细胞由本实验室保存;逆转录病毒转染试剂X-tremeGENE 9 DNA transfection reagent购自瑞士Roche公司;opti-MEM和FBS均购自美国Gibco公司;DMEM高糖培养基和RPMI 1640培养基均购自江苏凯基生物技术股份有限公司;抗小鼠CD3抗体和CD28抗体均购自美国BioGems公司;重组人IL-2购自美国PeproTech公司;小鼠T细胞分选磁珠购自美国Stem Cell公司;HitransG P病毒感染增强液购自上海吉凯基因医学科技股份有限公司;标记小鼠的CD25 PE抗体、CD3 PE抗体、CD19 BV510抗体均购自美国Biolegend公司;6~8周的雌性BABL/c小鼠购自北京维通利华实验动物技术有限公司;流式细胞仪为美国BD公司LSR Fortessa;荧光显微镜为日本Olympus公司DP72。
将15 μg包含mCD19或hCD19的质粒和45 μl X-tremeGENE 9 DNA transfection reagent转染试剂共同转染Plat-E细胞,转染后24、48和72 h用倒置荧光显微镜观察荧光亮度拍照;收集富含逆转录病毒颗粒的细胞上清液,0.45 μm滤器过滤后小份分装,-80 ℃保存。
获取6~8周的雌性BABL/c小鼠的脾脏,研磨获取脾脏细胞,2.5%的冰醋酸计数后,重悬至1×108个/ml,根据试剂盒说明书进行磁珠分选纯化CD3+T细胞。分选前后留取细胞样本,流式细胞术检测CD3+T细胞的纯度。
获取6~8周的雌性C57BL/6小鼠的脾脏,分选纯化后的CD3+T细胞用RPMI 1640培养基重悬调整细胞数2×106个/ml,接种于用不同刺激剂处理的24孔板中(每孔1 ml),加入100 U/ml IL-2于37 ℃、5%CO2孵箱培养。分组如下:①空白对照组(无刺激剂);②可溶性抗CD3/CD28组,培养基中直接加入抗CD3和抗CD28抗体(终浓度均为2 μg/ml);③佛波酯+离子霉素组,培养基中加入50 ng/ml佛波酯和750 ng/ml离子霉素;④包被抗CD3/CD28组,即利用抗CD3和抗CD28抗体包被培养板4 ℃过夜(终浓度均为2 μg/ml)。不同刺激条件下刺激8、24、48和72 h后,表面抗体CD25染色,PI区分标记死亡细胞,流式细胞术分析CD3+T细胞的活化及凋亡程度。
CD3+T细胞活化36 h后,进行病毒感染。T细胞分组:①阴性对照组,即未感染病毒的活化CD3+T细胞;②hCD19 CAR-T组;③mCD19 CAR-T组。感染前将24孔板中的活化T细胞移入6孔板,每孔加入相应的病毒3 ml,每孔加入40 μl 1×HitransG P病毒感染增强液,1500×g(升降速度均为3)、30 ℃离心80 min后,置于37 ℃、5% CO2的培养箱中继续孵育6~8 h后,更换新鲜的培养基,加入100 U/ml IL-2继续培养。荧光显微镜下观察24、48和72 h的荧光亮度。病毒感染72 h后收集细胞,流式细胞术检测GFP+CAR-T细胞比例。
淋巴瘤细胞株A20细胞表面染色CD19-BV510,流式细胞术检测A20细胞表面CD19的表达情况;将收集好的CAR-T细胞计数后与A20细胞以效靶比1∶1在24孔板中培养(每孔均5×105个A20细胞),分组如下:①CD3+T +A20细胞组;②hCD19 CAR-T+A20细胞组;③mCD19 CAR-T+A20细胞组。流式细胞术分别检测A20细胞12、24和48 h的凋亡率。
18只6~8周的雌性BABL/c小鼠用γ射线进行非致死剂量3 Gy照射,4 h后注射5×105个A20细胞,建立淋巴瘤小鼠模型;建模后第3天注射1×106个CAR-T细胞,分组如下(每组6只):①A20细胞组;②hCD19 CAR-T+A20细胞组;③mCD19 CAR-T+A20细胞组。分别于第6和12天处死小鼠获取外周血、脾脏、骨髓,红细胞裂解后收集淋巴细胞,经CD3-PE、CD19-BV510、PI染色,流式细胞术检测CD19+及GFP+CD3+CAR-T细胞比例。
流式结果使用Flowjo_V10软件进行分析,数据采用Graphpad Prism 7.0进行绘图与统计分析。两样本均数比较采用独立样本t检验,多个样本均数比较采用单因素方差分析,两两比较采用SNK检验。P<0.05为差异有统计学意义。
用Plat-E细胞包装mCD19 CAR-T和hCD19 CAR-T逆转录病毒,结果可见,24 h表达绿色荧光细胞较少且荧光较弱,48 h和72 h表达绿色荧光细胞随时间增多,72 h荧光达到最强(图1)。结果表明在48 h后病毒滴度显著升高,因此收集48 h和72 h的病毒上清,以备后续实验。


CAR-T细胞:嵌合抗原受体T细胞
经磁珠分选小鼠CD3+T细胞后,流式细胞术检测分选后CD3+T细胞的比例高达90%以上,满足后续实验要求(图2A)。CD3+T细胞在可溶性抗CD3/CD28抗体、佛波酯+离子霉素、包被抗CD3/CD28抗体的刺激下,与空白对照组相比,佛波酯+离子霉素组和包被抗CD3/CD28组在8 h时CD3+T细胞表面活化标志CD25略有升高,24 h时CD25表达显著,48 h和72 h时包被抗CD3/CD28组CD3+T细胞活化率可达66.4%且高于佛波酯+离子霉素组;而可溶性抗CD3/CD28组的CD3+T细胞随刺激时间延长仅25.8%的细胞活化,显著低于包被抗CD3/CD28组。同时检测刺激细胞的活性,结果表明佛波酯+离子霉素组和包被抗CD3/CD28组在第24 h活细胞比例开始下降,在48 h降至30%左右(图2B、2C)。上述结果说明,包被抗CD3/CD28抗体的刺激活化效果最佳,且在刺激后24~48 h具有较好的细胞活性。
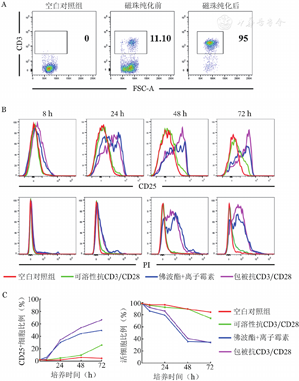

A:磁珠分选前后CD3+T细胞的纯度检测;B:CD3+T细胞分别在空白对照、可溶性抗CD3/CD8抗体(终浓度2 μg/ml)、佛波酯(50 ng/ml)+离子霉素(750 ng/ml)和包被抗CD3/CD28抗体(终浓度2 μg/ml)刺激下,流式细胞术检测8~72 h细胞增殖、凋亡情况;C:不同刺激条件下,8~72 h后CD3+T细胞增殖、凋亡的曲线
于活化后36 h用冻存的逆转录病毒感染,分别制备mCD19 CAR-T和hCD19 CAR-T细胞。在含有IL-2的培养基中,持续培养24、48和72 h,荧光显微镜下观察逆转录病毒感染后GFP的荧光强度。如图3A可见活化感染后T细胞变大、数量增加且聚团生长。mCD19 CAR-T细胞荧光亮度随时间逐渐增强,72 h达到最强;收集72 h感染病毒的CD3+T细胞,流式细胞术检测以GFP+为标记的CAR-T细胞比例为(32.27±7.56)%(图3B)。


A:CD3+T细胞感染的明场和荧光图;B:流式细胞术检测GFP+CAR-T细胞的比例
93.6%的A20细胞表达CD19分子(图4A)。CAR-T细胞与A20细胞共培养12、24和48 h后检测A20细胞的凋亡率,在第12 h mCD19 CAR-T+A20细胞组凋亡率为4.1%,与CD3+T+A20细胞组和hCD19 CAR-T+A20细胞组相比无明显差异;在第24、48 h,mCD19 CAR-T+A20细胞组A20细胞的凋亡率分别为8.26%和24.30%,而对照组和hCD19 CAR-T+A20细胞组无明显变化(图4B)。


A:淋巴瘤细胞株A20细胞表面CD19+表达率;B:未感染病毒的CD3+T+A20细胞组、hCD19 CAR-T组和mCD19 CAR-T组分别与A20细胞(效靶比1∶1)体外共培养12、24、48 h A20细胞凋亡率;CAR-T细胞:嵌合抗原受体T细胞
建模后第6天,mCD19 CAR-T组脾脏CD19+细胞比例[(1.83±0.58)%]显著低于A20细胞组[(12.29±2.53)%]和hCD19 CAR-T+A20细胞组[(13.22±4.83)%],差异均有统计学意义(P<0.001、P<0.05),而外周血和骨髓中无明显差异;第12天,脾脏和骨髓中CD19+细胞比例均减少,显著低于A20细胞组且差异具有统计学意义[脾脏:(0.36±0.04)%对(47.00±13.46)%,P<0.001;骨髓:(1.82±0.29)%对(37.30±1.44)%,P<0.0001],外周血中差异无统计学意义。随着时间的变化,脾脏和骨髓中A20组的CD19+细胞比例随时间升高,而输注mCD19 CAR-T细胞后的CD19+细胞比例明显下降,提示mCD19 CAR-T细胞在小鼠体内可以发挥良好的靶向杀伤作用。
建模后第12天在外周血、脾脏和骨髓中GFP+CD3+CAR-T细胞比例分别为(2.90±1.12)%、(4.96±0.80)%和(13.55±1.56)%;提示mCD19 CAR-T细胞在外周血、脾脏和骨髓中均有分布,且淋巴瘤细胞A20定植的主要器官骨髓中分布最多(图5)。


CAR-T细胞:嵌合抗原受体T细胞
CAR-T细胞疗法在肿瘤的治疗中扮演着重要的角色,在复发/难治性的血液系统恶性肿瘤中效果尤为突出。随着CAR-T细胞新的理想靶点的研发和结构优化,细胞因子释放综合征[9]、神经毒性[10]等并发症的发生率降低、程度减轻。
除了CAR的靶点和自身结构外,CAR-T细胞的疗效与T细胞的活性、扩增和感染效率有直接关系,因此本研究探索了不同刺激条件下CD3+T细胞活化扩增情况和最佳感染时间。对比可溶性的CD3/CD28抗体,固定化的抗体可以更有效地扩增T细胞[11,12,13];佛波酯作为蛋白激酶C的激活物[14]和转运钙离子的离子霉素可共同激活T细胞[15],但此活化方式显著降低了活化后T细胞的活性[16];而且有相关研究报道T细胞在体外反复刺激活化后,亦会产生活化诱导细胞死亡(AICD),导致T细胞的活性降低,从而影响后期CAR-T细胞制备的质量[17,18],所以优化T细胞刺激活化体系、探索活化细胞的最佳感染时间是实现CAR-T细胞在体内保持良好免疫状态的前提。本研究中,我们运用了可溶性抗CD3/CD28抗体、包被抗CD3/CD28抗体、佛波酯+离子霉素分别刺激活化T细胞,结果表明在包被抗CD3/CD28抗体的刺激下T细胞的克隆增殖更好,且在刺激后24~48 h仍具有良好的细胞活性。因此,采用此培养体系,可使细胞感染携逆转录病毒效率更高,且保持良好的体内免疫应答功能。
本实验利用单纯活化的CD3+T细胞、mCD19 CAR-T细胞和hCD19 CAR-T细胞与鼠源A20细胞共培养,活化CD3+T细胞和hCD19 CAR-T细胞均不能杀伤A20细胞,凋亡率无显著差异,而mCD19 CAR-T细胞对A20细胞具有显著的杀伤作用,说明了mCD19 CAR-T细胞对小鼠来源的CD19抗原具有靶向特异性。为了进一步验证mCD19 CAR-T细胞的体内效果分布特征,我们检测了A20荷瘤小鼠体内CD19+细胞比例。在建模后第6天和第12天,对比hCD19 CAR-T细胞组,输注了mCD19 CAR-T细胞组的小鼠在骨髓和脾脏中分别检测到CD19+细胞比例显著下降,表明mCD19 CAR-T细胞在体内可有效发挥特异性杀伤作用。与此同时,我们检测了CAR-T细胞在小鼠体内的分布,建模后第12天在外周血、骨髓和脾脏中,均检测到CAR-T细胞的分布,与文献[19]报道一致,且其在淋巴瘤细胞A20定植的主要器官骨髓中分布最多。
综上所述,我们运用不同的刺激活化体系,筛选获得了最佳的CD3+T细胞培养条件,优化了逆转录病毒感染小鼠原代T细胞的最佳时间,成功制备了mCD19 CAR-T细胞,并在体内外展现了良好的杀伤能力,可用于我们后续进一步的研究。
所有作者声明无利益冲突



























