
探讨双表达弥漫大B细胞淋巴瘤(DLBCL)的临床特征与预后。
回顾性分析2016年1月至2020年12月北京大学第三医院收治的166例双表达DLBCL患者的临床资料,分析患者的临床特征、生存和预后因素。
共收集DLBCL患者410例,其中双表达淋巴瘤(DEL)166例(40.5%)。男82例,女84例,中位诊断年龄63.5(21~95)岁。110例(66.3%)患者初诊年龄≥60岁,106例(106/163,65.0%)患者诊断时LDH升高,74例(74/160,46.2%)诊断时β2-微球蛋白(β2-MG)≥ 3 mg/L,107例(107/163,65.6%)结外受累数目≥2个,65例(65/166,39.2%)有B症状,131例(131/165,79.4%)初诊时分期为Ⅲ、Ⅳ期,41例(41/161,25.5%)初诊时国际预后指数(IPI)评分0~2分,38例(38/161,23.6%)初诊时IPI评分3分,82例(82/161,50.9%)初诊IPI评分4~5分。DEL患者中9例(9/56,16.1%)具有MYD88和CD79B突变。单因素分析显示,年龄≥60岁(P=0.004)、β2-MG水平升高(P=0.002)、IPI评分高(P=0.003)与较差的总生存(OS)相关,β2-MG水平升高(P=0.031)、LDH水平升高(P=0.017)、分期Ⅲ~Ⅳ期(P=0.001)、IPI评分高(P=0.013)、免疫组化p53突变型(P=0.049)和PIM1突变(P=0.039)与较差的无进展生存(PFS)相关。多因素分析显示,IPI评分4~5分(HR=2.622,95%CI 1.398~4.917,P=0.003)是影响DEL患者OS的独立危险因素。生存分析显示,DEL与非DEL患者的PFS率差异有统计学意义(65.6%对75.1%,P=0.002),而OS率的差异无统计学意义(81.8%对83.6%,P=0.226)。在DEL患者中,REPOCH方案的总有效率高于RCHOP或RCHOP样方案(81.5%对63.4%,P=0.004)。
DEL是一组侵袭性较强的淋巴瘤,具有较差的PFS,采用REPOCH方案化疗可能会改善患者的整体预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
弥漫大B细胞淋巴瘤(DLBCL)是最常见的侵袭性非霍奇金淋巴瘤(NHL),临床上具有明显的异质性,根据基因表达谱和免疫组化方法对DLBCL进行细胞起源(COO)分型,可分为生发中心来源(GCB)和非GCB(non-GCB)两种亚型,该分型方法对于预后的价值已得到广泛接受和认可,但仍有部分患者的预后具有差异性。在2016版世界卫生组织(WHO)关于造血和淋巴系统肿瘤的分类中将伴有c-myc和bcl-2和(或)bcl-6基因重排正式定义为高级别B细胞淋巴瘤(HGBL)[1],具有c-myc和bcl-2或bcl-6易位的B细胞淋巴瘤被称为双打击淋巴瘤(DHL),具有三个基因易位的B细胞淋巴瘤被称为三打击淋巴瘤(THL)。免疫组化染色提示Myc和Bcl-2蛋白高表达,而FISH分析未显示基因重排,被称为双表达淋巴瘤(DEL)[2,3,4,5]。
目前研究认为DEL的预后优于DHL,但与普通DLBCL相比生存率仍较差[6]。由于其诊断标准(Myc和Bcl-2阳性阈值)及预后仍存在争议,且NCCN指南中并未提出统一有效的治疗方案,因此目前并未将其列为独立的诊断类型,对于此类患者是否需要调整治疗策略也无定论。基于此,本研究回顾性分析了北京大学第三医院血液科收治的166例DEL患者,对患者的临床资料进行分析,并进一步探讨DEL患者的诊断和治疗策略。
本研究回顾性收集了2016年1月至2020年12月北京大学第三医院就诊的410例初治DLBCL患者的临床资料,所有患者均根据2008版WHO造血与淋巴系统肿瘤分类诊断标准经过病理组织活检和(或)免疫组织化学染色进行诊断。通过免疫组织化学染色检测肿瘤细胞中Myc、Bcl-2的表达,Myc≥40%且Bcl-2≥50%定义为DEL,通过荧光原位杂交(FISH)检测有无c-myc、bcl-2和(或)bcl-6基因重排。410例初治DLBCL患者中DEL患者166例(40.5%),其中114例完善了FISH相关检查,10例(10/114,8.8%)患者为DHL。
在DEL患者中,56例患者进行了高通量测序基因突变检测,检测的基因包括B2M、BCL2、BCL6、CARD11、CD79A、CD79B、KMT2D、MYC、MYD88、PIM1、STAT6、TP53等55个基因。
166例DEL患者中82例接受了RCHOP方案(利妥昔单抗+环磷酰胺+阿霉素+长春新碱+泼尼松)或RCHOP样方案化疗,65例接受REPOCH方案(利妥昔单抗+依托泊苷+泼尼松+长春新碱+环磷酰胺+阿霉素)化疗,11例接受了COPADM方案(环磷酰胺+长春新碱+大剂量甲氨蝶呤+阿霉素)、R-GDP方案(利妥昔单抗+吉西他滨+顺铂+地塞米松)、TEDDi-R方案(替莫唑胺+依托泊苷+脂质体阿霉素+地塞米松+利妥昔单抗)、R-hyper CVAD(环磷酰胺+长春新碱+阿霉素+地塞米松+利妥昔单抗)等其他化疗方案的治疗,8例未接受系统治疗。在接受系统治疗的158例患者中,20例患者接受了自体造血干细胞移植(auto-HSCT)。本研究中,化疗方案未进行剂量调整,高龄患者减量1/4,如治疗期间出现粒细胞缺乏伴发热会继续减量。
采用门诊或电话联系的方式随访,随访截止时间为2021年4月。无进展生存(PFS)时间定义为自患者诊断至首次出现疾病进展、死亡或随访截止的时间。总生存(OS)时间定义为自患者诊断至因任何原因死亡或随访截止的时间。
采用SPSS 20.0软件进行统计学分析,P<0.05为差异有统计学意义。计数资料采用例数(百分比)形式描述,计量资料采用中位数(范围)描述。预后影响因素的单因素分析采用Kaplan-Meier法和Log-rank检验,并绘制生存曲线,采用Cox比例风险回归模型进行多因素分析。
本研究共纳入166例初诊DEL,其中男82例,女84例,中位诊断年龄63.5(21~95)岁,110例(66.3%)患者初诊年龄≥60岁,106例(106/163,65.0%)患者诊断时LDH升高,74例(74/160,46.2%)诊断时β2-微球蛋白(β2-MG)≥3 mg/L,107例(107/163,65.6%)结外受累数目≥2个,65例(39.2%)有B症状,131例(131/165,79.4%)初诊时分期为Ⅲ、Ⅳ期,41例(41/161,25.5%)初诊时国际预后指数(IPI)评分0~2分,38例(38/161,23.6%)初诊时IPI评分3分,82例(82/161,50.9%)初诊IPI评分4~5分。DEL患者与非DEL患者年龄(P=0.042)、分期(P=0.034)、IPI评分(P=0.002)和β2-MG水平(P=0.002)的差异有统计学意义(表1)。
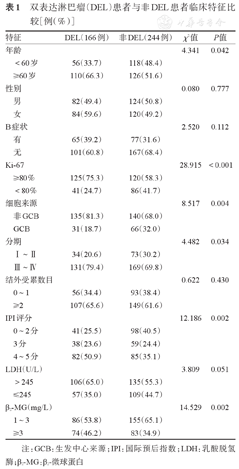
双表达淋巴瘤(DEL)患者与非DEL患者临床特征比较[例(%)]
双表达淋巴瘤(DEL)患者与非DEL患者临床特征比较[例(%)]
| 特征 | DEL(166例) | 非DEL(244例) | χ2值 | P值 | |
|---|---|---|---|---|---|
| 年龄 | 4.341 | 0.042 | |||
| <60岁 | 56(33.7) | 118(48.4) | |||
| ≥60岁 | 110(66.3) | 126(51.6) | |||
| 性别 | 0.080 | 0.777 | |||
| 男 | 82(49.4) | 124(50.8) | |||
| 女 | 84(59.6) | 120(49.2) | |||
| B症状 | 2.520 | 0.112 | |||
| 有 | 65(39.2) | 77(31.6) | |||
| 无 | 101(60.8) | 167(68.4) | |||
| Ki-67 | 28.915 | <0.001 | |||
| ≥80% | 125(75.3) | 120(58.3) | |||
| <80% | 41(24.7) | 86(41.7) | |||
| 细胞来源 | 8.517 | 0.004 | |||
| 非GCB | 135(81.3) | 140(68.0) | |||
| GCB | 31(18.7) | 66(32.0) | |||
| 分期 | 4.482 | 0.034 | |||
| Ⅰ~Ⅱ | 34(20.6) | 73(30.2) | |||
| Ⅲ~Ⅳ | 131(79.4) | 169(69.8) | |||
| 结外受累数目 | 0.622 | 0.430 | |||
| 0~1 | 56(34.4) | 93(38.4) | |||
| ≥2 | 107(65.6) | 149(61.6) | |||
| IPI评分 | 12.186 | 0.002 | |||
| 0~2分 | 41(25.5) | 98(40.5) | |||
| 3分 | 38(23.6) | 59(24.4) | |||
| 4~5分 | 82(50.9) | 85(35.1) | |||
| LDH(U/L) | 3.809 | 0.051 | |||
| >245 | 106(65.0) | 135(55.3) | |||
| ≤245 | 57(35.0) | 109(44.7) | |||
| β2-MG(mg/L) | 14.529 | 0.002 | |||
| 1~3 | 86(53.8) | 155(65.1) | |||
| ≥3 | 74(46.2) | 83(34.9) | |||
注:GCB:生发中心来源;IPI:国际预后指数;LDH:乳酸脱氢酶;β2-MG:β2-微球蛋白
166例DEL患者初诊时的免疫组化结果显示,135例(81.3%)为non-GCB亚型,31例(18.7%)为GCB亚型;143例(86.1%)Ki-67≥70%,125例(75.3%)Ki-67≥80%,61例(36.7%)Ki-67≥90%;54例(32.5%)Myc≥50%,21例(12.7%)Myc≥70%;69例(41.6%)Bcl-2≥70%,32例(19.3%)Bcl-2≥90%;36例(36/86,41.9%)患者p53为突变型。
166例DEL患者中56例进行了二代测序基因突变检测,56例患者均存在基因突变,其中IGLL5、PIM1、CD79B、MYD88、KMT2D、BTG1、TP53、PRDM1、DTX、BTG2、PCLO、TMSB4X、BCL2、CREBBP和CCND3的突变频率大于10%,CD79B和MYD88双突变患者9例(9/56,16.1%),TP53突变患者10例(10/56,17.8%)(图1)。
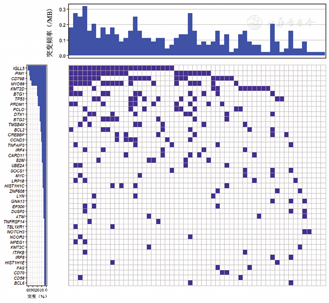

相关性分析显示,IGLL5突变与高分期和B症状相关,PIM1突变与年龄相关。其余基因突变与性别、年龄、结外累及、骨髓受累、分期、有无B症状、LDH水平、β2-MG水平、IPI评分均无关。
166例DEL患者中158例进行了化疗,其中82例接受RCHOP或RCHOP样方案化疗,65例接受REPOCH样方案化疗,11例接受其他方案化疗。接受6个周期化疗后进行评估,所有DEL患者初始治疗后总有效率(ORR)为68.3%(108/158),完全缓解(CR)率为50.6%(80/158),部分缓解(PR)率为17.7%(28/158)。其中,RCHOP或RCHOP样方案化疗的ORR为63.4%(52/82),CR率为42.7%(35/82),PR率为20.7%(17/82)。REPOCH方案化疗的ORR为81.5%(53/65),CR率为64.6%(42/65),PR率为16.9%(11/65)。对于DEL患者,REPOCH方案组的ORR优于RCHOP或RCHOP样方案组,差异有统计学意义(P=0.004)。
在接受化疗的158例DEL患者中,120例完成了6个疗程的化疗,CR率为56.7%(68/120),PR率为20%(24/120),ORR为76.7%(92/120);38例未完成6个疗程的化疗,CR率为31.6%(12/38),PR率为7.9%(3/38),ORR为39.5%(15/38)。75岁及以上的DEL患者32例,14例未完成化疗,16例完成6个疗程的化疗,2例未接受治疗。完成化疗的16例患者的CR率为31.3%(5/16),PR率为37.5%(6/16),ORR为68.8%(11/16)。
244例非DEL患者中232例进行了化疗,12例患者未接受治疗。接受化疗的232例患者中168例接受RCHOP或RCHOP样方案化疗,55例接受REPOCH样方案化疗,9例接受其他方案化疗。接受6个周期化疗后进行评估,所有非DEL患者初始治疗后ORR为71.1%(165/232),CR率为57.3%(133/232),PR率为13.8%(32/232)。其中,接受RCHOP或RCHOP样方案化疗患者的ORR为72%(121/168),CR率为57.1%(96/168),PR率为14.9%(25/168);接受REPOCH方案化疗患者的ORR为70.9%(39/55),CR率为60.0%(33/55),PR率10.9%(6/55)。对于非DEL患者,REPOCH方案组与RCHOP或RCHOP样方案组疗效的差异无统计学意义(P=0.744)。
DEL组分析结果显示,接受RCHOP样方案治疗的82例患者中,non-GCB亚型70例,复发率为41.4%(29/70),死亡率为18.6%(13/70);GCB型12例,复发率为16.7%(2/12),死亡率为8.3%(1/12)。接受REPOCH方案治疗的65例患者中,non-GCB亚型52例,复发率为36.5%(19/52),死亡率为13.5%(7/52);GCB亚型13例,复发率为30.8%(4/13),死亡率为0。
166例DEL患者中,158例接受系统治疗,其中20例患者接受了auto-HSCT,138例患者未进行auto-HSCT,移植组和非移植组的3年OS率分别为90%和85.5%(P=0.532);1年复发率分别为5%和24.6%(P=0.049)。
20例接受auto-HSCT的患者中男12例,女8例,5例(25%)患者初诊时年龄≥60岁,15例(75%)为non-GCB亚型,18例(90%)患者Ki-67≥70%,17例(85%)Ki-67≥80%,11例(55%)Ki-67≥90%;5例(25%)患者Myc≥50%,4例(20%)Myc≥70%;8例(40%)患者Bcl-2≥70%,3例(15%)Bcl-2≥90%。13例(65%)患者p53为突变型,11例(55%)诊断时LDH升高,7例(35%)诊断时β2-MG≥3 mg/L,14例(70%)结外受累数目≥2,7例(35%)有B症状,17例(85%)初诊时Ann Arbor分期Ⅲ~Ⅳ期,10例(50%)初诊时IPI评分为0~2分,5例(25%)初诊IPI评分3分,5例(25%)初诊IPI评分为4~5分,3例(15%)有骨髓受累,19例(95%)移植时已达到CR。
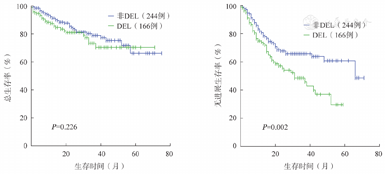
410例DLBCL患者中接受系统治疗的可随访患者367例,中位随访时间为18(0~75)个月,1年、3年、5年OS率分别为89.6%、85.9%、82.8%,1年、3年、5年PFS率分别为81.2%、72.5%、71.1%。其中154例DEL患者1年、3年、5年OS率分别为87.7%、83.8%、81.8%,1年、3年、5年PFS率分别为77.9%、68.2%、65.6%。213例非DEL患者1年、3年、5年OS率分别为91.1%、85.9%、83.6%,1年、3年、5年PFS率分别为83.6%、75.6%,75.1%。DEL与非DEL患者PFS率的差异有统计学意义(P=0.002),OS率的差异无统计学意义(P=0.226)(图2)。

CD79B和MYD88双突变的9例患者1年、3年OS率均为100%,1年、3年PFS率分别为88.9%和66.7%。进一步生存分析显示CD79B和MYD88双突变未导致预后不良。
本研究有81例DEL患者接受了中枢神经系统预防,共有7例中枢神经系统受累患者,其中3例(3.7%)为中枢神经系统原发DEL,4例(4.9%)为中枢神经系统继发DEL。81例DEL患者1年、3年、5年OS率分别为90.4%、76.5%、76.5%,1年、3年、5年PFS率分别为63.0%、42.0%、37.0%。
单因素分析显示,年龄≥60岁(P=0.004)、β2-MG水平升高(P=0.002)、IPI评分高(P=0.003)与较差的OS相关,β2-MG水平升高(P=0.031)、LDH水平升高(P=0.017)、分期Ⅲ~Ⅳ期(P=0.001)、IPI评分高(P=0.013)、免疫组化p53突变型(P=0.049)和PIM1突变(P=0.039)与较差的PFS相关。多因素分析显示,IPI评分4~5分(HR=2.622,95%CI 1.398~4.917,P=0.003)是影响DEL患者OS的独立危险因素。本研究中Ki-67以70%、80%、90%作为界值,Myc蛋白以50%、60%、70%作为界值,各组预后的差异均无统计学意义(P值均>0.05)。
本研究中DEL的发病率为40.5%,Hwang等[7]报道的一项Meta分析中提到,DEL的发病率为6%~50%,偏倚调整后的发病率为31%(95%CI 27%~36%)。本研究中DEL发病率偏高,我们收治的患者中部分是外院化疗后患者,可能存在选择偏倚。
多数研究表明,DEL患者预后较差,且更容易出现在高龄患者中,存在分期晚、结外受累及IPI评分高危等不良因素[8,9]。本研究中,与非DEL患者的基线特征比较,DEL具有高龄(>60岁)、疾病分期晚(Ⅲ~Ⅳ期),β2-MG水平高、IPI评分高,Ki-67高表达特点,与预后不良具有相关性,与既往文献报道基本相同[10]。本研究中DEL以non-GCB亚型为主,占81.2%,而GCB亚型仅占18.8%,与Ting等[11]的报道(两种亚型分别占74.2%和25.8%)基本相同。而Akyurek等[12]报道,DEL中两种亚型的比例分别为49.0%与51.0%。亚组分析显示,对于DEL患者,无论是R-CHOP样还是R-EPOCH样方案治疗,non-GCB亚型的复发率和死亡率均较GCB亚型高。
目前WHO建议以c-Myc≥40%、Bcl-2≥50%作为DEL诊断阈值,本研究中采用该定义。研究结果显示DEL组患者5年PFS率低于非DEL组患者(65.6%对75.1%,P=0.002),5年OS率略低于非DEL组(81.8%对83.6%,P=0.226)。目前不同研究对于c-Myc、Bcl-2的最佳阳性阈值存在争议,Johnson等[2]以c-Myc>40%和Bcl-2>50%作为阈值,DEL组显示出较差的5年OS率(39%对70%,P<0.001)和5年PFS率(44%对66%,P=0.002)。与此同时,也有部分国内外研究采用c-Myc≥40%、Bcl-2≥50%作为阈值,结果显示,DEL组患者的OS率和PFS率仅略低于非DEL组,差异无统计学意义[13]。Zaiem等[14]认为,DLBCL中Ki-67≥80%与预后不良相关,但本研究中,Ki-67≥80%与Ki-67<80%的患者相比,OS及PFS差异均无统计学意义,可能是由于本研究DEL患者的Ki-67水平普遍较高,75.3%的DEL患者Ki-67水平超过80%。
既往研究认为,TP53突变与淋巴瘤的形成有关,是DLBCL患者的独立不良预后因素,且TP53突变与p53过表达相关[15,16]。本研究中,p53突变型与较差的PFS相关(P=0.049),但p53突变型未显示较差的OS,可能与复发后的积极治疗改善了这类患者的预后有关。
NCCN指南一线推荐RCHOP方案作为治疗DLBCL的方案,更高强度的REPOCH方案作为DHL的治疗方案,但DEL的一线方案仍未得出统一结论。Ting等[11]的研究显示,DEL在老年患者中更为普遍,接受RCHOP样方案治疗的DEL患者的中位OS时间较非DEL患者缩短[(17.7±4.4)个月对(29.8±1.9)个月,P=0.080]。CALGB 50303研究显示,与RCHOP方案相比,REPOCH方案的毒性更大,不能改善PFS或OS,但研究也指出,高IPI评分及具有不良预后因素患者能否获益尚不明确[17]。M.D. Anderson癌症中心的一项回顾性研究评估了16例接受R-EPOCH方案治疗的DEL患者的临床结局,结果显示,1年PFS率为65%,1年OS率为86%[18]。Aggarwal等[19]回顾性评估了16例DEL患者,R-CHOP组的复发率显著高于R-EPOCH组(80%对18%,P=0.042)。本研究显示,在6个周期化疗后进行疗效评估,一线REPOCH方案化疗的疗效明显优于一线R-CHOP样方案化疗(P=0.004)。
此外,DEL患者是否需要进行auto-HSCT以及移植时机目前也尚无统一认识。Oki等[20]的研究显示,对于DHL患者,auto-HSCT或异基因造血干细胞移植(26例)未使无事件生存或OS获益。另一项研究将12例DEL患者随机分组,未行造血干细胞移植患者的2年PFS率为29%,行造血干细胞移植患者的2年PFS率为60%[21]。Kim等[22]的一项研究纳入67例接受auto-HSCT的DLBCL患者,DEL组与非DEL组5年OS率与5年PFS率的差异无统计学意义(P值分别为0.429和0.614)。本研究中20例DEL患者接受了auto-HSCT,1年复发率为5%,1年OS率为100%,3年OS率为90%。20例患者中,1例为疾病进展后行补救治疗,其余19例均在6或8个周期获得CR后进行auto-HSCT,在移植后的1年内未复发,3年复发率为26.3%(5/19)。根据上述结果,DEL患者在初始治疗获得CR后行auto-HSCT是能够获益的。
综上所述,本研究显示,DEL是一组侵袭性较强的淋巴瘤,患者具有高龄、疾病分期晚、β2-MG水平高、高IPI评分特点,病理类型主要为non-GCB,Ki-67高表达,PFS较差。高IPI评分、免疫组化p53突变是DEL患者的预后不良因素。采用高强度的REPOCH方案化疗、一线进行auto-HSCT和CAR-T细胞治疗可能会改善DEL患者的整体预后。本研究为单中心回顾性研究,部分老年患者的用药剂量偏低、随访时间不够是本文的局限之处。
所有作者声明无利益冲突



























