
对于伴混合系白血病基因重排(Mixed Lineage leukemia rearrangement, MLL-r)的AML,MLL相关的融合基因可以作为有效的微小残留病(MRD)标志,对造血干细胞移植后的复发进行有效预测[1]。伴不同MLL-r的AML初诊时融合基因定量水平不同,随着肿瘤负荷变化的动力学也不尽相同,因此,可能并非所有类型的MLL-r都是最佳的分子MRD监测指标。此外,少数患者会出现克隆演变,流式细胞术(FCM)检测AML MRD的敏感性(10-3~10-4)一般低于分子生物学检测(10-4~10-5)[2],而WT1作为泛白血病标志物可用于对大多数AML的MRD进行监测[3]。临床中我们会同时监测FCM、MLL相关融合基因以及WT1水平,观察伴有MLL-r的AML的MRD状态,预警移植后白血病复发。本研究拟比较WT1和MLL-r作为伴MLL-r的AML的MRD标志,预测移植后复发的阳性预测值和阴性预测值,以评估其临床应用价值。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
对于伴混合系白血病基因重排(Mixed Lineage leukemia rearrangement, MLL-r)的AML,MLL相关的融合基因可以作为有效的微小残留病(MRD)标志,对造血干细胞移植后的复发进行有效预测[1]。伴不同MLL-r的AML初诊时融合基因定量水平不同,随着肿瘤负荷变化的动力学也不尽相同,因此,可能并非所有类型的MLL-r都是最佳的分子MRD监测指标。此外,少数患者会出现克隆演变,流式细胞术(FCM)检测AML MRD的敏感性(10-3~10-4)一般低于分子生物学检测(10-4~10-5)[2],而WT1作为泛白血病标志物可用于对大多数AML的MRD进行监测[3]。临床中我们会同时监测FCM、MLL相关融合基因以及WT1水平,观察伴有MLL-r的AML的MRD状态,预警移植后白血病复发。本研究拟比较WT1和MLL-r作为伴MLL-r的AML的MRD标志,预测移植后复发的阳性预测值和阴性预测值,以评估其临床应用价值。
2008年7月至2020年10月期间于北京大学人民医院血液科确诊的AML伴MLL-r并接受造血干细胞移植的连续患者100例,患者的诊断依据MICM标准[4]。纳入标准:①年龄>12岁;②原发性AML;③移植后MRD监测同时检测了MLL-r和WT1。排除标准:①继发性AML或者治疗相关性AML;②临床随访信息不全。
所有患者均进行了形态学、常规细胞遗传学、免疫表型分析,具体操作步骤参考文献[5]。应用实时定量PCR(RQ-PCR)方法检测12种MLL融合基因(MLL-AF4、MLL-AF6、MLL-AF9、MLL-AF10、MLL-ELL、MLL-ENL、MLL-AF1p、MLL-AF1q、MLL-SETP6、MLL-SETP9、MLL-AF17和MLL-AFX),具体方法参照文献[6]。WT1基因表达水平(%)=WT1拷贝数/ABL拷贝数×100%,WT1>0.6%定义为阳性[7,8]。MLL-r>0%定义为阳性[1]。
对于HLA不完全相合的患者接受以下治疗:甲环亚硝脲(Me-CCNU)250 mg/m2,-3 d,1次;白消安(BU)3.2 mg·kg-1·d-1静脉滴注,-8~-6 d;阿糖胞苷(Ara-C)4 g·m-2·d-1,-10~-9 d;兔抗胸腺细胞球蛋白(ATG)2.5 mg·kg-1·d-1,-5~-2 d;环磷酰胺(CTX)1.8 g·m-2·d-1,-5~-4 d。对于HLA相合的同胞供者移植(MSDT),Ara-C减量为2 g·m-2·d-1并且加用羟基脲(80 mg/kg总剂量)。所有患者均接受了包括G-CSF(5 μg·kg-1·d-1,5 d)动员的骨髓和外周血的同种异基因移植混合物。未处理的外周血干细胞(在G-CSF后第5天收集)和骨髓(在G-CSF后第4天收集)在收集当天回输。采用霉酚酸酯、甲氨蝶呤和环孢素A预防移植物抗宿主病[9]。
对移植后MRD阳性患者进行的干预措施包括减停免疫抑制剂、使用干扰素、联合化疗的改良供者淋巴细胞输注等。如患者发生严重的移植物抗宿主病、感染或器官衰竭等,暂不进行复发干预[10]。
移植后骨髓或髓外复发标准参考文献[3]。
通过查阅患者电子病历进行随访,随访截止日期为2021年9月30日,中位随访时间为1 192(49~4 647)d。
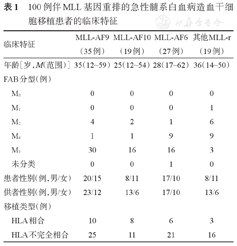
100例伴有MLL-r融合基因的AML患者根据MLL-r的种类分为四组:MLL-AF9(35例),MLL-AF10(19例),MLL-AF6(27例)和其他MLL-r(19例,其中1例AF17,2例AF1q,2例AF4,11例MLL-ELL,1例MLL-ENL,2例MLL-SEPT9)。四组患者的临床资料见表1。各组伴MLL-r的AML患者主要分布在M4、M5两个亚型中。
100例伴MLL基因重排的急性髓系白血病造血干细胞移植患者的临床特征
100例伴MLL基因重排的急性髓系白血病造血干细胞移植患者的临床特征
| 临床特征 | MLL-AF9(35例) | MLL-AF10(19例) | MLL-AF6(27例) | 其他MLL-r(19例) | |
|---|---|---|---|---|---|
| 年龄[岁,M(范围)] | 35(12~59) | 25(12~54) | 28(17~62) | 36(14~50) | |
| FAB分型(例) | |||||
| M0 | 0 | 0 | 0 | 0 | |
| M1 | 0 | 0 | 0 | 1 | |
| M2 | 4 | 2 | 1 | 6 | |
| M4 | 1 | 1 | 9 | 9 | |
| M5 | 30 | 16 | 16 | 3 | |
| 未分类 | 0 | 0 | 1 | 0 | |
| 患者性别(例,男/女) | 20/15 | 8/11 | 17/10 | 8/11 | |
| 供者性别(例,男/女) | 23/12 | 13/6 | 17/10 | 13/6 | |
| 移植类型(例) | |||||
| HLA相合 | 10 | 8 | 6 | 3 | |
| HLA不完全相合 | 25 | 11 | 21 | 16 | |
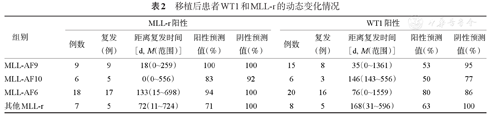
对100例接受造血干细胞移植的患者移植后的WT1和MLL-r的动态变化进行分析,结果见表2。MLL-AF9组,WT1预测复发的阳性和阴性预测值分别为53%和95%。26例患者的MLL-r持续阴性,未观察到复发。MLL-r预测复发的阳性和阴性预测值分别为100%和100%。7例WT1转阳(0.72%~1.4%)并且MLL-r阴性的患者,未出现复发。
移植后患者WT1和MLL-r的动态变化情况
移植后患者WT1和MLL-r的动态变化情况
| 组别 | MLL-r阳性 | WT1阳性 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 例数 | 复发(例) | 距离复发时间[d, M(范围)] | 阳性预测值(%) | 阴性预测值(%) | 例数 | 复发(例) | 距离复发时间[d, M(范围)] | 阳性预测值(%) | 阴性预测值(%) | |
| MLL-AF9 | 9 | 9 | 18(0~259) | 100 | 100 | 15 | 8 | 35(0~1361) | 53 | 95 |
| MLL-AF10 | 6 | 5 | 0(0~556) | 83 | 92 | 6 | 3 | 146(143~556) | 50 | 77 |
| MLL-AF6 | 18 | 17 | 133(15~698) | 94 | 100 | 20 | 16 | 76(0~1559) | 80 | 86 |
| 其他MLL-r | 7 | 5 | 72(11~724) | 71 | 100 | 8 | 5 | 168(31~596) | 63 | 100 |
MLL-AF10组,WT1预测复发的阳性和阴性预测值分别为50%和77%。13例患者MLL-r阴性,1例发生髓外复发,12例未复发。MLL-r预测复发的阳性和阴性预测值分别为83%和92%。2例WT1升高(0.75%~1.8%)并且MLL-r阴性,未复发。
MLL-AF6组,WT1预测复发的阳性和阴性预测值分别为80%和86%。9例患者的MLL-r持续阴性,且均未复发。MLL-r预测复发的阳性和阴性预测值分别为94%和100%。4例WT1升高(0.8%~2%)并且MLL-r阴性,未复发。
其他MLL-r组,WT1预测复发的阳性和阴性预测值分别为63%和100%。12例患者的MLL-r持续阴性,未观察到复发。MLL-r预测复发的阳性和阴性预测值分别为71%和100%。1例WT1升高(0.67%)并且MLL-r阴性,未复发。
对于100例整体伴MLL-r的AML患者,WT1预测复发的阳性和阴性预测值分别为65%和90%;MLL-r预测复发的阳性和阴性预测值分别90%和98%。四组患者移植后从WT1表达异常升高到复发的中位时间和MLL-r从转阳到复发的中位时间见表2。对同时间点的FCM分析显示:MLL-AF9组9例FCM+患者均复发,距复发中位时间为0(0~50)d;MLL-AF10组中6例FCM+患者中有4例复发,距复发中位时间为0(0~143)d;MLL-AF6组17例FCM+患者均复发,距复发中位时间为33(0~472)d;其他MLL-r组6例FCM+患者中有5例复发,距复发中位时间为40(0~692)d。
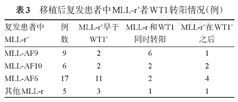
造血干细胞移植后复发患者中WT1+和MLL-r+的时间点见表3。大部分患者的MLL-r转阳时间点早于或与WT1同时转阳[早于或同时转阳比例,MLL-AF9:88.9%(8/9),MLL-AF10:66.7%(4/6),MLL-AF6:76.5%(13/17),其他MLL-r:80.0%(4/5)]。
移植后复发患者中MLL-r+者WT1转阳情况(例)
移植后复发患者中MLL-r+者WT1转阳情况(例)
| 复发患者中MLL-r+ | 例数 | MLL-r+早于WT1+ | MLL-r和WT1同时转阳 | MLL-r+在WT1+之后 |
|---|---|---|---|---|
| MLL-AF9 | 9 | 2 | 6 | 1 |
| MLL-AF10 | 6 | 2 | 2 | 2 |
| MLL-AF6 | 17 | 11 | 2 | 4 |
| 其他MLL-r | 5 | 3 | 1 | 1 |
MLL-AF9组9例移植后MRD阳性(MLL-r转阳)患者接受化疗、DLI或者干扰素治疗,其中7例MRD未转阴,后复发死亡;2例MRD转阴后存活。MLL-AF10组6例移植后MRD阳性患者接受干预治疗,其中4例未转阴,后复发死亡;2例转阴后存活。MLL-AF6组11例移植后MRD阳性患者接受干预治疗,皆未转阴,后复发死亡。对于其他MLL-r组,3例移植后MRD阳性患者接受干预治疗,皆未转阴,后复发死亡。
根据欧洲白血病网络小组(ELN)的危险分层,伴MLL融合基因重排的AML患者属于中高危人群[11]。伴MLL-r的AML患者因预后相对不良,符合条件的患者都应该建议进行HSCT,但是移植后复发的问题值得关注。目前MLL-r和WT1相比,哪个更适合作为MRD监测指标尚无定论,有必要对WT1作为对伴MLL-r的移植后AML的MRD标志的临床价值进行进一步探究。我们通过回顾分析得到了WT1在四种不同类型MLL-r中预测移植后复发的阳性预测值和阴性预测值,并将其与MLL-r的阳性预测值和阴性预测值进行了比较,WT1预测移植后复发的阳性预测值和阴性预测值均低于MLL-r,表明WT1在HSCT后MLL融合基因阳性AML MRD监测中的作用不够显著。
随后我们对allo-HSCT复发的患者WT1转阳与MLL-r转阳的时间点进行了分析,发现大部分患者的MLL-r转阳时间点早于或与WT1同时转阳。从MRD转阳时间角度上看,WT1监测伴MLL-r的AML患者移植后MRD的作用并不优于MLL-r。研究显示WT1预测AML移植后复发的特异性并非100%,并且WT1在预测AML移植后复发时的阈值也并不完全相同[1,12,13]。我们的研究结果表明部分单纯WT1移植后轻度或一过性升高的患者,融合基因阴性,也没有复发,提示WT1不够特异,可能有其他因素影响其表达。所以移植后如果单纯WT1轻度升高,而不伴MLL-r转阳,临床上可以观察,综合判断,避免过度干预带来的不良预后。
本研究入组病例较少,且为单中心、回顾性分析。期望未来有多中心、前瞻性临床试验针对此问题进一步探究,并能继续明确各种类型MLL-r融合基因随治疗的动力学变化,及与其他MRD指标的相关性。
综上,伴有MLL-r的AML中,WT1预测复发的阳性预测值和阴性预测值低于MLL-r,移植后MRD监测建议首选MLL-r,WT1基因可作为有益的参考指标。
所有作者声明无利益冲突


























