
探索在国人弥漫大B细胞淋巴瘤(DLBCL)中免疫组织化学染色(IHC)检测P53蛋白表达状态预测TP53基因突变风险的能力,以及P53表达差异的预后评估价值。
收集北京高博博仁医院2021年1月至2021年12月同时进行二代测序(NGS)和IHC检测的DLBCL病例51例,依据P53的IHC染色将P53蛋白表达状态分为缺失(<1%)、弥漫(>80%)和不均一(1%~80%)3组,将缺失及弥漫表达归为TP53突变高风险组;与NGS结果对比分析IHC预测TP53突变风险的敏感性和特异性。收集北京大学肿瘤医院2016年6月至2019年9月有完整随访资料的DLBCL患者131例,制作组织芯片并通过IHC检测P53表达,评估P53表达差异的预后价值。
51例同时行IHC和NGS检测的病例中,TP53突变高风险23例(7例缺失,16例弥漫),NGS证实22例存在TP53突变;TP53突变低风险组28例,仅1例证实有TP53突变。IHC预测TP53突变风险敏感性95.7%,特异性96.4%。NGS共检出26个TP53突变位点,等位基因突变频率为61.57%(13.41%~86.25%),P53弥漫组检出16个错义突变、2个剪切位点突变;缺失组检出6个截短突变、1个剪切位点突变;不均一组检出1个截短突变。纳入预后分析的131例DLBCL患者中,IHC显示29.0%(38/131)为TP53突变高风险(17例弥漫、21例缺失)。多因素分析显示TP53突变高风险(HR=2.612,95% CI 1.145~5.956,P=0.022)是影响总生存的独立危险因素。
IHC检测P53蛋白表达缺失(<1%)或弥漫(>80%)TP53突变风险高,IHC预测TP53突变的敏感性与特异性高,TP53突变高风险是预后不良的独立影响因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
弥漫大B细胞淋巴瘤(DLBCL)是最常见的淋巴瘤类型[1],生物学行为具有强异质性,肿瘤细胞起源(Cell of Origin,COO)分型是广泛认可的病理学预后指标[2]。利妥昔单抗和蒽环类药物的联合应用极大提高了DLBCL的疗效和预后[3,4,5],但复发难治病例仍高达40%[6]。我们既往对新的病理标志物如双重打击淋巴瘤进行研究[7]。近年TP53基因突变与DLBCL的预后相关性也越来越受到关注[8],TP53突变在DLBCL中检出率约20%[8],并在DLBCL分子分型中作为A53亚型分型的重要依据,具有一定的预后和治疗提示价值[9]。目前在卵巢癌等肿瘤中可通过免疫组织化学染色(IHC)显示P53表达状态(>80%为弥漫过表达,<1%为表达缺失)以提示TP53基因突变状态已得到较为广泛的认可[10,11]。尽管DLBCL中也存在P53蛋白"过表达"或"表达缺失"[12],但上述判断标准是否适用DLBCL尚不明确,部分研究以P53表达比例≥50%预测TP53突变,未涵盖P53表达缺失,亦未获得一致结论[3,6,8,13,14]。
因此,本研究收集了部分同时行TP53二代测序(NGS)和P53 IHC检测的病例,探索在DLBCL中IHC检测P53表达状态预测TP53基因突变状态的病理学评估标准及其可行性。并在此基础上收集了一组临床、病理及随访信息完整的初治DLBCL病例,分析P53表达差异对预后的影响,期待为国人DLBCL中P53评估提供一些依据。
1.收集2021年1月至2021年12月间北京高博博仁医院同时进行P53的IHC及靶向外显子(包含TP53)NGS检测的51例DLBCL患者,进行诊断试验。
2.收集北京大学肿瘤医院2016年6月至2019年9月间确诊的131例初治DLBCL患者,进行预后分析。纳入标准:(1)具有完整的临床和治疗信息;(2)存档组织标本符合制作组织芯片的要求。
所有病例依据2016年WHO淋巴造血系统肿瘤分类标准[1],经2名以上血液病理学专家复核诊断。
HE切片勾选石蜡标本肿瘤细胞丰富区域,使用法国Alphelys公司组织芯片仪制作组织芯片(每例均含2个直径1 mm的组织条,使用芯片仪自带程序标记对应位置)。
应用瑞士Roche公司BENCHMARK-XT自动免疫组织化学染色机完成,Ⅰ抗BCL2、BCL6、CD10、CD20、Mum1、P53均购自美国安捷伦DAKO公司;CD3ε、C-MYC、Ki67均购自北京中杉金桥生物技术有限公司,DAB显色。P53阳性对照使用卵巢癌阳性组织,其余为反应性增生的淋巴组织。阴性对照均为Ⅰ抗稀释液代替Ⅰ抗进行染色。
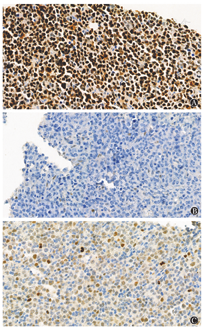
仅计数明确着色的肿瘤细胞在所有肿瘤细胞中占比。CD10、BCL6、MUM1≥30%为阳性[2]。BCL2≥50%为高表达,MYC≥40%为高表达[15]。P53表达状态分为缺失(<1%)、弥漫(>80%)以及不均一(1%~80%)(图1),缺失和弥漫表达归为TP53突变高风险组[10,11]。同时便于对比按P53是否≥50%分为高表达或低表达组[6]。

使用GeneRead DNA FFPE Kit(Qiagen公司,德国)分离提取FFPE样品DNA,进行定性定量检测。使用KAPA hyper plus试剂盒利用酶切方法完成预文库构建,预文库与定制的Kapa Hyper choice panel(NimbleGen,美国)进行杂交捕获,并对目标DNA片段进行富集扩增以生成gDNA文库。使用NextSeq 550测序系统(Illumina,美国)进行高通量测序(深度约2 500×)。使用BWA(0.7.15版)进行参考基因组比对,GATK(4.0.4版)和VarDict(2014版)软件检测单核苷酸变异和小片段插入缺失等,最终使用IGV浏览器人工审核,记录TP53突变。
参照2014年淋巴瘤Lugano分期及评效标准进行疗效评价。随访截止日期为2022年1月,总生存(OS)时间定义为从确诊至出现死亡或末次随访的时间间隔。无事件生存(EFS)时间定义为研究病例从确诊直至疾病出现进展、复发、死亡或末次随访的时间间隔。
本研究为回顾性研究,应用SPSS 22.0软件进行统计学分析。采用受试者工作特征曲线(ROC曲线)评价IHC预测TP53突变的敏感性及特异性。采用Cox等比例风险回归模型进行影响OS和EFS的单因素及多因素分析,单因素分析中P<0.1的变量纳入多因素分析,采用逐步法对纳入多因素模型的变量进行筛选并确定最终的危险因素。P<0.05为差异有统计学意义。
51例同时行IHC和NGS检测的病例中,TP53突变高风险组23例(弥漫组16例、缺失组7例),其中22例NGS检测存在TP53突变,仅1例弥漫组NGS未检出TP53突变;28例TP53突变低风险组,仅1例NGS检出TP53突变。以NGS检出TP53突变为"金标准",使用IHC突变高风险与低风险分组预测TP53突变风险敏感性是95.7%,特异性是96.4%;按P53≥50%阈值进行分组,预测TP53突变风险敏感性仅65.2%,特异性仅21.4%。
本组病例NGS共检出26个TP53突变位点,中位等位基因突变频率为61.57%(13.41%~86.25%),大部分突变(92.3%,24/26)分布在TP53 DNA结合域。P53弥漫组检出16个错义突变,2个剪切位点突变;缺失组检出6个截短突变,1个剪切位点突变;不均一组检出1个截短突变(图2)。
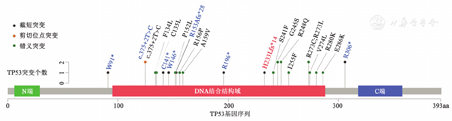

注 黑字为P53弥漫(>80%)组突变位点,蓝字为P53缺失(<1%)组突变位点,红字为P53不均一(1%~80%)组突变位点,*示终止密码子
纳入131例北京大学肿瘤医院有完整的临床及随访信息的DLBCL患者,中位年龄56(24~84)岁,其中>60岁44例(33.6%);男77例(58.8%);Ann Arbor Ⅲ~Ⅳ期67例(51.1%);有B症状(发热、盗汗、体重减轻)50例(38.2%);ECOG>1分10例(7.6%);30例(22.9%)结外侵犯部位>1个;68例(51.9%)血清LDH水平升高(>240 U/L);出现大包块者40例(30.5%);IPI 3~5分36例(27.5%)。同时出现MYC及BCL2蛋白双高表达(DEL)的共22例(16.8%)。全部病例均接受了CHOP方案(环磷酰胺+阿霉素+长春新碱+泼尼松)为主的标准化一线治疗,其中79例(60.3%)患者联合了利妥昔单抗治疗。疗效评估87例(66.4%)完全缓解(CR),17例(13.0%)部分缓解(PR),26例(19.8%)疾病进展(PD),1例(0.8%)未评价疗效。患者5年OS及EFS率分别为85.7%、52.5%。
131例患者中P53中位表达水平为17.5%(0~95.0%),其中弥漫组17例(13.0%)、缺失组21例(16.0%)、不均一组93例(71.0%),38例(29.0%)归为TP53突变高风险组。
单因素分析结果详见表1,Ann Arbor Ⅲ~Ⅳ期(P=0.005)、结外侵犯>1处(P=0.011)、血清LDH>240 U/L(P=0.053)、IPI 3~5分(P=0.005)、DEL(P=0.051)、TP53突变高风险(P=0.081)在0.1的水平上是影响OS的危险因素;Ann Arbor Ⅲ~Ⅳ期(P<0.001)、结外侵犯>1处(P<0.001)、血清LDH>240 U/L(P=0.018)、IPI 3~5分(P<0.001)、一线治疗未用利妥昔单抗(P=0.009)、DEL(P=0.010)是影响EFS的危险因素。将上述变量纳入多因素COX模型,通过逐步法进行变量筛选,最终结果显示Ann Arbor Ⅲ~Ⅳ期(HR=4.532,95% CI 1.659~12.381,P=0.003)、DEL(HR=2.528,95% CI 0.968~6.604,P=0.058)及TP53突变高风险(HR=2.612,95% CI 1.145~5.956,P=0.022)是影响OS的独立危险因素。Ann Arbor Ⅲ~Ⅳ期(HR=3.236,95% CI 1.761~5.948,P<0.001)、DEL(HR=2.012,95% CI 1.082~3.741,P=0.027)、血清LDH>240 U/L(HR=1.671,95% CI 0.920~3.037,P=0.092)及一线治疗未用利妥昔单抗(HR=2.799,95% CI 1.615~4.851,P<0.001)是影响EFS的独立危险因素。
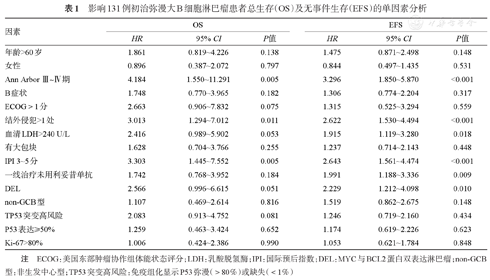
影响131例初治弥漫大B细胞淋巴瘤患者总生存(OS)及无事件生存(EFS)的单因素分析
影响131例初治弥漫大B细胞淋巴瘤患者总生存(OS)及无事件生存(EFS)的单因素分析
| 因素 | OS | EFS | ||||
|---|---|---|---|---|---|---|
| HR | 95% CI | P值 | HR | 95% CI | P值 | |
| 年龄>60岁 | 1.861 | 0.819~4.226 | 0.138 | 1.475 | 0.871~2.498 | 0.148 |
| 女性 | 0.896 | 0.387~2.072 | 0.797 | 0.844 | 0.497~1.435 | 0.531 |
| Ann Arbor Ⅲ~Ⅳ期 | 4.184 | 1.550~11.291 | 0.005 | 3.296 | 1.850~5.870 | <0.001 |
| B症状 | 1.748 | 0.770~3.965 | 0.182 | 1.306 | 0.774~2.204 | 0.317 |
| ECOG>1分 | 2.663 | 0.906~7.832 | 0.075 | 1.315 | 0.525~3.294 | 0.559 |
| 结外侵犯>1处 | 3.013 | 1.294~7.012 | 0.011 | 2.622 | 1.530~4.494 | <0.001 |
| 血清LDH>240 U/L | 2.416 | 0.989~5.902 | 0.053 | 1.915 | 1.119~3.280 | 0.018 |
| 有大包块 | 1.628 | 0.704~3.766 | 0.255 | 1.237 | 0.714~2.143 | 0.448 |
| IPI 3~5分 | 3.303 | 1.445~7.552 | 0.005 | 2.643 | 1.561~4.474 | <0.001 |
| 一线治疗未用利妥昔单抗 | 1.742 | 0.768~3.952 | 0.184 | 1.991 | 1.188~3.336 | 0.009 |
| DEL | 2.566 | 0.996~6.615 | 0.051 | 2.229 | 1.212~4.098 | 0.010 |
| non-GCB型 | 1.107 | 0.469~2.614 | 0.816 | 1.519 | 0.862~2.675 | 0.148 |
| TP53突变高风险 | 2.083 | 0.913~4.752 | 0.081 | 1.246 | 0.719~2.160 | 0.434 |
| P53表达≥50% | 1.259 | 0.463~3.424 | 0.652 | 1.174 | 0.619~2.226 | 0.623 |
| Ki-67>80% | 1.006 | 0.424~2.386 | 0.990 | 1.053 | 0.621~1.784 | 0.848 |
注 ECOG:美国东部肿瘤协作组体能状态评分;LDH:乳酸脱氢酶;IPI:国际预后指数;DEL:MYC与BCL2蛋白双表达淋巴瘤;non-GCB型:非生发中心型;TP53突变高风险:免疫组化显示P53弥漫(>80%)或缺失(<1%)
TP53基因是最早发现的抑癌基因之一,编码的P53蛋白可通过诱导细胞周期停滞、诱发细胞凋亡及修复DNA损伤等机制减少遗传不稳定性,在超半数实体瘤中存在TP53突变导致P53功能失活并提示预后不良,淋巴瘤中TP53突变发生率仅12.5%,在DLBCL中约20%,尽管发生率相对低,TP53突变在DLBCL的发生、进展及耐药中仍具有重要意义[8,16,17]。
由于TP53编码基因较长,突变位点具有不确定性,传统的Sanger测序可能会漏检,NGS检测虽更为准确,但费用高、耗时长且涉及生信分析,不易在日常工作中普及。研究发现TP53错义突变通常会导致突变的P53蛋白抗降解而在细胞核中积累,从而出现P53蛋白弥漫表达;提前终止突变和剪接位点突变则导致细胞中P53蛋白表达缺失[10]。因此使得IHC染色检测P53表达状态进而预测TP53基因突变状态成为可能,在卵巢癌和子宫内膜癌中IHC染色预测基因突变状态,具有100%的特异性和96%的敏感性[10,11]。但既往研究在DLBCL中通过IHC预测TP53突变及预后通常以50%为截断值,不同研究结论存在差异[6,12,13,14,17]。究其原因首先是采用50%截断值,将P53表达缺失纳入低风险组可能造成数据的偏差;其次研究大多使用一代测序检测TP53突变,可能存在漏检;同时IHC染色可能使用手工染色或者不同的自动化染色系统,标准化及可重复性较差;再加上文献中对病理医师判读P53染色强度没有明确要求,加重了判读结果不一致性。我们尝试参照妇科肿瘤中的标准,将P53表达弥漫(比例>80%)和缺失(<1%)作为提示TP53突变高风险的标准模式。初步证实IHC在DLBCL中亦可以较好地预测TP53突变风险,敏感性和特异性均>95%,接近妇科肿瘤研究结果;同时结果显示P53弥漫组绝大部分属于错义突变;P53缺失组绝大部分属于截短突变,突变类型与蛋白表达相关性也基本一致[8,10]。个别不一致的病例可能受到如IHC和NGS检测方法敏感性、肿瘤转录后调控等影响[8]。因此采取与妇科肿瘤一致以肿瘤细胞>80%强表达为截断值,可以更好地提高阅片的一致性。
单因素生存分析证实Ann Arbor Ⅲ~Ⅳ期、结外侵犯、LDH升高、IPI 3~5分及伴有DEL均为影响OS和EFS的危险因素,与其他文献报道基本一致[15,18,19]。本组病例绝大部分治疗方案含利妥昔单抗,导致COO分型失去预测价值[4]。多因素分析与既往报道一致[18,20],进一步证实伴有DEL和Ann Arbor Ⅲ~Ⅳ期是影响国人DLBCL的OS和EFS的独立危险因素,TP53突变高风险是OS独立危险因素,利妥昔单抗时代DEL是比COO分型更强的病理预后指标[15,18]。
另一个有意义的发现是通过NGS和IHC结果对比进一步确认了DLBCL中TP53突变会导致P53表达缺失(<1%);我们还初步证实P53表达缺失组预后较差,因此本研究进一步丰富和完善了DLBCL中IHC预测TP53突变和预后的研究数据和结论。
总之,本研究结果证实P53的IHC染色表达弥漫(>80%)和缺失(<1%)可以较为准确预测DLBCL的TP53突变高风险,且TP53突变高风险是OS的独立危险因素。本研究使用的P53 IHC判读标准具有一定的可行性,有利于针对性发现TP53突变、评估预后及开展靶向治疗[9,21],最终改善生存。由于本研究为回顾性研究,样本量有限且DEL病例数较低,结论有待进一步前瞻性、大样本研究验证。
所有作者声明不存在利益冲突



























