
蛋白C是一种维生素K依赖性丝氨酸蛋白酶,是抗血栓形成调节系统的核心组成部分,具有抗凝和纤溶特性。蛋白C在体内以酶原形式存在,在内皮细胞表面凝血酶-血栓调节蛋白复合物的作用下激活成活化蛋C(APC)[1],在蛋白S辅助下,通过灭活活化的凝血因子V和凝血因子Ⅷ来抑制凝血酶的产生,发挥抗凝作用,主要作用部位在微循环[2]。遗传性蛋白C缺陷症以反复弥散性血管内凝血和出血性皮肤坏死为主要表现,可伴有多器官出血或血栓形成。1981年Griffin等[2]首次报告,编码蛋白C的PROC基因发生突变可导致蛋白C含量和(或)功能异常,导致血栓性出血性疾病。现报告我院收治的2例遗传性蛋白C缺陷症致新生儿暴发性紫癜患者,旨在提高对该病的临床及基因诊断的认识。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
蛋白C是一种维生素K依赖性丝氨酸蛋白酶,是抗血栓形成调节系统的核心组成部分,具有抗凝和纤溶特性。蛋白C在体内以酶原形式存在,在内皮细胞表面凝血酶-血栓调节蛋白复合物的作用下激活成活化蛋C(APC)[1],在蛋白S辅助下,通过灭活活化的凝血因子V和凝血因子Ⅷ来抑制凝血酶的产生,发挥抗凝作用,主要作用部位在微循环[2]。遗传性蛋白C缺陷症以反复弥散性血管内凝血和出血性皮肤坏死为主要表现,可伴有多器官出血或血栓形成。1981年Griffin等[2]首次报告,编码蛋白C的PROC基因发生突变可导致蛋白C含量和(或)功能异常,导致血栓性出血性疾病。现报告我院收治的2例遗传性蛋白C缺陷症致新生儿暴发性紫癜患者,旨在提高对该病的临床及基因诊断的认识。
例1,男,5日龄,因"发现腹部及足底瘀斑2 d"入院,系孕37周剖宫产娩出,羊水清,无窒息抢救史,胎盘未见异常,出生体重2850 g。患儿生后第3天家长发现左侧足底和右侧下腹部不规则瘀斑,生后第5天瘀斑加重,且睾丸部位出现瘀斑,入院前急诊B超提示左侧睾丸实质内未见明确彩色血流信号(不排除左侧睾丸部分坏死可能),收治泌尿外科拟手术治疗,外科医师查视患儿排除睾丸扭转,为进一步查明病因转入我科。家族史:父母及4岁姐姐体健,异卵双胞胎妹妹无类似表现;否认家族成员有中紫癜及深静脉血栓病史。入科时查体:生命体征平稳,右侧下腹部可见大小约3 cm×6 cm不规则瘀斑,周围伴红肿,部分皮肤破溃,伴少许渗液,部分皮肤表面黑色痂覆盖,左足底有一2 cm×1 cm瘀斑,双侧阴囊肿胀,阴茎及左侧阴囊皮肤颜色变黑,肢端皮温正常,双足背动脉可触及搏动。辅助检查:血常规示WBC 18.3×109/L、HGB 150 g/L、PLT 84×109/L、中性粒细胞66%;C反应蛋白(CRP)6.6 mg/L(参考值0~8.0 mg/L),降钙素原300 ng/L(参考值<200 ng/L);凝血功能提示凝血酶原时间(PT)14.4 s(参考值10~14 s),活化部分凝血活酶时间(APTT)86.3 s(参考值23~40 s),纤维蛋白原(FIB)1.440 g/L(参考值1.80~4.00 g/L),凝血酶时间(TT)15.9 s(参考值14~21 s),D-二聚体33.34 mg/L(参考值0~0.5 mg/L);血气、电解质、肝功能、肾功能、心肌酶谱、血糖正常,疱液分泌物涂片+培养、双份血培养无细菌生长。会阴部B超提示左侧睾丸实质回声明显降低,考虑左侧睾丸坏死,睾丸部分实质回声不均,双侧睾丸鞘膜积液,双侧阴囊壁肿胀。肝胆胰脾及肾上腺B超均未见异常。眼部B超提示右侧玻璃体占位,右视网膜部分脱离,右眼视乳头缺损可能;眼眶磁共振检查示右侧眼玻璃体内异常信号(考虑视网膜病伴出血可能),右视网膜脱离。皮肤软组织B超提示左侧枕部及右膝部软组织明显增厚;头颅CT脑实质无异常,双侧顶部、左侧颞顶枕部皮肤软组织肿胀。
例2,男,7日龄,因"发现后背部及双侧大腿皮肤红肿坏死2 d"入院。患儿为弃婴,出生史及家族史不详。收住新生儿外科,予万古霉素联合美罗培南抗感染,患儿皮肤瘀斑及硬肿范围进一步扩大,转入我科。入科时查体:生命体征平稳,体温37.8 ℃,左额部及顶枕部皮肤可见大片瘀斑,心肺腹未见异常,双侧腹股沟、骶髂部、双侧大腿及左下肢皮肤可见大片状瘀斑,其上可见血疱,阴阜、阴囊及臀部硬肿,触痛明显,肢端皮温正常,双足背动脉可触及搏动。辅助检查:血常规示WBC 29.49×109/L、HGB 124 g/L、PLT 73×109/L、中性粒细胞74.2%;CRP 7.9 mg/L,降钙素原760 ng/L;凝血功能:PT 14.9 s,APTT 57.2 s,FIB 1.16 g/L,TT 13.9 s,D-二聚体80 mg/L;血气、电解质、肝功能、肾功能、心肌酶谱、血糖正常。疱液分泌物涂片+培养、血培养无细菌生长。头颅CT提示脑室系统稍扩张,周围白质区范围增广,透明隔间腔稍宽;两顶部头皮血肿;腹部增强CT提示胸腹部弥漫肿胀;双侧肾盂饱满;双侧睾丸密度不均,阴囊内低密度影。磁共振:双侧大脑半球白质区广泛异常信号,考虑广泛软化伴少许出血可能。幕上脑室扩张,四脑室饱满,透明隔间腔存在,小脑脑沟增深;磁共振血管成像(MRA)提示Wilis环显示中断、双侧大脑前中动脉远端显示不清,大脑后动脉全段显示不清;磁共振静脉成像(MRV)深静脉系统显示不清。
例1和例2患儿入院后给予积极抗感染、输注冷沉淀及凝血酶原复合物补充凝血因子,免疫球蛋白加强支持治疗,同时给予每12 h 1次输注新鲜冰冻血浆(10 ml/kg)和低分子肝素钠(100 IU/kg)皮下注射抗凝,加强皮肤护理等对症支持治疗。两例患儿经治疗后血小板均上升至正常范围,但皮肤瘀斑较前加重,复查凝血功能D-二聚体有所下降,停止新鲜冰冻血浆输注后迅速升高。例1入院第8天测蛋白C活性为0%,抗原为13.1%,蛋白S活性为119.3%,第12天家长放弃治疗出院,3 d后死亡。例2入院后第4天测蛋白C活性为2%,蛋白C抗原为15.6%,蛋白S活性为70.8%,给予持续补充新鲜冰冻血浆及抗凝治疗,患儿终因弥散性血管内凝血而死亡。
例1检出PROC基因c.1032(exon9)C>G和c.400+5G>A 2个突变位点,验证父母均为杂合子突变,姐姐正常,异卵双胞胎妹妹为单杂合子突变(图1、图2)。例2检出PROC基因c.1310(exon9)A>C、c.181(exon3)delG 2个突变位点(图3、图4),未进行家系验证(患儿为弃婴)。以上4个PROC基因突变位点除c.400+5G>A外,均为首次报道。
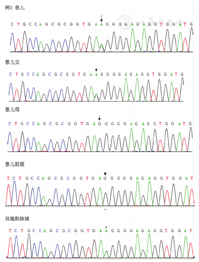

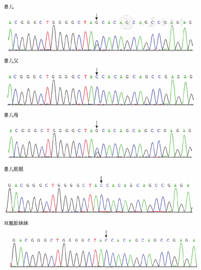





PROC基因定位于2q13-14,由9个外显子和8个内含子组成,根据遗传方式的不同分为杂合和纯合变异,杂合型蛋白C缺陷症多见,好发于30~40岁成人。根据蛋白C活性和抗原的检测结果分为Ⅰ型和Ⅱ型。前者由于蛋白C合成减少或功能正常的分子稳定性降低导致蛋白C活性和抗原平行降低;后者由于异常蛋白C分子合成导致蛋白C活性降低而抗原正常[3,4]。本组2例患儿蛋白C活性和抗原平行下降,为Ⅰ型遗传性蛋白C缺陷。
人群中无症状杂合蛋白C缺陷症的发病率为1/200~1/500,有症状杂合蛋白C缺陷症的发病率为1/16万~1/32万[5],多在成年发病,临床上可引起反复深静脉血栓,患者血浆水平呈轻度下降,为正常人的30%~60%[6]。只有极少数患者是由纯合或更少见的复合杂合突变引起的严重蛋白C缺陷,血浆中蛋白C含量极度降低,大部分患者在婴儿时期即发生暴发性紫癜,发病率约为1/50万~1/75万[7],患者出生后不久就会在微循环系统形成广泛血栓,多因严重脑损伤、多器官功能衰竭而死亡[5]。有研究显示PROC基因变异与暴发性紫癜相关,日本一项27例有蛋白C缺陷症的儿童回顾性研究显示,有16例表现为暴发性紫癜,9例患者存在PROC基因变异,提示PROC基因变异与暴发性紫癜密切相关[8]。本组两例患儿均在新生儿期发病,蛋白C活性极低,发生暴发性紫癜及广泛微循环血栓形成,患儿转归情况亦符合既往报道,经加深WES检测发现了4个PROC基因变异位点,其中3个为新发基因变异位点,目前尚未见报道。例1为PROC基因复合杂合突变c.1032(exon9)C>G和c.400+5G>A导致蛋白C缺陷,但其胞妹携带单点变异且无相关临床表现,符合常染色体隐性遗传方式。例2未进行家系基因分析,不能确定其遗传方式。
蛋白C缺陷症所致的广泛微血栓形成目前尚无有效根治方法,在国际上,主张联合应用蛋白C替代治疗及抗凝药物治疗[9]。蛋白C替代物主要包括新鲜冰冻血浆和蛋白C浓缩物,在蛋白C严重缺乏的患儿中,所需血浆用量大,且蛋白C半衰期短,停止血浆输注后症状仍会持续加重,在新生儿患者中大量新鲜冰冻血浆的输注可能导致液体过负荷、肺水肿及蛋白尿形成,且反复多次地输注不同供者的血浆不但增加传播病毒性疾病的风险,同时也增加了输注相关的过敏反应的概率[10]。
蛋白C浓缩物是从人体血浆中提取的并经高度纯化得到,进行病毒灭活,具有良好的有效性及安全性。一项多中心研究[11]显示蛋白C浓缩物治疗暴发性紫癜和急性血栓形成有效率高达95%,且无明显不良反应,经治疗后所有患者的D-二聚体迅速下降。临床研究证实蛋白C浓缩物对严重先天性蛋白C缺乏症的治疗效果优于新鲜冰冻血浆和其他抗凝血药物[12]。而在日本的27例患儿中,18例接受蛋白C浓缩物的治疗,其中2例因感染而死亡,而幸存者中8例遗留神经系统后遗症[8],蛋白C浓缩物目前在中国尚未上市。
儿童蛋白C缺陷中常用的抗凝药物为低分子肝素及华法林。低分子肝素需静脉用药,且易发生肝素诱导的血小板减少症。华法林治疗过程中需监测凝血功能,使其在儿童中的应用受限。有研究指出直接口服抗凝药物可能成为治疗儿童蛋白C缺陷引起深静脉血栓形成的新手段[13]。我们所报道的2例患儿应用新鲜冰冻血浆联合低分子肝素钠抗凝,却没有起到预期效果,仍有反复血栓形成,分析原因可能与血浆蛋白C含量严重缺乏相关。
肝移植是一种成熟的治疗先天性严重蛋白C缺陷的方法,与终身输注蛋白C浓缩物相比,具有明显的经济优势,且避免了复发性凝血功能紊乱及器官脏器出血和血栓形成的风险。在国外,儿童肝移植大多数具有良好的长期生存率[14,15]。国内目前没有本病进行肝移植的相关报道。
PROC基因缺陷患者是否出现临床症状是由环境因素(妊娠、外伤、服用避孕药、长期制动等)与基因突变共同作用的结果[16]。对于蛋白C缺陷患者来说,避免使用避孕药、防止各种创伤的发生是预防深静脉血栓形成的重要措施,对于长期卧床的患者应鼓励床边康复、适度进行肌肉训练。
所有作者声明无利益冲突


























