
多发性骨髓瘤(MM)是一种以克隆性浆细胞恶性增殖为特征的疾病,发病率在血液系统恶性肿瘤中排名第二位,目前仍无法治愈[1]。近年来,随着免疫调节药物、蛋白酶体抑制剂、CD38单抗等新药及自体造血干细胞移植(ASCT)技术的应用,MM的完全缓解(CR)率不断提高,但几乎所有病例仍会复发[2,3,4,5]。2016年,国际骨髓瘤工作组(IMWG)将微小残留病(MRD)列入疗效评估[6]。MRD是治疗后或治疗期间持续存在少数恶性细胞的状态,被认为是复发的根源,故亟需更敏感的检测技术评估深层缓解程度。目前MRD检测技术主要包括二代流式细胞术(NGF)、二代测序(NGS)、等位基因特异性寡核苷酸聚合酶链反应技术(ASO-PCR)、体液活检及影像学技术等。这些技术各有其优点和局限性,尚无统一的检测方法与评价标准。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多发性骨髓瘤(MM)是一种以克隆性浆细胞恶性增殖为特征的疾病,发病率在血液系统恶性肿瘤中排名第二位,目前仍无法治愈[1]。近年来,随着免疫调节药物、蛋白酶体抑制剂、CD38单抗等新药及自体造血干细胞移植(ASCT)技术的应用,MM的完全缓解(CR)率不断提高,但几乎所有病例仍会复发[2,3,4,5]。2016年,国际骨髓瘤工作组(IMWG)将微小残留病(MRD)列入疗效评估[6]。MRD是治疗后或治疗期间持续存在少数恶性细胞的状态,被认为是复发的根源,故亟需更敏感的检测技术评估深层缓解程度。目前MRD检测技术主要包括二代流式细胞术(NGF)、二代测序(NGS)、等位基因特异性寡核苷酸聚合酶链反应技术(ASO-PCR)、体液活检及影像学技术等。这些技术各有其优点和局限性,尚无统一的检测方法与评价标准。
本研究中我们应用NGF及NGS方法动态监测同一患者的骨髓MRD情况,统计分析最低检测线(limit of detection,LOD)及肿瘤负荷(tumor load,TL),在保证两种方法LOD达到1.0×10-5的基础上定义MRD阴性,并进行MRD结果的逐步统计分析,证实其对深度缓解的评估作用,分析比较两种方法的一致性及在检出率上的差异,同时探索MRD检测对患者生存的预测。
本中心的一项VRD登记性研究纳入苏州大学附属第一医院自2019年9月1日至2022年1月31日收治的82例初诊MM患者,在治疗过程中同时采用NGF及NGS方法检测患者骨髓MRD情况。MM诊断、分期标准及疗效评估参照2020年修订版中国多发性骨髓瘤诊治指南[7]。监测的时间点为诱导治疗后、移植/巩固治疗后,维持治疗期间每半年进行一次。
取MM患者的新鲜骨髓标本(24~48 h),选取骨髓涂片后的第一管骨髓液(3~5 ml)。抗体包括CD138-APC、CD38-APC750、CD45-KO、CD19-ECD、CD56-PC7、CD27-PB、CD81-APC700、CD117-PC5 8种膜抗体以及Kappa-FITC、Lambda-PE两种胞质抗体(Kappa-FITC和Lambda-PE购自丹麦Dako公司,膜抗体购自美国Beckman Coulter公司)[8]。
先确定初诊MM患者全骨髓细胞中肿瘤浆细胞免疫球蛋白克隆性重排(美国Invivoscribe公司的LymphoTrack检测试剂盒),包括IGH和(或)IGK基因克隆性重排的类型和序列。在患者后续的随访标本中,以诊断时检测到的克隆性重排序列作为其分子标志来进行MRD监测[9]。
随访时间截至2022年1月31日。中位随访时间为14(5~29)个月。通过查阅住院病历、门诊病历及电话进行随访。对于随访期间死亡的病例,通过病历记录和(或)与患者家属电话联系确认。总生存(OS)时间定义为自确诊之日至末次随访或死亡的时间。无进展生存(PFS)时间定义为自确诊之日至疾病发生进展或死亡的时间。
采用SPSS 26.0软件及GraphPad Prism 9.0进行统计学分析。计数资料用例数(百分比)表示,计量资料用中位数(范围)表示。均数的比较采用成组两样本秩和检验和方差分析的双侧检验,率的比较采用Fisher确切概率法;两项数据的一致性检验采用Kappa系数,定量数据的相关性分析采用Pearson积矩相关系数。采用Kaplan-Meier法绘制生存曲线,Log-rank检验用于估计单个危险因素的生存差异,P<0.05为差异有统计学意义。
共有82例同时进行NGF-MRD及NGS-MRD检测的MM患者纳入最终分析,诱导治疗后疗效达到非常好的部分缓解(VGPR)以上者71例(86.59%),疗效达CR及严格意义的CR(sCR)患者44例(53.66%),移植或非移植患者完成VRD方案治疗(共63例)后疗效达VGPR以上者59例(93.65%),达CR+sCR者41例(65.08%)。
从样本采集到系统输出均影响MRD的测定,其结果高度依赖于样本的质量及浓度[10,11,12,13]。统计82例患者诱导治疗后用于NGF-MRD及NGS-MRD检测的细胞总数,分别统计两种检测方法的中位LOD值和中位TL(图1)。本研究中,将在1.0×10-5水平未检测到肿瘤细胞定义为NGF-MRD阴性或NGS-MRD阴性。去除3例未达标的NGS标本,分析在同一检测标准下检测到的MRD结果,42例NGF-MRD阳性,64例NGS-MRD阳性,应用NGS方法检测出的MRD阳性率较应用NGF方法更高(81.01%对51.22%)。其中,将MRD阴性标本的LOD值视为TL纳入研究,NGS较NGF能检测出更高的TL(中位TL:2.440×10-3对1.155×10-5,P<0.001)。
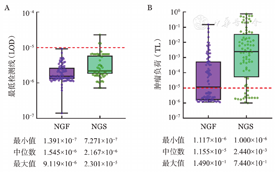

在应用NGS检测MRD时,按照每个细胞提取6.5 pg DNA计算
分析82例患者在传统IMWG疗效标准评估下的MRD状况,疗效在VGPR以下的患者无论应用NGF还是NGS检测,MRD结果均为阳性。8例(29.63%)疗效为VGPR的患者NGF-MRD为阴性,CR以上患者NGF-MRD阴性率则达到75%。疗效为VGPR的患者NGS-MRD阴性率为3.85%,CR以上的患者NGS-MRD阴性率为32.56%。当疗效达到VGPR以上再进行MRD检测似乎更为合理[13,14,15,16]。随着疗效的不断加深,MRD阳性率逐渐降低,中位TL逐渐减低,疗效为疾病进展(PD)的患者TL最高,而疗效达到CR的患者中位TL值最低(图2)。MRD不仅能精准地呈现不同疗效水平患者TL的差距(P=0.002),同时也能在一定程度上说明同一疗效水平患者TL不同,总之,MRD反映更深层次的缓解。
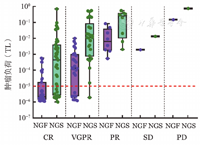

NGF:二代流式细胞术;NGS:二代测序;CR:完全缓解;VGPR:非常好的部分缓解;PR:部分缓解;SD:疾病稳定;PD:疾病进展
将NGF-MRD与NGS-MRD结果进行配对统计学分析,就MRD的检出率而言,对于疗效为VGPR、CR及sCR的患者,NGS-MRD的阳性检出率较NGF-MRD更高(VGPR:96.15%对70.37%;CR及sCR:68.18%对25.00%)。同样,在TL的检测方面,NGS较NGF能检测到更高的TL,不同疗效的中位TL如下:部分缓解(PR):2.505×10-1对6.400×10-3,P=0.002;VGPR:1.120×10-2对1.350×10-4,P=0.005;CR及sCR:4.410×10-4对2.153×10-6,P=0.023,差异均有统计学意义。
去除LOD值未达到1.0×10-5的3例患者,对疗效达到VGPR及以上的69例患者MRD结果进行配对分析,15例(21.74%)患者骨髓NGF-MRD与NGS-MRD均为阴性,29例(42.03%)患者两种检测方法均为阳性。在MRD定性方面,两种方法的一致率为63.77%,与国外结果(68.00%)相似[17]。两种检测方法结果不一致之处为:25例(36.23%)患者NGS检测MRD为阳性,但应用NGF检测为阴性,不存在NGF-MRD阳性而NGS-MRD阴性的情况。应用Fisher确切法比较两种方法是否具有一致性,结果表明P<0.001,两种方法结果一致,差异有统计学意义。但Kappa=3.728,一致性较差。
除去LOD值未达到1.0×10-5的3例患者,对疗效达到VGPR以上且MRD阳性的54例患者进一步行配对分析比较两种方法TL的差异,相关系数r=0.4371(54例,P=0.001)(图3)。综上,两种方法在MRD结果定性及TL定量方面均有一定的相关性。


对79例LOD值达到1.0×10-5的患者进行生存分析,中位随访时间为14个月,共6例患者进展,2例患者死亡,中位PFS时间及OS时间均未达到。根据诱导结束后的疗效将79例患者分为CR及sCR、VGPR和PR及以下3个组别,三组患者的中位PFS时间分别为未达到、未达到和17个月(P<0.001),中位OS时间均未达到(P=0.535)(图4)。2例死亡患者中1例死于肺部感染,另1例死于疾病进展。


CR:完全缓解;sCR:严格意义的完全缓解;VGPR:非常好的部分缓解;PR:部分缓解
将疗效CR+sCR组和VGPR组单独进行比较,24个月PFS率分别为94.06%和85.12%,差异无统计学意义(P=0.413)。根据MRD结果对LOD值达到1.0×10-5且疗效达到VGPR及以上的69例患者进行分组,中位随访时间15个月,4例进展,2例死亡。所有MRD阴性患者均未进展或死亡。在应用NGF方法检测时,MRD阴性组的PFS时间较阳性组延长(P=0.008),应用NGS检测时,MRD阳性组与阴性组PFS时间的差异无统计学意义(P=0.234)(图5)。两种方法OS的差异均无统计学意义(P值均>0.05)。
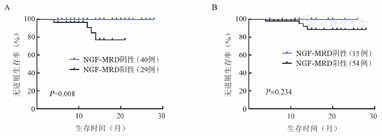

NGF:二代流式细胞术;NGS:二代测序;MRD:微小残留病
根据69例传统疗效达到VGPR及以上患者的MRD结果进行分组,共分为四组:NGF-MRD阴性且NGS-MRD阴性组(15例),NGF-MRD阴性且NGS-MRD阳性组(25例),NGF-MRD阳性且NGS-MRD阴性组(0例),NGF-MRD阳性且NGS-MRD阳性组(29例)。所有进展及死亡患者均为NGF-MRD阳性且NGS-MRD阳性。各组PFS的差异有统计学意义(P=0.029),OS的差异无统计学意义(P=0.162)。
MM治疗的CR率不断提高,经过治疗达到CR的患者预后仍然不同,即便之后提出了sCR的概念,仍不能很好地解释CR患者结局的差异性。2016年,国际骨髓瘤工作组(IMWG)将MRD列入疗效评估[6]。但由于利用不同的技术、研究设计、统计标准,在MM临床试验中评估和报告MRD的方式存在显著差异,这种差异为数据解释、后续研究的设计和定量荟萃分析带来了挑战。因此多个指南及共识推荐在进行MM-MRD的分析时,必须以标准化的方式定义、评估和报告,特别是LOD、MRD阴性的界定等。
本研究以1.0×10-5为LOD值,100%的NGF标本及96.34%的NGS标本达到此标准。随着疗效反应的加深,两种方法检测的MRD阳性率逐步下降。疗效为PD、疾病稳定、PR的患者NGS-MRD及NGF-MRD结果皆为阳性,说明我们在进行MRD的评估时要求疗效达到VGPR及以上。诱导治疗后应用NGF检测,疗效达到VGPR以上的患者MRD阳性率为42.25%。Kriegsmann等[17]的研究数据显示,应用NGF检测,疗效达到VGPR以上的MRD阳性患者占42.02%,Flores-Montero等[18]的研究数据为47.00%。应用NGS方法检测,疗效达到CR以上患者的MRD阳性率为67.44%。GRIFFIN临床研究结果表明,VRD组疗效达CR及以上的患者NGS-MRD阳性率为67.80%[19]。本研究结果同时也反映,随着疗效的不断加深,MRD不仅能精准地呈现不同疗效水平上的TL差距,同时也能在一定程度上说明同一疗效水平的患者TL可能不同。就MRD的检出率而言,NGS的MRD阳性检出率更高,在TL的检测方面,应用NGS可检测到更多的肿瘤细胞数量。将NGF-MRD与NGS-MRD结果进行配对分析,显示两种方法在MRD结果定性及TL定量方面有一定的相关性。42.03%的患者两种检测方法均为阳性。21.74%均为阴性,总的一致率为63.77%,与国外结果相似[17,20]。Medina等[21]的研究认为两者的一致性可达到85.8%,但该研究NGF的LOD值达2×10-6水平,NGS的LOD值为10-5水平。在CASSIOPEIA试验中,两种方法的总体一致率为83.5%,但该研究并未标注LOD值[22]。在生存分析中,NGF-MRD阳性预示更短的PFS时间、早期复发。NGF和NGS检测MRD阴性预测2年PFS率100%。由于本研究随访时间较短,仅对诱导治疗后MRD结果进行分析,后期我们将对这些患者继续随访,探讨不同监测时间点的MRD阳性率及MRD水平对患者OS的影响。
NGF和NGS为两种常用的检测骨髓中MRD的技术,两种技术各有其优点及局限性。NGF检测MRD所需的骨髓标本量较多,且必须为新鲜标本,需在24~48 h内评估,但其有适用性广、检测迅速、简便等优点。NGS检测MRD所需的骨髓标本量少,可检测保存时间较长的标本,有利于回顾性分析,但该技术仅适用于90%的患者,且需要与基线标本进行对比[23,24,25],具有检测周期长、检测费用高等局限性,具备该技术的实验室也较少[26,27]。由于NGS较NGF有更高的敏感性,本研究将继续延长随访时间,观察MRD检测结果对PFS的影响。
由于MRD检测在MM的疗效评估、预后判断、复发预测、治疗指导等方面具有重要意义,为提高检测结果的稳定性、可比性及可信度,亟需制定检测技术的统一标准。
所有作者声明无利益冲突


























