
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
感染性骨不连、骨缺损是创伤骨科的严重并发症,控制感染与骨重建是骨科医生共同面临的难题。近年来膜诱导技术(inducedmembranetechnique, IMT)的临床应用,使得感染性骨不连、骨缺损在治疗上取得较大突破[1,2],主要体现在有效的感染控制和快速骨重建两方面[3]。一些特殊部位采用膜诱导技术治疗成功的报道,如股骨大段骨缺损重建[4]、关节周围骨缺损重建[5]和前臂骨缺损重建[6],使得越来越多的临床骨科医生开始关注膜诱导技术[7]。
膜诱导技术最开始应用于非感染性骨缺损的重建,在感染性骨不连、骨缺损及骨缺损病例中报道较少[8,9]。个别手术医生因忽略控制骨感染的基本原理和某些手术细节引起较多的并发症[10]。本文旨在阐述膜诱导技术进行感染性骨不连、骨缺损重建的手术细节和注意事项,供临床医生共同讨论学习。
膜诱导技术的适应证主要包括因肿瘤、创伤、感染引起的四肢长骨骨缺损,同时跟骨与趾(指)骨骨缺损也可应用。
在临床应用中并未发现膜诱导技术严格的手术禁忌证,但在一些极端条件下使用会影响手术疗效,如急性感染伴全身症状者,应用膜诱导重建后感染极易复发。自体骨来源缺乏的老人可以考虑只完成一期手术,永久使用骨水泥假体,而儿童则可以考虑体外构建组织工程骨。伴有软组织缺损或供血障碍的骨缺损,以及免疫缺陷疾病者,如系统性红斑狼疮、免疫性肾病、艾滋病等,需要在恢复软组织缺损和免疫性疾病获得控制以后进行手术。因此,膜诱导技术的相对手术禁忌证:①伴全身症状的急性骨髓炎;②伴有软组织缺损或血供障碍的骨缺损;③自体骨缺乏的成年患者;④未获得控制的免疫缺陷疾病患者。
许多感染性骨不连、骨缺损均为慢性感染,因此术前应认真评估并根据患者的意愿制定个体化的治疗方案[11]。反复的感染病程,使得许多患者都存在不同程度的烦躁和焦虑。值得注意的是,并不是所有骨感染均需要进行重建,可能只需要解决其中的某个关键问题,如恶臭、流脓、局部反复疼痛。有些自身免疫缺陷性疾病或软组织条件糟糕的患者,即使多次手术依然面临巨大的失败风险,术前需对手术的必要性进行反复沟通。对于感染局限的患者可能只需要一次清创手术,而对于耐药菌感染或伴有糖尿病的患者可能需要反复多次清创才能有效控制感染。
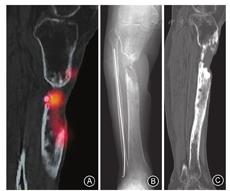
术前辅助检查是准确定位病灶的关键。常规的X线检查只能反映骨折愈合、内固定状态以及死骨的大致位置,并不能反映病灶的位置。CT可以更加细致地反映死骨片位置和病灶与周围骨组织的毗邻关系,结合核素骨显像与MR检查可以划定出病灶的大致范围。MR检查虽能准确反映髓腔内病灶波及的范围和软组织受累程度,但在合并内固定物时会出现较多的伪影,故无法作为一种常规的手段开展。近年来,核素骨显像检查在诊断骨科感染方面有很多应用,其敏感度较高,能大致判断病灶范围(图1A),但由于其特异性不高易发生误判[12],因而需要与X线(图1B)和CT(图1C)结果相结合,以在术前准确定位病灶中发挥各自优势,从而避免术中的盲目性。

除常规的拉钩、骨刀、刮匙、电钻等骨科器械外,在一期手术过程中会使用到一些清创辅助工具。辅助工具的使用可以扩大清创的范围,避免遗留死角。如使用软杆扩髓系统可增大扩髓的长度及范围;完成清创前使用磨钻对骨质继续磨除3~5 mm,并使用低压脉冲反复冲洗两次以上,有利于清除隐匿病灶及浮游细菌,减少术后复发。值得注意的是,在每次清创结束后,需要重新消毒铺单,更换或消毒手术器械,手术人员更换手术衣及手套,避免术区污染。
患者根据切口及暴露情况选择合适体位,并尽可能使用止血带,使视野清晰。肢体根部结扎止血后,常规消毒铺巾。以病灶中心位置作为手术切口,既要尽可能完全清除病灶,又要避免过多损伤周围组织。
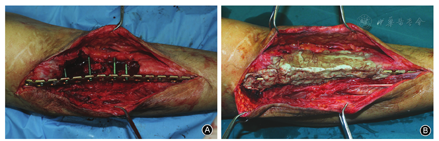
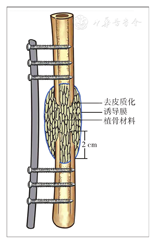
一般选择创伤骨科常规简单切口切开,如有原切口则可沿原切口切开。有窦道者需先梭形切除窦道及周围皮肤,由浅入深切除坏死及失活皮下周围软组织,暴露深部骨组织或内固定材料。去除内固定后,清理螺钉孔和内固定周围肉芽组织。根据术前病灶定位,可以选用电钻钻孔槽形或椭圆形开窗,或者节段切除病灶骨质,使用刮匙清理髓腔内死骨与肉芽组织,软杆扩髓器进一步清理髓腔,直至骨折端见"点状出血征"。根据需要术中留取标本做微生物学或病理学检查,并以双氧水及碘伏消毒,同时使用脉冲冲洗工具清洗术区。然后使用骨刀或磨钻等工具继续沿骨质表面去除边界骨质5 mm,并按"地毯式"进一步清理周围失活的软组织(表面苍白),再次消毒及使用脉冲冲洗伤口。术区重新消毒后,更换无菌单及手术器械,手术人员更换手套和手术衣。骨折端使用外固定架或抗生素骨水泥被覆钢板固定。通常在40 g庆大霉素骨水泥粉剂中加入5 g万古霉素,混合均匀后加入液态单体,面团期以2 cm3体积大小逐个放入骨缺损区,骨折端平滑包裹超过2 cm[13],抗生素骨水泥完全包裹内固定物(图2)。待骨水泥发热塑形后,使用冰生理盐水浸泡或冲洗降温。留置引流管,缝合术区。

一期术后患者需每月复查一次血常规、红细胞沉降率、C反应蛋白,检查肢体是否存在红、肿、热症状,以评估感染控制情况。一般在一期术后2个月,感染控制良好,局部无渗出及窦道的情况下,可考虑重建手术[14]。术前通过CT测量骨缺损体积(一期术中手术记录则为重要参考),取自体骨或异体骨进行重建。
在行大段骨缺损重建时,自体骨主要取自髂后。患者取俯卧位,沿髂嵴行弧形切口,逐层切开后,暴露髂嵴顶点,使用骨刀打开髂骨外板,取适量松质骨与髂骨外板后,骨蜡封闭骨床或使用异体骨、骨水泥等材料填充取骨缺损,缝合切口。松质骨使用咬骨钳剪碎成颗粒状备用。
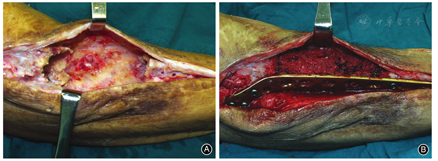
尽可能使用手术刀全层切开皮肤及皮下,暴露骨水泥。保护诱导膜(图3A),在囊内使用骨刀敲除骨水泥,取出内植物与骨水泥。清理髓腔,生理盐水冲洗伤口后重新固定,取骨折端周围软组织再次行微生物及病理学检查。除急性炎症外,骨折端需植骨,植骨前骨折端需行去皮质化处理,使用松质骨颗粒充分包裹骨折两端,保证植骨充分(图3B)。

良好的软组织覆盖是控制感染与诱导成膜的基础。对术中可能出现软组织覆盖困难情况时,需要提前设计皮瓣。既往多次手术的肢体,切口设计一般尽量以原切口为主,术后延迟到3周拆线;对于可能影响术后愈合的瘢痕或窦道周围的软组织,术中需要将其切除,一般切除1~2 mm。伤口愈合是感染控制的一项重要指标,也是整个膜诱导手术成功的关键,因此术中应尽量实现无张力缝合并延长留置负压引流的时间。可吸收缝线和编织丝线均易被细菌克隆,因此尽量全层缝合切口,避免缝线残留于深部组织。对于缝合困难的切口,皮瓣暂时无法覆盖时,可采用伤口负压引流处置创面;但不建议将其作为治疗骨感染的常规方法,因为覆盖在软组织表面的负压引流无法控制来自于深部的感染。
清创术后伤口负压引流可保留约2周,减少渗出物对切口的刺激。一期术后复查X线片,根据药敏结果使用抗生素2周,患者在伤口愈合后出院。术后复查C反应蛋白、红细胞沉降率,如二者均出现二次增高时,需留意感染复发的可能。伤口愈合不良者,需延长使用抗生素直至愈合。再次植骨术后复查X线片,避免过早负重,否则会导致颗粒状松质骨发生移位。当X线片显示出现明显的骨痂形成后可考虑在双拐下负重。
膜诱导重建需要以彻底清除病灶为前提[15],包括去除死骨、肉芽、内固定等异物[16,17]。配合清创手术以控制感染的措施还包括消灭死腔、留置引流、骨折固定、局部抗生素和软组织覆盖[18,19]。成功的清创手术需要同时达到以下目的[11]:①通过彻底清创降低细菌负荷,配合全身和局部的抗生素控制感染;②骨重建区充分的软组织覆盖,为二次手术创造条件;③坚强固定,避免内植物松动损害诱导膜的新生血供。缺乏血供或者无血供的死骨片均应在术前计划中去除,避免成为感染复发的根源。对难以判定的病灶骨,需要结合后期骨重建的难度进行保留,如桥接骨片应尽最大可能保留。
因相关基础研究缺失,故清创的具体内容存在争议[20]。在许多文献中均将"点状出血征"作为完成彻底清创的标准,但在临床实践中,仍存在许多困难:如出血不明显的情况下,是否可以保留低活力骨块;新生的骨痂是否可以保留。研究表明多次清创可以提高感染的控制效率[21]。骨感染难治的原因可以概括为[22]:骨组织内血药浓度较一般组织更低,抗生素难以达到有效血药浓度;死骨区域缺乏血供,抗生素无法发挥作用;细菌形成生物被膜增加抗生素的耐药性;细菌潜入骨细胞内,并以一种低繁殖的状态持续存在。因此,清创手术需要清除的不仅是死骨,还应包括受感染骨,即病灶周围的低活力骨和部分正常骨。根据术前辅助检查定位的病灶,在完成清创术后需要地毯式逐一扩大清创范围。在彻底清除死骨后,继续扩大清除骨组织超过5 mm[23]。新生骨痂常包裹许多病灶骨,一般不建议保留,但塑形好与骨组织结合紧密的大骨块可以考虑保留。
膜诱导需要大量的自体骨进行重建,而感染会导致骨吸收并最终导致手术失败[24]。在非感染性骨缺损重建病例中,一般认为术后6~8周时诱导膜血管化程度及分泌的促骨修复因子含量最佳,包括血管内皮生长因子(vascular endotheli-al growth factor,VEGF)、骨形态发生蛋白-2(bone morphogen-ic protein-2,BMP-2)、转化生长因子-β(transforming growth factor beta,TGF-β)[25],是最佳的植骨时机。对感染性骨缺损病例,一般是在清创术后2个月,如局部软组织修复良好,复查白细胞计数、红细胞沉降率、C反应蛋白无一致性增高,且能除外感染时可考虑二期手术[26]。植骨术中需要再次行快速冰冻检查,如无急性炎症则可考虑植骨[27]。其中自体骨是最佳的骨移植材料,通常取自髂骨,颗粒大小为3~5 mm3。但由于自体骨来源有限,所以在膜诱导二期植骨时可采用自体骨或异体骨相结合的办法[28]。对节段性骨缺损应用明胶海绵作为植骨中心可有效减少植骨量[29]。文献报道,采用膜诱导与骨搬移相结合的办法,既可发挥膜诱导的优势又可节约骨源[30]。
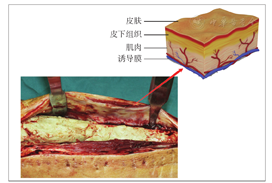
诱导膜紧贴在骨水泥表面,肌肉组织以下,其作用在于机械包裹松质骨,隔离软组织并提供丰富的血供。术中应全层切开,避免过多分离诱导膜上方的肌肉及皮下组织,减少对其血供的损害(图4)。因此,诱导膜内丰富的血管和其完整性均非常重要[31]。为了减少骨不连的发生,诱导膜通常需要超过骨折端2 cm以上。一期清创术后骨折端需使用骨刀磨除骨皮质,并用骨水泥包裹。感染性骨缺损清创术后通常使用外固定架固定,但外固定架易松动可能会影响骨移植区诱导膜的血供。Yu等[32]报告清创术后采用抗生素骨水泥被覆钢板固定,可达到坚强固定与控制感染的目的。二期手术去除骨水泥时,应注意保护诱导膜的完整性,避免过度牵拉和使用过氧化氢清洗伤口;内固定钢板尽可能置于诱导膜外,以减少其产生的遮挡效应,通常采用的方法是在切口的前方或后方置入钢板(图5),以减少钢板下方的骨吸收。由于移植骨在获得影像学骨愈合后仍然还有较长的皮质化塑形期[33],所以长期使用外固定架固定易出现钉道感染和外固定架松动,不利于移植骨的塑形[34]。Wang等[35]和Luo等[36]在二期重建时均主张使用内固定。抗生素涂层髓内钉在局部释放抗生素杀灭细菌,同时能减少植骨量和维持肢体的长度[37]。

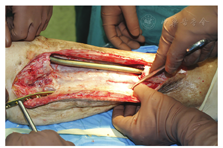

感染复发分为一期术后复发和二期植骨术后复发。一期术后感染复发又分为急性和慢性两种。急性术后感染复发指在伤口愈合以前出现的复发。这部分病例起病急,再次手术通常能找到明确的遗留病灶或因骨折固定、死腔处置、留置引流或局部抗生素使用而导致感染的问题。这些复发病例只能再次进行清创处理。一期术后的慢性复发指在伤口愈合后植骨以前出现的复发。如果复发是因骨水泥外露而导致,则只能再次行清创手术;如果只是伤口渗液,无论是形成还是未形成窦道,则可继续等待,并参考植骨的指征进行处理。
相对一期术后复发,二期术后感染复发的处理显得更加的棘手。因此,判断是否达到植骨的指征非常重要。二期植骨术后感染复发通常表现为渗液,其中一部分病例通过延长抗生素的使用时间可以得到控制;而对未能获得控制并转变为慢性感染的病例,继续使用抗生素无法达到治疗目的。一般需等待6~9个月获得骨愈合后,去除内固定并清创,保留大部分有活力的骨块以减轻重建压力。如果清创术后形成较大的骨缺损,则需要重复一期手术过程。
为避免骨不连的发生,要求抗生素骨水泥包裹骨缺损断超过2 cm;同时二期植骨过程中骨折端需要去皮质化,诱导膜腔内充分植骨(图6)。自体骨的使用比例通常不低于总量的2/3[45],辅助材料可以是同种异体骨或硫酸钙[46,47]。一般而言,来自成年人双侧髂后上棘的自体骨在不添加其他材料的情况下,能重建10~12 cm的胫骨或股骨缺损。因术后发生骨不连可能与自体骨的使用比例和植骨量有关,故为避免骨不连的发生,应当增加自体骨的使用比例,并充分植骨。

膜诱导重建可加速骨愈合,患者术后早期可完全负重[48]。虽然不同文献报道膜诱导重建术后骨愈合时间不一,但影像学检查示骨愈合时间一般为4~8个月[17,49]。Yeganeh等[50]研究发现,年龄、骨缺损长度和感染时间均对骨缺损修复无影响,但可能与植骨材料中自体骨的含量过低、骨折固定方式、低毒力细菌感染等相关。当膜诱导重建过程中发生骨延迟愈合后,不要急于外科干预,可指导患者行负重训练,其中一部分患者可在骨移植术后1~2年缓慢愈合(图7)。当内固定已失效或等待时间超过2年时,可考虑再次手术干预。
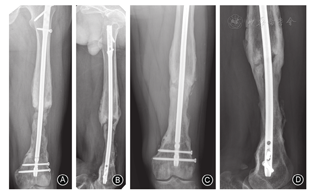

内固定发生断裂通常是因固定方式不当、负重时间过早或骨不愈合导致。术后负重是在观察到骨痂形成后再扶双拐逐渐负重行走,通常为术后2个月前后。
对于超过5 cm的长节段骨缺损,单纯使用一块钢板或者髓内钉固定均需要面临很大的骨不连或内固定断裂风险。因髓腔和髓内钉之间的间隙,会造成骨折端与髓内钉间的微动,故预防的措施是在髓内钉固定的同时在诱导膜外辅以小钢板固定[51]。
总之,膜诱导技术是一种基于重建的骨感染治疗新方法,其优势体现在清创与重建兼顾,不单纯依赖抗生素治疗感染,转变了骨感染的治疗策略。清创术后使用内固定、缩短抗生素治疗时间均从不同程度减少了患者的痛苦,为患者的快速康复创造了条件。但膜诱导技术在骨感染领域还存在许多不明确的地方,比如局部抗生素的添加比例,二期重建的手术指针,都值得今后的进一步深入研究明确。


























