
探讨不同年龄段Chiari畸形Ⅰ型(Chiari malformation typeⅠ, CMI)伴脊柱侧凸患者影像学特征的自然史。
回顾性分析2010年6月至2018年6月诊断为CMI伴脊柱侧凸80例患者的病历资料,根据年龄分为儿童组(≤ 10岁)、青少年组(11~18岁)和成人组(≥19岁)。将脊柱侧凸弯型分为典型弯和非典型弯,记录各组患者的脊柱侧凸弯型分布情况;测量冠状位和矢状位影像学参数,包括侧凸Cobb角、顶椎偏距、冠状面平衡、胸椎后凸角、腰椎前凸角、骨盆倾斜角、骨盆入射角、骶骨倾斜角、矢状面平衡,以及在MRI上测量患者小脑扁桃体下疝程度及脊髓空洞的类型。三组间各参数进行统计学分析。
儿童组(10例)、青少年组(44例)和成人组(26例)典型弯发生率分别为70.0%、、84.1%和50.0%(χ2=14.766,P=0.141),非典型弯为30.0%、15.9%和50.0%(χ2=2.654,P=0.265),三组CMI患者脊柱侧凸弯型分布的差异无统计学意义。冠状位参数中主弯Cobb角(F=16.751,P< 0.001)、主弯柔韧性(F=3.285,P=0.044)、次弯Cobb角(F=9.805,P<0.001)和冠状面平衡(F=5.249,P=0.007)的差异均有统计学意义,两两比较结果显示随着年龄增长,主弯和次弯Cobb角亦增加,主弯的柔韧性下降;三组间冠状面平衡的差异无统计学意义,但青少年组冠状面平衡数值低于其他两组。矢状位参数中胸椎后凸角(F=4.324,P=0.017)、腰椎前凸角(F=4.590,P=0.013)、骨盆入射角(F=5.501,P=0.006)和骨盆倾斜角(F=3.220,P=0.045)三组间的差异有统计学意义,两两比较结果显示随着年龄的增长,各矢状位参数均明显增加,侧凸畸形加重。MRI显示越年轻的患者,高级别的小脑扁桃体下疝(χ2=18.479,P< 0.001)和膨胀型脊髓空洞(χ2=23.074,,P=0.003)的比例越高。
Chiari畸形Ⅰ型患者随着年龄增长,主弯Cobb角明显进展而柔韧性降低,提示应早期进行手术干预以降低手术风险。年长患者小脑扁桃体下疝和脊髓空洞程度优于年轻患者,提示可能存在自发性缓解。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
Chiari畸形(Chiari malformation)为小脑扁桃体经枕骨大孔疝入上颈段椎管内,可伴脑桥和延髓延长、扭曲或下疝及后颅窝发育不良,也可合并颅底、枕骨大孔区畸形及脊髓脊膜膨出。根据其病理改变Chiari畸形分为四型,其中Chiari畸形Ⅰ型(Chiari malformation typeⅠ,CMI)是临床上最常见的类型,发生率为0.56%~0.75%[1,2],而Chiari畸形Ⅱ型~Ⅳ型较为少见,且通常在新生儿期和儿童早期即出现严重的神经系统异常。CMI以小脑扁桃体向椎管内下移为主要特征,无脑脊膜膨出,下移超过枕骨大孔平面以下至少5 mm[3]。CMI患者通常伴有脊柱侧凸,发生率为15%~50%[4,5]。尽管既往已有较多的相关研究,但CMI的发病机制仍未明确。
近年来,主流观点认为发生CMI的原因是后颅窝发育不良,造成小脑过度拥挤,小脑扁桃体向尾侧下疝,从而导致脑脊液循环障碍并形成脊髓空洞[6,7,8,9]。Zhu等[10,11]报告在CMI伴脊髓空洞患者中脊柱侧凸的方向倾向于与小脑扁桃体下疝和脊髓空洞方向一致;CMI不伴脊髓空洞患者中脊柱侧凸的方向同样与小脑扁桃体下疝的方向保持高度一致,这为CMI导致脊柱侧凸的说法提供了更多的证据。
为进一步探究CMI患者病情的发展,既往研究开始关注CMI的自然史[12,13,14],显示大部分患者的神经系统异常保持不变,仅少数患者好转或恶化。然而这些研究均未考虑到CMI伴脊柱侧凸患者未经治疗的脊柱侧凸可迅速进展,导致新的神经症状或限制胸廓大小而影响呼吸功能[15,16];且入组的被试者均为仅需接受保守治疗的患者,病例数量少或平均随访时间短,很难准确反映真实的病程。
有鉴于此,本研究回顾性分析了80例CMI伴发脊柱侧凸患者的病历资料,目的在于:①总结既往CMI自然史研究的面果;②观察不同年龄段患者的影像学特征以分析以神经系统异常和脊柱侧凸变化为特征的CMI伴发脊柱侧凸患者自然史。
纳入标准:①确诊为CMI伴发脊柱侧凸的患者,且具有完整的临床及影像学资料;②主要观察指标为CMI影像学特征、脊柱侧凸的弯型及其测量参数;③横断面研究。
排除标准:①既往有后颅窝减压手术史及脊柱手术史;②合并椎体骨折等创伤史;③脊柱肿瘤;④合并先天性脊柱发育不良;⑤MRI示神经系统异常。
按上述的纳入及排除标准,收集2010年6月至2018年6月我院诊断为CMI伴脊柱侧凸的患者,共80例纳入本研究。根据年龄分为儿童组(年龄< 10岁),青少年组(10~18岁)和成人组(年龄>18岁)。
儿童组10例,女6例、男4例,年龄(6.5±2.3)岁(3~9岁),Risser征为(0.0±0.0)级。
青少年组44例,女19例、男25例,年龄(14.7±1.9)岁(10~18岁),Risser征为(1.9±1.7)级。
成人组26例,女14例、男12例,年龄(31.7±11.3)岁(19~58岁),Risser征为(5.0±0.2)级。
ANOVA显示,三组患者年龄和Risser征的差异均有统计学意义(P<0.05),而性别分布的差异则无统计学意义(P=0.516)。
既往研究提出CMI患者侧凸的弯型可以分为典型弯和非典型弯[17]。典型弯的端椎和顶椎如下所示[17,18,19]:右胸弯(T5,6~T11,12,顶椎T7,T8),右胸弯/左腰弯(T4~6~T11,T11~L3,4,顶椎T8,T9和L2),右胸弯/左胸腰弯(T3~5~T10,T10~L3,顶端T4,5和L1),胸腰弯(T9,T10~L3,顶端T12,L1)和腰弯(T12~L4,顶端L2)。典型弯中的非典型特征包括但不限于原发或继发弯中较高/较低的端椎或顶椎。此外,非典型弯包括左胸弯,左胸弯/右腰弯,左胸弯/右胸腰弯,右和左双胸弯,不典型右胸弯(King Ⅳ型),三和四弯。
1.主弯、次弯Cobb角及柔韧性:
侧凸Cobb角定义为冠状面头侧端椎上终板与尾侧端椎下终板所成的夹角(图1)。Cobb角最大的侧弯为主弯,其次的侧弯为次弯。Cobb角越大表示侧凸畸形越严重。柔韧性可预测病变脊柱的可塑性和弹性,通过以下公式[20]计算:
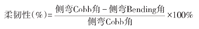
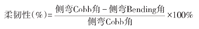

2.顶椎偏移距离(apical vertebral translation, AVT),是评估脊柱侧凸的常用指标,对制定手术策略、预测术后并发症等具有重要的指导意义。评估上胸弯和胸弯时,定义为顶椎或顶椎间盘中点至C7铅垂线的水平距离;评估胸腰弯和腰弯,定义为顶椎或顶椎间盘中点至骶骨中垂线的水平距离(图1)。
3.冠状面平衡(coronal balance, CB):定义为C7铅垂线(C7 plumb line,C7PL)至骶骨中垂线(center sacral vertical line,CSVL)的水平距离(图1)。CB >20 mm定义为冠状面失衡 [21]。
1.胸椎后凸角(thoracic kyphosis,TK):定义为T3椎体上终板与T12椎体下终板的夹角(图1)。根据正常人群矢状面参数将TK分为后凸正常(20°~50°)、后凸减小(< 20°)和后凸增大(>50°)[17,22]。
2.腰椎前凸角(lumbar lordosis,LL):定义为T12与S1上终板的夹角(图1)。根据正常人群矢状面参数将LL分为前凸正常(54°~74°)、前凸减小(< 54°)和前凸增大(>74°)[17,22]。
3.骨盆倾斜角(pelvic tilt,PT),是骨盆的位置参数,描述骨盆旋转的情况,反映代偿机制。定义为经骶骨上终板中点和双侧股骨头中心连线中点连线与铅垂线的夹角(图1)。
4.骨盆入射角(pelvic incidence,PI),是骨盆的解剖学参数,反映骨盆对矢状面失衡的代偿能力。定义为经骶骨上终板中点的垂线与经骶骨上终板中点和双侧股骨头中心连线中点连线的夹角(图1)。
5.骶骨倾斜角(sacral slope,SS),是骨盆的位置参数,PT和SS共同用于描述骨盆绕股骨头旋转的情况。定义为骶骨上终板切线与水平线的夹角(图1),与PT、PI之间存在如下等量关系,即PI=PT+SS。
6.矢状面平衡(sagittal vertical axis,SVA):定义为C7铅垂线(C7PL)至骶骨后上角的水平距离(图1)。SVA>50 mm定义为矢状面失衡[20]。
小脑扁桃体下疝程度可分为三级:Ⅰ级(疝体下缘超过枕大孔下方5 mm,但未到C1后弓上缘),Ⅱ级(疝体下缘位于C1后弓水平),Ⅲ级(疝体下缘至C1后弓下缘)。
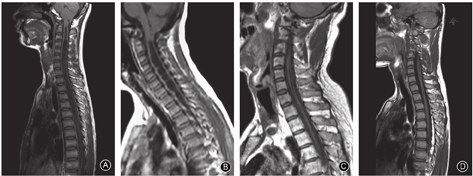
脊髓空洞的形态分为四种类型,即膨胀型、念珠型、细长型和局限型(图2)[23]。

计算最大S/C比值时,应在同一节段测量脊髓空洞前后径和脊髓直径[24]。
脊髓空洞的长度定义为脊髓空洞跨越的椎体数。
本研究为横断面研究。采用SPSS 20.0(SPSS公司,美国)统计软件包进行统计分析,数据以( ±s)表示,儿童组、青少年组与成人组各参数比较采用单因素方差分析(ANOVA)、χ2检验或Fisher精确检验,两两比较采用LSD法;检验水准α值取双侧0.05。
±s)表示,儿童组、青少年组与成人组各参数比较采用单因素方差分析(ANOVA)、χ2检验或Fisher精确检验,两两比较采用LSD法;检验水准α值取双侧0.05。
典型弯的发生率为71.3%。儿童组发生率为70.0%,青少年组为84.1%,成人组为50.0%(P=0.141,表1)。典型弯中上、下端椎和(或)顶椎向上或向下偏移被定义为不典型特征,在儿童组、青少年组和成人组中不典型特征占典型弯的比例分别为85.7%(6/7)、65.8%(25/38)、78.6%(11/14),三组患者不典型特征分布的差异无统计学意义(P=0.442,表1)。
儿童组、青少年组和成人组患者的弯型分布
儿童组、青少年组和成人组患者的弯型分布
| 弯型 | 儿童组(10例) | 青少年组(44例) | 成人组(26例) | χ2值 | P值 | |
|---|---|---|---|---|---|---|
| 典型弯 | 7(70.00%) | 37(84.09%) | 13(50.00%) | - | ||
| 右胸弯 | 5(50.00%) | 27(61.36%) | 5(19.23%) | |||
| 右胸弯/左腰弯 | 0 | 2(4.55%) | 2(7.69%) | |||
| 右胸弯/左胸腰弯左胸腰弯 | 01(10.00%) | 4(9.09%)2(4.55%) | 01(3.85%) | 14.766 | 0.141 | |
| 右胸腰弯 | 1(10.00%) | 1(2.27%) | 3(11.54%) | |||
| 左腰弯 | 0 | 1(2.27%) | 2(7.69%) | |||
| 非典型弯 | 3(30.00%) | 7(15.91%) | 13(50.00%) | - | ||
| 左胸弯 | 3(30.00%) | 7(15.91%) | 10(38.46%) | |||
| 左胸弯/右腰弯 | 0 | 0 | 3(11.54%) | |||
| 右双胸弯 | 0 | 0 | 0 | 2.654 | 0.265 | |
| 左双胸弯 | 0 | 0 | 0 | |||
| 不典型右胸弯(King Ⅳ) | 0 | 0 | 0 | |||
非典型弯的发生率为28.8%。儿童组发生率为30.0%,青少年组为15.9%,成人组为50.0%,三组患者非典型弯分布的差异无统计学意义(P=0.265,表1)。
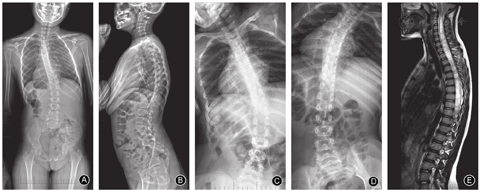
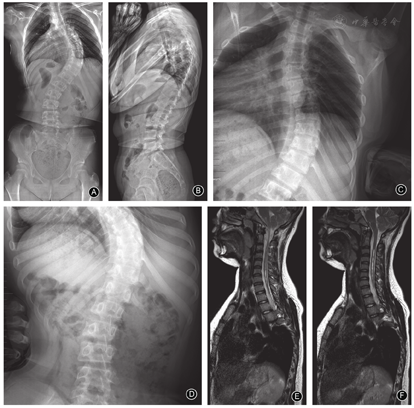
儿童组的主弯Cobb角为31.1°±11.9°(图3)、青少年组为56.7°±17.0°(图4)、成人组为70.7°±22.6°(图5),随着年龄增加,主弯Cobb角明显增大,三组的差异有统计意义(P< 0.001,表2);主弯柔韧性明显降低(63.9%±28.7% vs 43.8%±20.0% vs 36.9±22.7%,P=0.044,表2);次弯Cobb角明显增大(16.8°±8.8° vs 34.8°±14.7° vs 41.6°±17.2°,P< 0.001,表2)。
儿童组、青少年组和成人组患者脊柱畸形冠状面影像学参数的比较
儿童组、青少年组和成人组患者脊柱畸形冠状面影像学参数的比较
| 测量参数 | 儿童组(10例) | 青少年组(44例) | 成人组(26例) | F值 | P值 |
|---|---|---|---|---|---|
主弯Cobb角( ±s,°) ±s,°) | 31.03±11.90 | 56.71±17.02 | 70.65±22.55 | 16.751 | < 0.01 |
主弯柔韧性( ±s,%) ±s,%) | 63.87±28.68 | 43.77±19.97 | 36.86±22.72 | 3.285 | 0.044 |
主弯顶椎偏距(AVT, ±s,mm) ±s,mm) | 40.22±21.96 | 48.86±22.68 | 56.21±27.92 | 1.688 | 0.192 |
次弯Cobb角( ±s,°) ±s,°) | 16.80±8.78 | 34.75±14.69 | 41.55±17.21 | 9.805 | < 0.01 |
冠状面平衡(CB, ±s,mm) ±s,mm) | 15.57±13.26 | 9.94±7.49 | 18.70±14.93 | 5.249 | 0.007 |


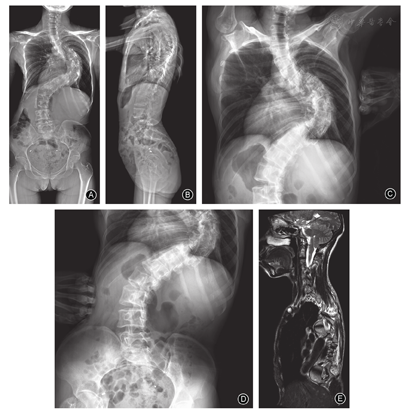

青少年组CB为(9.9±7.5)mm,优于儿童组(15.6±13.3)mm和成人组(18.7±14.9)mm(P=0.007,表2)。三组发生冠状面失衡的患者分别为2例、1例和3例。各组间主弯AVT的差异则无统计学意义(P=0.192,表2)。
儿童组、青少年组和成人组患者的TK(32.1°±8.0° vs 32.5°±12.9° vs 43.3°±20.9°,P=0.017,表3)、LL(50.4°±9.3° vs 54.6°±13.1° vs 63.4°±16.3°,P=0.013,表3)、PI(32.1°±10.2° vs 42.7°±10.1° vs 44.1°±9.9°,P=0.006,表3)和PT(-1.9°±12.3° vs 4.9°±8.1° vs 5.8°±7.1°,P=0.045,表3)随着年龄的增加而增大。三组SS(P=0.444,表3)和SVA(P=0.742,表3)的差异则无统计学意义,发生矢状面失衡的患者分别为0例、3例和1例。
儿童组、青少年组和成人组患者脊柱畸形矢状面影像学参数的比较
儿童组、青少年组和成人组患者脊柱畸形矢状面影像学参数的比较
| 测量参数 | 儿童组(10例) | 青少年组(44例) | 成人组(26例) | 检验值 | P值 | |
|---|---|---|---|---|---|---|
胸椎后凸角(TK, ±s,°) ±s,°) | 32.06±8.00 | 32.45±12.85 | 43.29±20.93 | F=4.324 | 0.017 | |
| 后凸减小(例,%) | 0 | 5(11.36%) | 3(11.54%) | |||
| 后凸正常(例,%) | 10(100.00%) | 34(77.27%) | 15(57.69%) | χ2=8.705 | 0.069 | |
| 后凸增大(例,%) | 0 | 5(11.36%) | 8(30.77%) | |||
腰椎前凸角(LL, ±s,°) ±s,°) | 50.36±9.25 | 54.55±13.14 | 63.39±16.28 | F=4.590 | 0.013 | |
| 前凸减小(例,%) | 6(60.00%) | 20(45.45%) | 8(30.77%) | |||
| 前凸正常(例,%) | 4(40.00%) | 22(50.00%) | 12(46.15%) | χ2=8.594 | 0.072 | |
| 前凸增大(例,%) | 0 | 2(4.55%) | 6(23.08%) | |||
骨盆入射角(PI, ±s,°) ±s,°) | 32.08±10.15 | 42.71±10.13 | 44.12±9.86 | F=5.501 | 0.006 | |
骨盆倾斜角(PT, ±s,°) ±s,°) | -1.88±12.33 | 4.90±8.12 | 5.81±7.07 | F=3.220 | 0.045 | |
骶骨倾斜角(SS, ±s,°) ±s,°) | 33.96±10.15 | 37.82±8.61 | 38.31±10.51 | F=0.821 | 0.444 | |
矢状面平衡(SVA, ±s,mm) ±s,mm) | -3.90±27.56 | -7.63±28.42 | -11.64±30.17 | F=0.299 | 0.742 | |
儿童组、青少年组和成人组患者小脑扁桃体下疝程度(P< 0.001,表4)、脊髓空洞形态(P=0.003,表4)和最大S/C比值(P=0.002,表4)的差异均有统计学意义。
儿童组、青少年组和成人组患者MRI测量参数的比较
儿童组、青少年组和成人组患者MRI测量参数的比较
| 测量参数 | 儿童组(10例) | 青少年组(44例) | 成人组(26例) | 检验值 | P值 | |
|---|---|---|---|---|---|---|
| 小脑扁桃体下疝程度(例,%) | ||||||
| Ⅰ级 | 0 | 17(38.6) | 12(46.2) | |||
| Ⅱ级 | 3(30.0) | 19(43.2) | 12(46.2) | χ2=18.479 | < 0.01 | |
| Ⅲ级 | 7(70.0) | 8(18.2) | 2(7.6) | |||
| 脊髓空洞形态(例,%) | ||||||
| 无空洞 | 2(20.0) | 2(4.5) | 5(19.2) | |||
| 膨胀型 | 5(50.0) | 12(27.3) | 5(19.2) | |||
| 念珠型 | 2(20.0) | 9(20.5) | 1(3.8) | χ2=23.074 | 0.003 | |
| 细长型 | 0 | 10(22.7) | 14(53.8) | |||
| 局限型 | 1(10.0) | 11(25.0) | 1(3.8) | |||
| 最大S/C比值(例,%) | ||||||
| ≤ 0.5 | 0 | 17(38.64) | 15(57.69) | χ2=16.072 | 0.002 | |
| >0.5 | 8(80.00) | 25(56.82) | 6(23.08) | |||
| 脊髓空洞长度(x±s,个) | 7.80±6.00 | 7.43±6.48 | 5.19±5.85 | F=1.221 | 0.301 | |
随着年龄的增大,高级别小脑扁桃体下疝的比例明显减少,儿童组为70.0%(7/10)、青少年组为18.2%(8/44)、成人组为7.6%(2/26)。膨胀型脊髓空洞的比例亦明显减少,儿童组为50.0%(5/10)、青少年组为27.3%(12/44)、成人组为19.2%(5/26),而细长型脊髓空洞的比例则明显增大,儿童组为0(0/10)、青少年组为22.7%(10/44)、成人组为53.8%(14/26);最大S/C比值>50%所占比例明显减少,儿童组为80.0%(8/10)、青少年组为56.8%(25/44)、成人组为23.1%(6/26)。
儿童组脊髓空洞的长度为(7.8±6.0)个椎体、青少年组为(7.4±6.5)个椎体、成人组为(5.2±5.9)个椎体,虽然差异无统计学意义(P=0.301,表4),但成人组空洞长度的平均值明显低于其他两组。
既往文献对CMI自然史报道不多,Novegno等[12]纳入22例接受保守治疗的CMI患者,年龄平均为6.3岁(1~16岁),随访时间平均为5.9年(3~19年),末次随访时MRI显示16例患者(72.7%)的小脑扁桃体下疝保持稳定,4例患者(18.2%)下疝自发缓解(其中1例患者下疝完全消退),2例患者(9.1%)下疝加重,因此其认为对于无症状或症状较轻的CMI患者,应采用保守治疗并定期随访,然而这项研究的病例数量较少,患者年龄和末次随访时间的跨度较大,且未关注脊髓空洞的变化。Strahle等[13]纳入147例年龄≤18岁(平均7.7岁)且随访时间≥1年(平均3.8年)的CMI患者,末次随访时103例患者(70.1%)小脑扁桃体下疝变化≤ 2 mm,45例(30.6%)下疝缓解,其中7例(4.8%)不再符合CMI的诊断标准(下疝<5 mm),6例患者(4.1%)下疝加重(超过4 mm),其认为下疝的改善与年龄相关,年龄越大改善越多;在随访期间8例患者(5.4%)发生了脊髓空洞,其中5例患者先前已诊断为脊髓空洞前状态或中央管扩张,3例患者(2.0%)脊髓空洞自发消退,因此其认为选择进行非手术治疗的CMI患者,其自然史通常是良性,偶尔可见自发改善或进展,然而该项研究随访时间太短,且未将患者进行年龄分组后详细分析。Whitson等[14]纳入52例不伴脊髓空洞的CMI患者,平均年龄8.2岁(2~16岁),随访时间超过12年,在末次随访时50%的患者小脑扁桃体下疝位置保持稳定,38%的患者小脑扁桃体下疝缓解(其中12%的患者下疝消退),12%的患者小脑扁桃体下疝进展,故认为CMI患者的小脑扁桃体下疝是动态发展而非一成不变,并且随访期间小脑扁桃体下疝自发恢复比进展更常见,但该项研究中患者年龄跨度较大,且仅纳入了不伴脊髓空洞的患者,无法观察脊髓空洞的发生、发展。
此外,这些研究纳入的患者均为临床评估后拟行保守治疗的患者,未涉及需接受手术治疗的患者,因此存在一定的选择偏倚,且均未同时考虑到患者弯型变化及CMI伴脊柱侧凸患者侧凸的进展情况,伴脊柱侧凸的发生率在CMI患者中并不低。
本研究是首个关于CMI伴脊柱侧凸患者自然史的横断研究,比较儿童组(图2)、青少年组(图3)和成人组(图4)三个不同年龄段患者的影像学特征。结果显示三组患者的非典型弯发生率较高,且各组间弯型分布的差异无统计学意义,这与既往文献报道的结果一致[11,25];随着年龄的增长,患者主弯和次弯Cobb角增大,而主弯柔韧性下降,此结果符合临床经验,与特发性脊柱侧凸相似[26]。此外,有文献报道接受支具或手术治疗的CMI患者,年龄≥10.5岁、Cobb角≥44.5°是侧凸进展的强预测因子[27]。青少年组的CB明显优于另外两组,可能预示着随着年龄增长,CMI患者的冠状面是由失衡到平衡,再到失衡的动态过程,此结果有待于进一步验证。矢状面X线片显示年龄越大的CMI患者,TK、LL、PI和PT均明显增大,这一变化趋势符合正常中国成年人群脊柱和骨盆的矢状面参数[22];CMI患者与正常人群的对比在既往文献中也有报道[28]。
本研究通过MRI观察了患者的小脑扁桃体下疝和脊髓空洞,结果显示年龄越小的患者越倾向于存在较高程度的小脑扁桃体下疝,并且三组患者脊髓空洞形态的分布差异有统计学意义,儿童组脊髓空洞以膨胀型为主(50.0%),且最大S/C比值>50%占多数(80.0%);青少年组脊髓空洞各形态比例相近;而成人组脊髓空洞以细长型为主(53.8%),最大S/C比值≤ 50%占多数(57.7%)。既往关于小脑扁桃体下疝和脊髓空洞的自发缓解存在争议[12,13,14,29,30],本研究结果从一个新的角度为此结论提供了证据。Strahle等[31]报告CMI患者中脊柱侧凸的发生与小脑扁桃体下疝并无独立相关,因此根据本研究的结果,我们推测CMI患者脊柱侧凸的发生、发展可能与多个因素相关,包括小脑扁桃体下疝突入椎管或椎管本身的狭窄造成脑脊液循环障碍,诱发部分患者发生脊髓空洞,使椎旁肌失神经支配造成了脊柱侧凸的进展[13, 32,33],随着年龄增长,后颅窝形态改善,小脑扁桃体下疝及脊髓空洞随之自发缓解。因此,本研究结果提示从脊柱畸形的角度评估,CMI患者需要早期进行手术干预。
本研究作为一个横断面研究,必然存在一定的局限型,首先该研究无法证明CMI患者的起病时间及病程长短,因此不同组间影像学特征的差异可能存在抽样误差或其他相关误差;其次本研究结果仅代表不同年龄组患者之间的差异,从侧面反映CMI患者的自然史;根据伦理学要求,难以对临床评估后需行手术治疗的患者开展纵向研究。因此,未来的研究应增加病例数量以及纳入患者术后的影像学数据进行分析,以避免此类误差的出现。
综上所述,本研究首次探究了CMI伴脊柱侧凸患者的自然史,分析了儿童组、青少年组和成人组三个不同年龄段CMI患者的影像学特征,发现三组脊柱侧凸的弯型分布的差异无统计学意义;随着年龄的增长,患者主弯及次弯Cobb角明显进展而主弯柔韧性降低,提示应早期进行手术干预以降低手术风险。此外,年长患者的小脑扁桃体下疝程度和脊髓空洞类型均优于年轻患者,提示小脑扁桃体下疝和脊髓空洞可能存在自发性缓解,此发现有助于进一步揭示CMI的发病机制。



























