
通过股骨截骨术增大股骨前倾角和髌骨内外侧软组织失平衡手术制作髌骨脱位模型,观察股骨滑车局部形态和骨小梁结构的变化。
取40只3个月龄的新西兰幼兔,分别对其右膝进行两种手术方式(每组20只):①截骨组,接受股骨旋转截骨术,股骨远端内旋来增大股骨前倾角;②软组织组,行髌骨内侧支持带松解和外侧支持带紧缩缝合术。所有左膝作为正常对照组。术后观察4个月至骨骼成熟,将股骨远端进行Micro-CT扫描,测量滑车形态:外侧髁、滑车沟和内侧髁的高度,滑车沟角,滑车的外侧和内侧关节面倾斜角等,并对骨小梁进行分析:骨体积分数、骨小梁厚度、骨小梁数量、骨小梁分离度和骨密度等。相关指标的结果进行组间比较。
截骨组中1例发生髋关节脱位,而髌骨未发生脱位;3例在屈膝状态下出现完全性的髌骨脱位;16膝在膝关节被动伸直时,髌骨发生脱位。软组织组中15膝在屈膝状态下出现完全性的髌骨脱位,5膝未发生髌骨脱位。截骨组的股骨滑车在滑车入口处伴有局部的突起形成,称为"骨突",而滑车关节面比较光滑,未出现明显的软骨破裂等,而软组织组的股骨滑车未见"骨突"形成,滑车关节面出现软骨破裂、缺损等关节炎表现。与对照组相比,截骨组和软组织组的滑车均变浅和变宽,滑车沟高度和滑车沟角变大,但两组比较没有统计学差异。与对照组相比,截骨组骨小梁发生汇聚,内侧髁和外侧髁的骨小梁厚度增大,内侧髁骨小梁数量减少,而软组织组表现为骨质疏松,内侧髁和外侧髁的骨体积分数、骨小梁厚度、骨小梁数量和骨密度都减少,骨小梁分离度增大。与软组织组相比,截骨组内侧髁和外侧髁的骨体积分数、骨小梁厚度、骨小梁数量和骨密度都较大,骨小梁分离度较小,差异有统计学意义。
通过股骨截骨术增大股骨前倾角和髌骨内外侧软组织失平衡手术可成功构建髌骨脱位的骨性和软组织型模型,并继发形成不同的滑车形态学改变和骨小梁结构变化。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
髌骨脱位在临床中较为常见,好发于青少年,其病因复杂,治疗手段不统一,如不能恢复良好的髌骨运动轨迹容易导致患者早期髌股关节炎的发生。髌骨脱位的危险因素大体分为两类:①软组织因素,如内侧髌股韧带(medial patellofemoral ligament,MPFL)的损伤[1];②越来越多的骨性危险因素被认识到,如滑车发育不良、髌骨高位、胫骨结节外置和股骨前倾角(femoral anteversion angle,FAA)增大等[2,3]。
生物力学研究证实,MPFL在维持髌骨稳定性的内侧软组织中起关键作用,提供约50%~60%的内侧稳定力量[4]。对于复发性髌骨脱位,MPFL撕裂愈合欠佳或功能失效者可占50%~96%[5],因此临床上MPFL重建是治疗髌骨脱位的基本术式。近年来研究发现FAA增大10°是髌骨脱位的独立危险因素,增大的FAA将会增加外侧髌股关节之间的压力,增加髌骨内侧支持带的张力[6,7]。临床上,对于伴FAA增大的髌骨脱位患者,常用的MPFL重建联合胫骨结节截骨术的治疗效果并不理想[8,9]。FAA的异常增大成为髌骨脱位相关的临床治疗和研究中需要考虑的重要因素。
目前在基础研究中,通常髌骨脱位的模型大都是通过松解髌骨内侧支持带,重叠缝合外侧支持带来完成的[10,11,12]。这种"软组织模型"未涉及髌骨脱位中的骨性危险因素,模拟真实的临床情况有一定的局限性,而既往文献中还没有髌骨脱位"骨性模型"的相关报道。许多研究证实,FAA在髌骨脱位的患者中要明显大于正常人群[13,14,15],而影像学分析也发现FAA增大会影响滑车发育的形态[2,16]。因此,通过增大FAA来建立髌骨脱位的"骨性模型"对探讨髌骨脱位的发病机制有重要的意义。
滑车发育不良是髌骨脱位的高危因素,而近年来的研究发现髌骨脱位会继发股骨滑车发育不良[10,11,12]。临床上对儿童髌骨脱位患者行复位手术治疗后随访发现,股骨滑车会出现滑车形态重塑现象[17,18]。髌骨脱位中的软组织损伤或骨性危险因素,均可改变髌股关节之间的压力分布,而导致相应的滑车形态改变[6,7]。目前滑车发育的机制尚不完全清楚,而应用Micro-CT观察滑车局部骨小梁的变化可以为研究滑车发育不良的机制提供参考。
本研究应用发育期实验兔,分别通过股骨旋转截骨术增大股骨前倾角和髌骨内外侧软组织失平衡手术来建立髌骨脱位的"骨性模型"和"软组织模型",并通过Micro-CT观察并比较两组模型中股骨滑车外部形态和内部骨小梁的变化。目的在于:①探讨髌骨脱位骨性模型和软组织模型的病理基础;②比较骨性因素和软组织因素对滑车发育的影响。
选择3个月龄的新西兰幼兔40只,雌性,体重1.8~2.3 kg,由河北医科大学实验动物中心提供。所有的幼兔术前检查膝关节的活动度和步态,均无异常。取所有幼兔的右侧后肢接受手术。
根据手术方式分为两组(每组20只):①接受股骨旋转截骨术,股骨远端内旋来增大股骨前倾角(截骨组);②进行髌骨内侧支持带松解和外侧支持带紧缩缝合术(软组织组)。
既往文献报道在7个月龄时兔子的骨骼发育趋向成熟,因此本研究所有实验动物在术后观察4个月,即至骨骼成熟[13]。
本实验经过河北医科大学第三医院动物伦理委员会同意(Z2017-016-1)。
采用耳缘静脉注射方式注入质量分数为25%的乌拉坦4 ml/kg(上海埃彼化学试剂有限公司,中国),并肌注速眠新0.05 ml/kg(吉林圣达动物药品有限公司,中国)联合麻醉,保持兔子左侧卧位在操作台上,常规备皮、碘伏消毒、铺单。
右膝关节稍微屈膝,在大腿的外侧中部取5 cm的纵向切口,依次切开皮肤、皮下组织,显露筋膜层,观察并确定位于股外侧肌和股二头肌之间的筋膜间隙,切开直到股骨干。
股骨横行截骨的位置定位在股骨干中点以远端,应用电锯小心轻柔的进行截骨,以尽量保证截骨面的断面平整。应用6孔的锁定截骨板(指骨解剖型接骨板,天津正天医疗器械有限公司,中国)沿着股骨干的后缘放置,在截骨线远端首先应用2枚锁定螺钉进行固定。待截骨远端骨块和截骨板固定牢靠后,将远端进行内旋,其旋转目标是截骨线远端和近端的骨干的后缘之间的距离约为3~4 mm,即股骨前倾角增大约200(图1)。然后应用2枚锁定螺钉将截骨线近端的股骨固定来完成截骨。
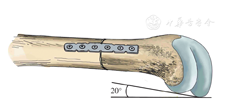

术后被动屈伸膝关节,检测髌骨的运动轨迹。髌骨在伸直的终末期可以出现髌骨的外移甚至脱位,在屈曲的过程中,髌骨会滑入股骨的滑车。应用生理盐水冲洗手术区后,应用普通的丝线逐层缝合筋膜、皮下组织和皮肤切口。
麻醉和体位同截骨组。采用膝前正中纵向切口,长约4 cm,依次切开皮肤、皮下组织,显露髌前筋膜,沿着髌骨内侧缘,纵向切开内侧支持带和关节囊,长约2 cm。
分别在髌骨上下极水平将髌骨外侧关节囊和外侧支持带结构重叠缝合2针(图2)。
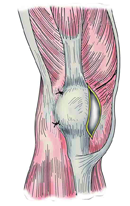

术后被动屈伸膝关节,检测髌骨的运动轨迹。髌骨在屈伸过程中不能复位于股骨滑车沟内,造成完全性髌骨脱位。用生理盐水冲洗手术区后,应用普通的丝线逐层缝合筋膜、皮下组织和皮肤切口。
术后每只动物放置单独的饲养笼中,术后的活动没有限制,随着疼痛的减轻,兔子的活动逐步增多。术后3 d在饲料中加入口服的头孢药物来预防感染。至术后4个月时,采用过量麻醉药物注射来处死兔子,在去除股骨远端所有的软组织后,收集股骨远端。
将收集的标本进行大体观察,后在10%的福尔马林溶液中保存,以备Micro-CT检测。
将离体的股骨远端标本进行Micro-CT(Sky-Scan model 1076,Skyscan公司,比利时)扫描,扫描条件为:电压50 kv,电流800 μA,以23.4 μm扫描分辨率、1 304×1 024视野大小进行扫描。所有的扫描层面导入Mimics 19.0软件(Materialise公司,比利时)进行相应的测量和计算。
首先需定位股骨滑车近端层面,通常为通过股骨滑车关节软骨初始覆盖的首个扫描层面,以此层面为基础,选取远端厚度为5 mm的CT层面,作为"测量平面",标记股骨后髁的连线作为参考线[20](图3)。
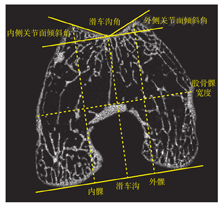

①滑车高度
连线股骨髁的最内侧点和最外侧点,确定为股骨髁的宽度;分别从外侧髁最高点、滑车最低点和内侧髁最高点做后髁参考线的垂线,并与之交点之间的距离定义为外侧髁高度(height of lateral,LTH)、滑车沟高度(height of central,CTH)和内侧髁的高度(height of medial trochlea,HTH)。为消除个体大小因素的影响,分别将所测的长度与股骨髁的宽度进行除法计算,用股骨髁宽度的百分率来表示其相对值。在滑车发育不良中,股骨滑车沟高度相对值会增加。
②滑车角度
分别连接外侧髁最高点和内侧髁最高点与滑车沟最低点的作为滑车外侧关节面和内侧关节面,而关节面之间的夹角为滑车沟角(sulcus angle,SA),而关节面与后髁连线的夹角分别定义为滑车的外侧关节面倾斜角(lateral trochlea slope,LTS)和内侧关节面倾斜角(medial trochlea slope,MTS)。在滑车发育不良中,滑车沟角变会变大,而滑车的外侧和内侧关节面倾斜角会减小。
定位股骨内、外侧髁贴近软骨下的区域,选取圆柱形区域设定为三维重建兴趣区域(region of interesting,ROI),用图像处理软件N-Recon 1.6.10.4(SkyScan公司,比利时)进行三维图像重建。
采用数据分析软件CT-AN 1.16.1.0(SkyScan公司,比利时)进行三维分析以下参数:
①骨体积分数(bone volume/tissue volume,BV/TV,单位:%),在选定的兴趣区内骨小梁总体积与样本总体积之比,发生骨质疏松时BV/TV值减小;
②骨小梁厚度(trabecular thickness,Tb.Th,单位:mm),骨小梁的平均厚度,发生骨质疏松时,Tb.Th值减小;
③骨小梁数量(trabecular number,Tb.N,单位:个/mm),指给定长度内骨组织与非骨组织的交点数量,可理解为每单位距离内有多少数量的骨小梁,发生骨质疏松时,Tb.N值减小;
④骨小梁分离度(trabecular spacing,Tb.Sp,单位:mm),骨小梁之间的髓腔平均宽度,发生骨质疏松时,Tb.Sp值增大;
⑤骨密度(bone mineral density,BMD),单位体积内骨的质量,发生骨质疏松时,BMD值减小。
采用SPSS 23.0(SPSS公司,美国)统计软件包进行统计学分析。本研究中涉及的统计学变量均为计量资料,用( ±s)的形式表示。对于满足方差齐性和正态分布的数据(内侧髁高度、滑车沟高度、外侧髁高度、滑车沟角、滑车内侧倾斜角、滑车外侧倾斜角、骨体积分数、骨小梁厚度、骨小梁数量、骨小梁分离度和骨密度)采用独立样本t检验;对于不满足方差齐性或正态分布的数据(无)采用非参数Mann-Whitney U检验。检验水准α值取双侧0.05。
±s)的形式表示。对于满足方差齐性和正态分布的数据(内侧髁高度、滑车沟高度、外侧髁高度、滑车沟角、滑车内侧倾斜角、滑车外侧倾斜角、骨体积分数、骨小梁厚度、骨小梁数量、骨小梁分离度和骨密度)采用独立样本t检验;对于不满足方差齐性或正态分布的数据(无)采用非参数Mann-Whitney U检验。检验水准α值取双侧0.05。
截骨组中1例发生了髋关节脱位,而髌骨未发生脱位,3膝在屈膝状态下出现完全性的髌骨脱位,16膝在膝关节被动伸直时,髌骨发生脱位。而在软组织组中,15膝在屈膝状态下出现完全性的髌骨脱位,5膝未发生髌骨脱位。
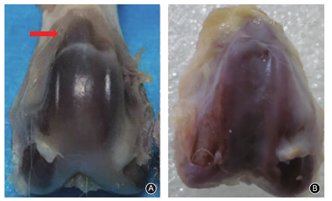
截骨组的股骨滑车在滑车入口处伴有局部的突起形成,称为"骨突",入口以远的滑车变宽和变浅,而滑车关节面比较光滑,未出现明显的软骨破裂等。而软组织组的股骨滑车未见"骨突"形成,滑车变宽和变浅,滑车关节面出现软组均裂、缺损等关节炎表现(图4)。

截骨组与其对照组的滑车沟高度相对值分别为0.94±0.04和0.92±0.04,内侧髁高度相对值为0.97±0.38和0.97±0.43,外侧髁高度相对值为0.97±0.07和0.99±0.04。截骨组与对照组相比滑车沟高度增加了0.02,差异有统计学意义(t=3.130,P=0.006);内侧髁高度和外侧髁高度均无统计学差异(图5)。
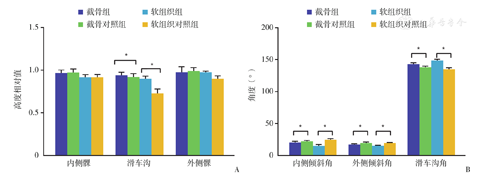

软组织组与其对照组的滑车沟高度相对值为0.90±0.03和0.73±0.05,内侧髁高度相对值为0.92±0.03和0.92±0.03,外侧髁高度相对值为0.98±0.03和0.94±0.03。与对照组相比,滑车沟高度增加了0.17,差异有统计学意义(t=9.104,P=0.000);内侧髁高度和外侧髁高度无统计学差异。
截骨组与其对照组的滑车沟角为142.90°±2.43°和138.26°±1.57°,滑车内侧倾斜角为20.49°±1.81°和22.30°±1.33°,滑车外侧倾斜角为17.40°±1.19°和19.56°±1.54°。与对照组相比,滑车沟角增大4.64°,差异有统计学意义(t=7.477,P<0.001);滑车内侧倾斜角减小了1.81°,差异有统计学意义(t=-9.985,P<0.001);滑车外侧倾斜角减小了2.16°,差异有统计学意义(t=-4.683,P<0.001)。这表明截骨组股骨滑车沟发育变浅、变平(图5)。
软组织组与其对照组的滑车沟角为149.31°±3.55°和135.39°±3.28°,滑车内侧倾斜角为17.11°±1.80°和25.19°±2.92°,滑车外侧倾斜角为16.48°±3.97°和23.01°±10.44°。与对照组相比,滑车沟角增加13.92°,差异有统计学意义(t=9.110,P<0.001);滑车内侧倾斜角减小8.08°,差异有统计学意义(t=-9.279,P<0.001);外侧倾斜角减小6.35°,,差异有统计学意义(t=-2.131,P=0.037)。这表明软组织组股骨滑车沟同样发育变浅、变平。
截骨组和软组织组相比较,二组滑车高度和滑车角度方面的差异均无统计学意义。
截骨组与其对照组的骨体积分数在内侧髁为20.89%±4.89%和22.90%±6.19%,外侧髁为19.55%±5.82%和20.84%±4.57%;骨小梁厚度在内侧髁为(0.15±0.05)mm和(0.12±0.03)mm,外侧髁为(0.14±0.04)mm和(0.11±0.04)mm;骨小梁数量在内侧髁为(1.12±0.35)个/mm和(1.53±0.30)个/mm,外侧髁为(1.23±0.31)个/mm和(1.38±0.36)个/mm;骨小梁分离度内侧髁(0.53±0.19)mm和(0.41±0.19)mm,外侧髁为(0.51±0.21)mm和(0.39±0.18)mm;骨密度在内侧髁为0.31±0.16和0.33±0.18,外侧髁为0.29±0.21和0.32±0.12(表1)。
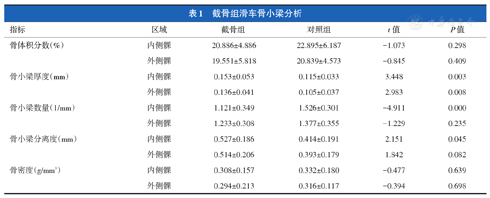
截骨组滑车骨小梁分析
截骨组滑车骨小梁分析
| 指标 | 区域 | 截骨组 | 对照组 | t值 | P值 |
|---|---|---|---|---|---|
| 骨体积分数(%) | 内侧髁 | 20.886±4.886 | 22.895±6.187 | -1.073 | 0.298 |
| 外侧髁 | 19.551±5.818 | 20.839±4.573 | -0.845 | 0.409 | |
| 骨小梁厚度(mm) | 内侧髁 | 0.153±0.053 | 0.115±0.033 | 3.448 | 0.003 |
| 外侧髁 | 0.136±0.041 | 0.105±0.037 | 2.983 | 0.008 | |
| 骨小梁数量(1/mm) | 内侧髁 | 1.121±0.349 | 1.526±0.301 | -4.911 | 0.000 |
| 外侧髁 | 1.233±0.308 | 1.377±0.355 | -1.229 | 0.235 | |
| 骨小梁分离度(mm) | 内侧髁 | 0.527±0.186 | 0.414±0.191 | 2.151 | 0.045 |
| 外侧髁 | 0.514±0.206 | 0.393±0.179 | 1.842 | 0.082 | |
| 骨密度(g/mm3) | 内侧髁 | 0.308±0.157 | 0.332±0.180 | -0.477 | 0.639 |
| 外侧髁 | 0.294±0.213 | 0.316±0.117 | -0.394 | 0.698 |
与对照组相比,截骨组的骨小梁厚度在内侧髁和外侧髁分别增加0.03 mm,差异均有统计学意义(t=3.448,P=0.003;t=2.983,P=0.008);骨小梁数量在内侧髁减少了0.41个/mm,差异有统计学意义(t=4.911,P=0.000);而骨体积分数、骨小梁分离度、骨密度以及骨小梁数量(外侧髁)的差异均无统计学意义,显示截骨组滑车骨小梁发生汇聚现象。
软组织组与其对照组的骨体积分数在内侧髁为14.75%±0.75%和22.14%±5.54%,外侧髁为15.37%±0.54%和21.54%±4.55%;骨小梁厚度在内侧髁为(0.11±0.01)mm和(0.15±0.01)mm,外侧髁为(0.11±0.05)mm和(0.15±0.01)mm;骨小梁数量内侧髁为(1.00±0.10)个/mm和(1.51±0.30)个/mm,外侧髁为(1.08±0.06)个/mm和(1.35±0.39)个/mm;骨小梁分离度内侧髁为(0.95±0.04)mm和(0.45±0.08)mm,在外侧髁为(0.95±0.10)mm和(0.41±0.20)mm;骨密度在内侧髁为0.15±0.02和0.38±0.04,外侧髁为0.17±0.04和0.36±0.04(表2)。
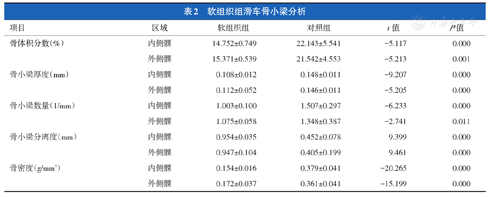
软组织组滑车骨小梁分析
软组织组滑车骨小梁分析
| 项目 | 区域 | 软组织组 | 对照组 | t值 | P值 |
|---|---|---|---|---|---|
| 骨体积分数(%) | 内侧髁 | 14.752±0.749 | 22.143±5.541 | -5.117 | 0.000 |
| 外侧髁 | 15.371±0.539 | 21.542±4.553 | -5.213 | 0.001 | |
| 骨小梁厚度(mm) | 内侧髁 | 0.108±0.012 | 0.148±0.011 | -9.207 | 0.000 |
| 外侧髁 | 0.112±0.052 | 0.146±0.011 | -5.205 | 0.000 | |
| 骨小梁数量(1/mm) | 内侧髁 | 1.003±0.100 | 1.507±0.297 | -6.233 | 0.000 |
| 外侧髁 | 1.075±0.058 | 1.348±0.387 | -2.741 | 0.011 | |
| 骨小梁分离度(mm) | 内侧髁 | 0.954±0.035 | 0.452±0.078 | 9.399 | 0.000 |
| 外侧髁 | 0.947±0.104 | 0.405±0.199 | 9.461 | 0.000 | |
| 骨密度(g/mm3) | 内侧髁 | 0.154±0.016 | 0.379±0.041 | -20.265 | 0.000 |
| 外侧髁 | 0.172±0.037 | 0.361±0.041 | -15.199 | 0.000 |
与对照组相比,软组织组骨体积分数在内侧髁和外侧髁分别减小7.39%和6.17%,差异均有统计学意义(t=-5.117,P=0.000;t=-5.213,P=0.001);骨小梁厚度均减小0.04 mm,差异均有统计学意义(t=-9.207,P=0.000;t=-5.205,P=0.000);骨小梁数量分别减少0.51个/mm和0.27个/mm,差异均有统计学意义(t=-6.233,P=0.000;t=-2.741,P=0.011);骨小梁分离度分别增大0.50 mm和0.54 mm,差异均有统计学意义(t=9.399,P=0.000;t=9.461,P=0.000);骨密度分别减低0.23和0.19,差异均有统计学意义(t=-20.265,P=0.000;t=-15.199,P=0.000)。这说明软组织组滑车骨小梁发生明显的疏松现象。
而与截骨组相比,软组织组股骨内侧髁和外侧髁的骨体积分数分别减小6.13%和4.18%,差异均有统计学意义(t=4.930,P=0.000;t=2.837,P=0.000);骨小梁厚度分别减小0.05 mm和0.02 mm,差异均有统计学意义(t=3.333,P=0.002;t=2.611,P=0.013);骨小梁数量分别减小0.12个/mm和0.16个/mm,差异均有统计学意义(t=1.304,P=0.000;t=2.052,P=0.041);骨小梁分离度均增大0.43 mm,差异均有统计学意义(t=-9.295,P=0.000;t=-7.686,P=0.000);骨密度分别减低0.15和0.12,差异均有统计学意义(t=3.879,P=0.000;t=2.248,P=0.031)。这说明软组织组滑车骨小梁更加疏松(图6)。
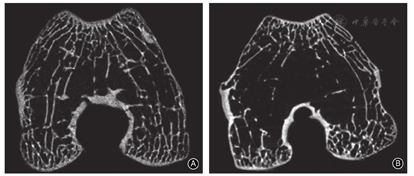

截骨组手术完成后,检测髌骨的运动轨迹。髌骨在伸直的终末期可出现髌骨的外移甚至脱位,在屈曲的过程中,髌骨会滑入股骨滑车。这复制了复发性髌骨脱位中"J"形征的表现,即伸膝终末阶段髌骨突然出现外侧移位。"J"形征预示髌骨脱位的复杂性,髌骨脱位多合并骨性危险因素。股骨前倾角增大、膝关节扭转角增大和高位髌骨是复发性髌骨脱位出现"J"形征的独立危险因素[3,9]。本研究中16膝(80%)在膝关节被动伸直时,髌骨发生脱位,3膝(15%)在屈膝状态下出现完全性的髌骨脱位。
而软组织手术完成后,髌骨在屈伸过程中不能复位于股骨滑车沟内,造成完全性髌骨脱位。内侧髌股韧带的最大约208 N的张力强度,最大位移为26 mm,而髌骨脱位中的髌骨外移远>26 mm,因此,急性髌骨脱位中内侧髌股韧带完全损伤[21]。由于内侧髌股韧带损伤的类型及其愈合能力的不同,内侧髌股韧带的功能失效会致复发性髌骨脱位。本研究模拟内侧髌股韧带损伤在复发性髌骨脱位中的基本病理,术后15膝(75%)在屈膝状态下出现完全性髌骨脱位,5膝(25%)未发生完全性髌骨脱位。
在截骨组中,增大股骨的前倾角可以导致在股骨滑车近端伴有局部骨突形成,内外侧髁局部骨小梁厚度增加,内侧髁骨小梁数量减少。滑车局部的变化是股骨前倾角增加后髌股关节之间压力改变的结果。
髌股关节压力会随着股骨前倾角增大而发生相应改变。股骨前倾角增大后,髌骨发生外移,外侧髌股关节间的压力要明显高于内侧面[22]。股骨旋转增加5°和10°时,髌股关节软骨的垂直压力增加26%和36%,剪切压力增加25%和30%[23]。当股骨旋转增加20°~30°时,髌股关节压力明显增加[24]。
滑车发育不良的原因存在争议,大体上分三种原因:①基因决定;②在胎儿期或儿童期的应力刺激;③基因和应力刺激相结合。一些研究通过观察家族性性髌骨脱位提出滑车形态由基因决定[25,26],而一些研究通过动物实验证实了后天的应力刺激因素的作用[10,11,12]。本研究证实了应力改变在滑车发育不良中的作用。本研究结果与影像学的分析相一致:滑车形态受到股骨前倾角的影响,前倾角越大,滑车越扁平,发育不良程度越严重[2,16]。本研究发现在滑车的近端有骨突的形成,这类似于滑车发育不良中的"滑车上突起"征象[27],在屈曲过程中,局部的突起可能阻止髌骨顺利滑入股骨滑车沟。
股骨前倾角增大后,滑车局部的骨小梁也发生相应变化,表现为内外侧髁局部骨小梁厚度增加,内侧髁骨小梁数量减少。股骨前倾增大后,由于髌股关节匹配性的改变,致髌股关节压力增加,外侧明显大于内侧[22,23],髌股关节之间的接触中心会明显外移[6,7]。这种力的不均衡转移会引起软骨下骨和松质骨的重塑,导致了骨小梁结构相应的变化。
软组织模型,即软组织失衡中髌骨脱位后,股骨滑车发育变浅变平的现象。Huri等[10]通过切开松解内侧的髌股韧带、髌半月板韧带、髌胫韧带和关节囊等所有髌骨内侧软组织结构来制造髌骨脱位模型。Li等[11]重叠缝合外侧关节囊来达到髌骨屈伸过程中完全脱位,来制造髌骨脱位模型。Wang等[12]采取内侧软组织松解和外侧支持带重叠缝合等方式,通过内侧软组织松解合并外侧支持带重叠缝合而导致的髌骨脱位后会导致滑车发育变平和变浅。本研究中软组织模型中也观察到了相似的结果,这也符合髌骨脱位的最常见的病理特征。
髌骨周围内外侧支持带间的张力会相互影响,共同构成"髌骨软组织环"。外侧支持带松解后,内侧软组织维持髌骨稳定性的能力也随之降低,内侧支持带的张力也减小,在屈膝的早期(0°~30°)外推髌骨外移10 mm所需力量较正常少14%~20%[28]。生物力学研究亦证实在内侧髌股韧带切断以后,髌股关节之间的平均压力和最大峰压力都较正常状态下明显下降。髌骨脱位的软组织模型,通过松解内侧支持带结构,破坏了"软组织环"结构的完整性,髌股关节之间的压力也随之减小[6,7]。
在软组织模型中,由于髌股关节之间压力的下降;内侧软组织松解后,髌骨完全性脱位,髌骨功能障碍引起活动量的减少;以及关节切开术导致局部炎症反应刺激等因素,滑车局部的骨小梁结构发生了类似骨质疏松模式的改变:骨小梁厚度、骨体积分数和骨小梁数量减少,骨小梁距离增加。而由于骨小梁的骨质疏松,易发骨小梁显微骨折,局部血肿,释放炎症因子,引起软骨退变,发生骨关节炎;骨小梁显微骨折致使关节处力线改变,长时间累及造成受力较大的部分软骨发生塌陷,继而再次影响力线,形成恶性循环,最终发生软骨损坏[29,30],因此在软组织模型中,滑车出现了软骨的均裂、缺损等骨关节炎的表现。临床研究业已证实骨质疏松症与退行性膝骨关节炎存在正相关性[30]。
本研究也存在一些局限性:①尽管兔子是膝关节常用的实验模型,但是其日常屈曲状态不能完全模拟人的伸直形态,而复发性髌骨脱位一般发生在膝关节伸直状态;②股骨截骨术的方位、角度以及内侧软组织松解程度等差异,致术后髌骨脱位程度存在差异性。下一步对于手术操作标准化将会增加实验结果的一致性;③本研究中未进行关节软骨及相关的分子机制的研究,未来结合相关研究,可更好地研究滑车发育的机制;④本研究考虑手术安全性和可操作性,应用了3个月龄实验兔,在术后观察了4个月。未来更娴熟的手术操作和精细的手术工具能够应用更小的实验动物,以便获取术后更长的观察时间,可能会获得更显著的实验结果。



























