
探讨新型3D打印个体化人工椎体在脊柱重建中的优势,并对其重建效果进行临床评估。
收集2017年1月至2018年12月行全椎体切除术后采用3D打印个体化人工椎体行脊柱重建的15例肿瘤患者的临床资料,其中男8例,女7例;年龄(39.5±13.4)岁(范围:20~57岁)。原发肿瘤12例,转移肿瘤3例。依据肿瘤位置及周围软组织侵及范围,采取单纯后路或前后路联合手术方式行全椎体切除,并进行3D打印人工椎体重建。分析手术时间、术中出血量、术后人工椎体稳定情况、与相邻椎体骨长入情况,手术前后神经功能改变情况、疼痛视觉模拟评分(visual analogue scale,VAS),局部控制情况及患者生存情况。
本组15例的手术时间(412.0±166.1)min(范围:135~740 min);术中出血量(4 140.0±3 809.3)ml(范围:100~14 000 ml);术后随访(23.2±7.0)个月(范围:12~35个月)。术前VAS评分(4.7±1.1)分,术后7 d(1.6±0.6)分,末次随访时(1.0±0.5)分,术后7 d及末次随访较术前的差异均有统计学意义(P<0.001)。术后7 d术前Frankel分级C级的3例逐渐恢复到D级,余12例D级和E级无变化,差异无统计学意义(Z=-1.732,P=0.083);术后末次随访时Frankel分级较术后7 d无明显变化。影像学表现:术后3个月时人工椎体与临近椎体已有初步的骨愈合;术后12个月时人工椎体和邻近椎体有大量骨连接形成,形成骨整合;术后24个月时可见人工椎体与邻近椎体骨整合更加确实。在随访期内人工椎体无松动移位,内固定无断裂失效。术中1例出现胸膜破裂,术后1例发生脑脊液漏,1例出现L5神经根麻痹,积极对症处理后均痊愈。1例血管内皮细胞瘤和1例上皮样血管肉瘤,分别于术后33个月和35个月死亡,1例软骨肉瘤术后16个月局部复发,服用安罗替尼治疗,肿瘤无进展,余12例无肿瘤复发及远处转移。
利用3D打印个体化人工椎体对脊柱肿瘤切除后重建,有利于精确恢复脊柱连续性,提供更好的界面匹配,利于骨的长入,同时人工椎体植入后即刻及远期稳定性良好,可满足脊柱重建的需要。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着人口平均寿命的不断提高,脊柱肿瘤的发病率逐年增高,其主要分为原发性肿瘤和转移性肿瘤。原发脊柱肿瘤非常少见,约占所有骨肿瘤的4.6~8.8%,脊柱转移瘤占全身骨转移瘤的50%[1]。根据脊柱肿瘤性质不同,外科治疗包括:椎体成形术、椎板减压肿瘤部分切除术以及脊椎肿瘤整块切除术等方式。其中脊椎整块切除术(total en bloc spondylectomy,TES)对肿瘤切除最为彻底,能获得良好的手术切除边界,为脊柱恶性肿瘤治疗提供了一个较为理想的方法,提高了脊柱肿瘤的治疗效果[2,3]。TES手术在提高脊柱原发及孤立转移肿瘤切除率和降低肿瘤局部复发率上,相对于单纯减压手术有着明显的优势,同时患者的远期生存时间也得到了延长[4,5]。特别是近年来随着肿瘤辅助治疗技术的不断提高,TES技术被更加广泛的应用于脊柱肿瘤的治疗,形成了较为完善的治疗流程,取得比较满意的疗效[6]。但TES创伤较大,切除了脊椎所有骨性结构、韧带和椎间盘组织,破坏了脊柱连续性,使脊柱彻底失稳,因此恢复脊柱连续性,重建脊柱稳定性尤为重要。
目前TES术后脊柱重建的方法很多,钛网和人工椎体是目前采用最为广泛的两种方法,但是二者在重建脊柱缺损中均存在不同程度的缺陷[7,8,9]。使用钛网重建椎体切除后脊柱缺损,其优点在于可提供良好的前柱支撑,同时有较大的植骨床,配合椎间植骨融合,可获得满意的疗效。但由于钛网与上下终板植骨面是点接触模式,因而容易发生应力集中,导致钛网陷入终板,从而出现钛网的下沉、松动、甚至塌陷或脊柱畸形等并发症的发生[10,11,12]。同时由于内固定失败或者继发的神经损害表现,使得患者可能需要接受非肿瘤引起的二次手术。因此良好的椎间支撑,确实的椎间融合是解决这一问题的唯一办法。人工椎体虽然可实现肿瘤切除后椎体间的良好支持,避免了钛网与临近椎体之间的应力集中,提高了人工椎体的稳定性和长期生存能力。但是其仍然无法实现个体化精准化的重建,特别是在上颈椎、骶骨等特殊部位无法实现对脊柱切除肿瘤后的重建,限制了其的进一步应用。
为了解决这一临床问题,新型的3D打印个体化人工椎体开始在临床尝试使用,理论上有诸多优势,解剖形态匹配好,界面接触紧密,即刻稳定性好,应力支持强,生物稳定性好,同时还可恢复脊柱的生理曲度等。上述优势使3D打印个体化人工椎体可能成为TES术后进行脊柱重建的优选方式。但是目前相关研究较少,其是否能够真正实现精准、稳定的脊柱重建,以及其在临床使用中可能存在的问题还需进一步研究来证实。
本研究通过椎体全切手术并利用3D打印人工椎体重建脊柱的方式治疗脊柱单发或相邻节段原发、转移肿瘤,分析临床疗效、影像学表现以及并发症情况。目的在于:①评价3D打印个体化人工椎体对于TES术后脊柱重建的疗效;②分析3D打印个体化人工椎体对于脊柱重建的优势;③探讨3D打印个体化人工椎体的设计基本原则。
纳入标准:①经MR检查及全身骨扫描检查明确诊断为脊柱单发或相邻节段原发、转移肿瘤的患者;②采用椎体全切手术治疗,并接受3D打印人工椎体重建脊柱;③主要观察指标为视觉模拟评分(visual analogue scale,VAS)、Frankel脊髓损伤分级、人工椎体及内固定系统稳定情况、人工椎体与邻近椎体的植骨融合情况;④回顾性病例研究。
排除标准:①非相邻节段的脊柱多发原发、转移肿瘤者;②有肺部或其他脏器的转移者;③预期生存期<6个月者;④随访资料不全或随访时间<12个月者。
依据上述纳入及排除标准,收集2016年1月至2018年12月共15例在西京医院骨肿瘤骨病科接受3D打印人工椎体脊柱重建患者资料纳入本研究,其中男8例,女7例;年龄(38.69±12.40)岁(范围:22~57岁)。
15例中原发肿瘤12例(80%,12/15):2例骨肉瘤(分别位于L1和L5),2例骨巨细胞瘤(分别为T12骨巨细胞瘤术后复发和L4骨巨细胞瘤),2例软骨肉瘤(T5软骨肉瘤术后复发和T11~L1软骨肉瘤),1例C2混合型血管内皮瘤,1例C2椎体纤维瘤,1例C7动脉瘤样骨囊肿合并病理骨折,1例T6骨母细胞瘤术后复发,1例T7,8上皮样血管肉瘤,1例L2侵袭性血管瘤;转移肿瘤3例(20%,3/15):1例T5肾癌转移,1例T4食道癌转移,1例L5甲状腺癌转移。3例颈椎患者通过手术获取标本确定病理诊断,其余12例患者行术前穿刺活检获取病理诊断,并于术中获取手术标本行术后常规病理进一步确定病理诊断。
本组15例患者均有不同程度的疼痛表现,术前VAS评分(4.7±1.1)分(范围:3~7分);6例(40%,6/15)下肢感觉肌力下降,Frankel脊髓损伤分级:C级3例(20%,3/15),D级3例(20%,3/15),E级9例(60%,9/15)。15例的脊柱肿瘤不稳定评分(spinal instability neoplastic score,SINS)评分(11.0±2.4)分(范围:8~15分)。术前所有患者均行X线,CT,MR及全身骨扫描检查。
本研究报第四军医大学西京医院伦理委员会批准通过(XJLL20140023),所有纳入患者均签署相关知情同意书。
术前24 h在局麻下经股动脉行肿瘤血管选择性栓塞术,除颈椎及上胸椎动脉栓塞风险较大未行栓塞术,下胸椎及腰椎肿瘤均行血管栓塞术,以减少术中出血。
术前根据患者的CT扫描及MR检查的影像学资料,计划手术切除范围,而后设计适合患者的个体化人工椎体。
将肿瘤切除后邻近椎体半径减少1~2 mm做为3D打印人工椎体的半径;以肿瘤切除后上、下相邻椎体之间的距离(切除椎体的范围和上下相邻椎间盘的高度之和)作为人工椎体的高度;根据脊柱肿瘤位置,依据生理曲度,设计人工椎体曲度,并对人工椎体进行中部收腰设计;而后将实体人工椎体进行网格化多孔处理(孔径600~800 μm、孔隙率70%~80%),最后进行人工椎体打印。
通常术前制备3D打印模型,更加直观的了解肿瘤侵及的范围,以及周围比邻重要的血管、脏器,对于肿瘤切除有一定的指导意义。同时在模型上还可以模拟肿瘤切除后,3D打印人工椎体重建脊柱的情况,实现术前精准了解假体重建即刻效果(图1)。
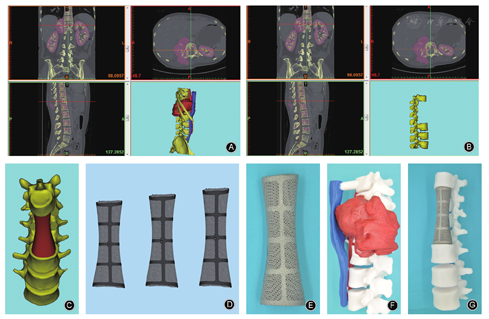

对于3D打印个性化人工椎体的尺寸设计主要考虑两方面因素:①切除椎体邻位终板的大小;②切除椎体加上重建节段涉及的所有椎间盘的高度(如2个椎体切除重建高度需包含3个椎间盘的高度)。为便于人工椎体安放,终板界面在保证解剖匹配的前提下适当缩小周边尺寸,通常为1~2 mm。人工椎体的高度设计需根据肿瘤切除范围和生理曲度恢复来确定,当骨质破坏严重或已发生病理骨折塌陷时,可参考上下正常椎体的高度进行设计。对于运动节段椎体高度的把控有时不是很准确,特别是当体位变换或已有后方固定时,人工椎体高度可能需增加或降低。因此,在初期设计时,最好设计3个相差2 mm的不同高度的人工椎体以备使用。
根据术前MR扫描和CT检查结果,确定手术方式。通常采用单纯后路行TES手术,但是对于颈椎及L5肿瘤建议采用前后路联合方式行TES手术,对于椎旁有巨大软组织肿瘤的患者,必要时还要行辅助切口。
单纯后路手术8例(53.3%):取后正中切口,显露后双侧椎板及小关节突后,置入椎弓根钉。分块切除病椎的后方结构,分开胸膜或腰大肌,结扎或电灼椎体节段供血血管,沿病椎两侧向椎体腹侧分离,直至病椎与周围组织被完全分离。安装单侧临时固定棒,用骨刀线锯,切断受累椎体上、下方椎间盘和软骨板,椎体游离完全后,绕硬膜囊旋转取出。刮除残留椎间盘,而后安装术前设计的3D打印个体化人工椎体,实现术中精确重建。
后前路联合手术4例(26.7%):先通过后正中切口显露病椎及临近椎体,而后根据需要置入螺钉,分块切除病椎后方结构,行后方固定。改为侧位,行胸腹联合切口或腹膜后斜切口显露病椎,分块切除病椎及病椎临近椎间盘,处理终板后,置入3D打印个体化人工椎体,行或不行侧前方固定。
前后路联合手术3例(20%):主要针对颈椎肿瘤,行颈前路切口,沿颈动脉与气管食管间隙显露病椎,分块切除病椎及临近椎间盘组织,处理终板后,置入3D打印个体化人工椎体,基于人工椎体预制固定孔,置入螺钉固定人工椎体。而后行后正中切口,切除病椎后方结构,置入螺钉行后方固定。
所有患者手术均由同一组脊柱肿瘤医生完成。
患者术后卧床2周,佩戴支具下地活动。3例转移瘤、2例软骨肉瘤、1例血管内皮瘤、1例上皮样血管肉瘤接受术后放疗;2例骨巨细胞瘤接受地诺塞麦和放疗联合治疗;2例骨肉瘤接受放疗及化疗治疗,化疗药物为顺铂,阿霉素,异环磷酰胺。余4例未行特殊处理。
记录患者手术时间、术中出血量及手术并发症情况。所有患者于术后1,3,6,12个月随访,此后每6个月随访1次,以复查的形式随访。每次复查摄脊柱X线片,并行脊柱CT扫描及三维重建以及胸部CT扫描,每6个月复查全身骨扫描、主要脏器B超。以判断人工椎体稳定性、植骨融合情况以及患者转归情况,并于患者术后7 d进行VAS评分,神经功能评分等。
观察人工椎体在脊柱正侧位X线片上的位置,与术后即刻X线片进行对比,确定人工椎体是否发生移位,如有发生,测量移位的距离和角度。观察内固定系统是否有螺钉松动、退钉、断钉、断棒。
通过三维CT观察人工椎体与邻近椎体骨愈合随着时间推移的变化情况,观察人工椎体与邻近椎体终板融合情况。
通过以下方法评价患者的转归情况:①行胸部CT扫描观察是否发生肺部转移;②行全身骨扫描及主要脏器的B超,筛查全身转移情况。
采用VAS评分对患者术前、术后7 d及末次随访时进行疼痛程度评分,评价疼痛改善情况。具体方法:在纸上面划一条10 cm的横线,横线的一端为0,表示无痛;另一端为10,表示剧痛;中间部分表示不同程度的疼痛。嘱患者根据自我感觉在横线上划一记号,表示疼痛的程度。
采用Frankel脊髓损伤分级对患者的术前、术后7 d以及末次随访时进行Frankel脊髓损伤分级,评价神经功能恢复情况。Frankel脊髓损伤分级:A级,平面以下深浅感觉完全消失,肌肉运动功能完全消失;B级,损伤平面以下运动功能完全消失,仅存某些包括骶区感觉;C级,损伤平面以下仅有某些肌肉运动功能,无有用功能存在;D级,损伤平面以下仅有某些肌肉运动功能,无有用功能存在;E级,深浅感觉、肌肉运动及大小便功能良好,可有病理反射。A级为完全性损伤,E级为基本正常。
采用SPSS 17.0(IBM公司,美国)统计软件包进行统计学处理,计量资料采用( ±s)表示,采用t检验对比患者术前及术后的VAS评分;等级资料采用Wilcoxon符号秩检验评价患者手术前后Frankel脊髓损伤分级变化情况。检验水准α值取双侧0.05。
±s)表示,采用t检验对比患者术前及术后的VAS评分;等级资料采用Wilcoxon符号秩检验评价患者手术前后Frankel脊髓损伤分级变化情况。检验水准α值取双侧0.05。
本组所有患者均行病椎切除3D打印人工椎体修复重建术,均顺利完成手术。其中单纯后路手术8例(53.3%),后前路联合手术4例(26.7%),前后路联合手术3例(20%)。术中无脊髓损伤,术后伤口愈合良好。15例的手术时间(412.0±166.1)min(范围:135~740 min),术中出血量(4 140.0±3 809.3)ml(范围:100~14 000 ml)。
15例随访(23.2±7.0)个月(范围:12~35个月),随访期内患者无失访。
本组15例患者均根据术前计划完整切除脊柱肿瘤,并依术前设计成功安装3D打印人工椎体,其中2例患者(13.3%,2/15)采用术前设计中最短的人工椎体(2例C2),7例(46.7%,7/15)采用和术前设计中间长度的人工椎体(1例C7、1例T4、2例T5、1例L4、2例L5),6例(40%,6/15)采用比术前设计中最长的人工椎体(1例T12、1例L1,1例L2,3例多节段T5-7、T7-8、T11~L1)。通过使用最适宜长度人工椎体,使得脊柱肿瘤切除后的缺损与人工椎体实现精确匹配。
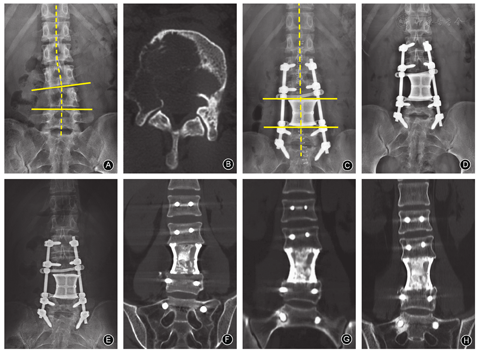
至末次随访期,15例的脊柱X线片示3D打印人工椎体与相邻上、下椎体匹配良好,固定确实,无松动、下沉及移位,未出现螺钉移位、断钉、断棒,内固定失败情况。同时3D打印人工椎体对脊柱生理曲度恢复情况良好,并且随着时间推移恢复的生理曲度并没有发生丢失(图2C,图2D, 图2E)。

15例术前VAS评分(4.7±1.1)分,术后7 d的VAS评分(1.6±0.6)分,较术前低2.9分,两者的差异有统计学意义(t=9.582,P<0.001);末次随访时为(1.0±0.5)分,较术后7 d进一步降低0.6分,与术前的差异有统计学意义(t=11.860,P<0.001),与术后7 d的差异亦有统计学意义(t=2.975,P=0.006)。
15例术前Frankel分级C级的3例术后7 d恢复到D级,D级和E级患者无明显变化,出院时的Frankel分级较术前无统计学差异(Z=-1.732,P=0.083);末次随访时,除2例死亡患者,其余患者Frankel分级较术后7 d时无明显变化(表1)。
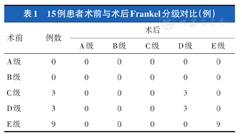
15例患者术前与术后Frankel分级对比(例)
15例患者术前与术后Frankel分级对比(例)
| 术前 | 例数 | 术后 | ||||
|---|---|---|---|---|---|---|
| A级 | B级 | C级 | D级 | E级 | ||
| A级 | 0 | 0 | 0 | 0 | 0 | 0 |
| B级 | 0 | 0 | 0 | 0 | 0 | 0 |
| C级 | 3 | 0 | 0 | 0 | 3 | 0 |
| D级 | 3 | 0 | 0 | 0 | 3 | 0 |
| E级 | 9 | 0 | 0 | 0 | 0 | 9 |
末次随访时13例(86.7%,13/15)患者存活,1例血管内皮细胞瘤和1例上皮样血管肉瘤(13.3%,2/15),分别于术后12个月和15个月出现全身多发转移,而后于术后33个月和35个月死亡。1例(6.7%,1/15)软骨肉瘤术后16个月局部复发,服用安罗替尼治疗,肿瘤无进展。其余12例(80%,12/15)患者无肿瘤复发及远处转移。
本组1例术中出现脑脊液漏,修补后采用明胶海绵封闭,术后持续引流,延长引流管拔管时间至术后1周,局部加压等对症处理后痊愈。1例术中切除部分胸膜及膈肌,给予明胶海绵筋膜覆盖,置入胸腔闭式引流管,术后1周拔除后无不良反应。1例术后出现L5神经根支配区域感觉减退,给予神经营养,脱水药物对症处理后,术后2周逐渐恢复正常。1例肋间神经痛患者,未行特殊处理,术后1个月疼痛缓解。
近年来随着数字化技术在骨科越来越广泛的应用[13,14,15],特别是3D打印技术的不断发展,使个体化人工椎体重建脊柱骨缺损成为可能。本研究采用具有独立自主知识产权的个体化、功能化3D打印人工椎体,其主要特色:①良好的解剖外形,保证其与上下椎体的良好匹配;②多孔结构使其更利于骨的早期长入;③框架支撑使得人工椎体有更好的支持强度;④中空植骨有利于与临近椎体的早期融合;⑤顶盖分散应力避免局部的应力集中,提高了人工椎体的即刻稳定性,减少远期假体下沉风险。
通过使用个体化、功能化的3D打印人工椎体对脊柱进行重建,术后即刻X线片示3D打印人工椎体与邻近椎体上下终板接触紧密,位置良好,准确的恢复了脊柱的连续性,实现了脊柱肿瘤TES术后脊柱即刻的稳定性。同时患者VAS疼痛评分明显下降,术后(1.6±0.6)分及末次随访(1.0±0.5)分较术前(4.7±1.1)分患者疼痛明显改善。Frankle分级C级的3例术后7 d恢复到D级,末次随访时,除2例死亡,余患者Frankel分级无明显变化,取得了预期的治疗效果。在术后3个月时,人工椎体与临近椎体已有初步的骨愈合,体现了人工椎体良好的生物相容性;术后12个月时人工椎体与邻近椎体大量骨性连接形成,发生骨整合,表明人工椎体可以达到椎体间融合的要求,最终实现脊柱前柱的融合。多孔结构的构型有利于骨的长入[17]。本研究中使用的3D打印人工椎体,其自身具有多孔结构,孔径600~800 μm、孔隙率70%~80%,使得人工椎体更适宜骨长入,与邻近椎体形成良好的骨接触,最终发生骨整合,真正实现了脊柱坚强的前方融合。
本研究团队在前期三维有限元模拟研究中,发现新型3D打印人工椎体在恢复脊柱稳定性上,降低假体松动、内固定失败的发生几率[18]。本研究中无论是即时还是随访期内,3D打印人工椎体位置良好,无移位、下沉,同时在随访期内未出现断钉、断棒等内固定失败相关并发症,体现了人工椎体优良的机械性能。为其在脊柱重建领域的进一步应用打下了坚实的基础。
3D打印人工椎体最大的优势在于通过术前精准的手术设计和术中精细的操作,可实现精确重建椎体肿瘤切除后所造成的缺损,使人工椎体在植入后,最大限度与上下椎体贴附,获取最大的接触面积,从而实现早期的即刻稳定,同时由于其对于上下椎体的良好匹配,对于由于病椎破坏所导致局部的后凸、侧凸畸形也有一定的矫正作用。Choy等[19]利用3D打印人工椎体用于治疗1例T9病理性骨折并发后突畸形的患者,取得满意疗效,3个月患者正常活动,6个月时人工椎体与上下椎体形成骨整合。本组中3D打印人工椎体置入后,也对由于相应椎体塌陷造成的侧凸畸形进行了矫正。
对于多节段的椎体切除后缺损的重建,3D打印人工椎体可大大降低假体塌陷,松动的风险,其优势体现得更加显著。Yoshioka等[20]研究发现钛网重建3个或3个以上椎体切除后的缺损,22例中11例均发生>2 cm的钛网沉降,8例发生于术后1个月。本组2例行3节段椎体切除人工椎体重建,1例骨母细胞瘤随访期内无局部复发,人工椎体无松动。另1例软骨肉瘤虽然在术后16个月发生了局部复发,但是在随访期内未出现假体的松动和移位。
对于特殊位置不规则椎体缺损后重建,3D打印人工椎体的也有着其独特的优势。刘忠军等[21]报告1例C2尤文肉瘤切除后,采用个体化人工椎体进行重建,术后1年局部无复发,远处无转移,人工椎体与邻近椎体发生骨整合。Mobbs等[22]报告1例C2脊索瘤切除后,采用个体化人工椎体进行重建,术后9个月随访时假体无松动移位,达到骨整合。本组1例C2骨巨细胞瘤的患者,通过个体化设计的人工椎体,重建了C2切除后的缺损,实现了支撑、固定、匹配、融合一体化,但是其不足在于未能矫正上颈椎的反曲,远期效果还需继续观察。郭卫等[23]报告1例骶骨脊索瘤利用个性化人工骶骨重建骶骨缺损,术后8个月患者假体发生断钉,但是患者无不适,术后1年活动情况良好,无骶髂关节不稳感觉。Kim等[24]报告1例骶骨骨肉瘤患者,通过3D打印假体实现精准重建半骶骨,术后1年时假体位置良好,与周围骨质发生骨整合。
目前3D打印人工椎体还处于临床试验阶段,椎体的设计都是临床医生根据临床需求与工程师沟通后,进行设计生产从而用于临床,目前还处于起步阶段,其设计还没有统一的标准。Girolami等[25]设计的"肾型"3D打印人工椎体,复合连接装置与后方连接棒相连,用于13例胸、腰椎肿瘤全切后的脊柱重建,最长随访18个月,除1例局部复发内固定去除,1例发生交接性后突畸形行返修手术,余11例患者未发生人工椎体移位或内固定失败。Choy等[19]设计了可容纳2枚椎弓根螺钉的3D打印人工椎体,将其用于胸9假肌源性血管内皮瘤切除术后脊柱重建,术后6个月,人工椎体位置良好。对于特殊部位如上颈椎肿瘤[21,22,26],骶骨肿瘤[23,24]切除术后的脊柱重建,3D打印人工椎体设计更加个性化,但都取得了比较满意的效果,进一步体现了个体化打印人工椎体的临床应用优势。
基于本研究团队前期研究结果及临床应用经验,认为人工椎体的设计应该符合"7S"标准:①Shape,形状上的高度匹配,形成紧密的接触,能够实现规则及不规则部位缺损的精准重建;②Structure,实体结构与多孔结构合理分布,同时多孔孔径大小和孔隙率符合骨长入需要;③Strength,良好的生物学强度,对假体即时的支撑稳定能力及远期的疲劳断裂提供保证;④Surface,通过假体的表面处理,进一步提高假体的生物学性能,提高骨整合能力[27,28];⑤Survival,假体体内长期生存,无炎症,排异等不良反应;⑥Surgery,假体设计要考虑外科医生的可操作性,假体解剖结构不能过于复杂,必要时设计把持和定位结构利于安放;⑦Setting,假体设计要考虑初始稳定性,可以通过假体自锁和辅助固定装置使用完成,常常需要设计定制假体与传统标准化器械连接使用的结构。
本研究的有一定的局限性:①作为一个单中心回顾研究,仅仅研究了3D打印个体化人工椎体对于脊柱肿瘤切除重建后的应用效果,未能和其它重建方法进行对照研究,在未来工作中将进一步开展多中心研究,以及脊柱多种重建方法的比较研究;②随访时间较短,对于远期效果还需进一步的评估;③研究病例数量偏少,所获得数据有限,结果可能存有偏差,还需要继续增加病例延长随访时间,以获得更为客观的临床结果。
综上所述,新型3D打印个体化人工椎体用于椎体肿瘤全切后脊柱重建,较传统重建方式有一定的优势。但是无论哪种重建方式,都是基于全脊椎整块切除手术基础上,因而明确手术适应证,合理选择手术方案是手术成功的前提。通过精准的术前设计,精细的术中操作,最终实现3D打印个体化人工椎体在术中对脊柱的精确重建,最大限度提高脊柱重建后的即刻稳定性,为最终实现脊柱椎间融合打下基础。3D打印人工椎体在脊柱重建中已经展现出其巨大的优势,但目前的临床应用还处于探索阶段,最终效果如何还需更多的病例以及更长时间的观察来评价。



























