
探讨股骨头坏死骨吸收区对股骨头内应力分布及疾病进展的影响。
回顾性分析2014年4月至2018年9月诊断为ARCOⅡ、Ⅲ期股骨头坏死的患者94例(155髋),男77例,女17例;年龄(39.90±10.45)岁(范围18~64岁)。依据是否含骨吸收区将患髋分为有骨吸收区组和无骨吸收区组,比较两组ARCO分期的差异。在无骨吸收区组选取1例ARCOⅡ期髋关节,模拟5、7、10、14、18、23 mm六个不同直径大小的球形骨吸收区,通过有限元方法模拟人在慢速行走时的髋关节负重,观察分析股骨头不含骨吸收区以及含不同直径大小骨吸收区时坏死区最大应力、平均应力和骨吸收区周围1 mm区域内的最大应力值。
有骨吸收区组67髋,其中ARCOⅡ期17髋、ARCOⅢ期50髋;无骨吸收区组88髋,其中ARCOⅡ期58髋、ARCOⅢ期30髋。有骨吸收区组ARCOⅢ期比例(74.6%,50/67)明显高于无骨吸收区组(34.1%,30/88),差异有统计学意义(χ2=25.03,P=0.000)。有限元应力云图显示在骨吸收区的上方存在应力集中区;有骨吸收区组的骨吸收区周围1 mm区域内最大von Mises应力为(6.94±1.78)MPa,高于无骨吸收区组的(5.01±0.35)MPa,差异有统计学意义(t=3.139,P=0.026)。线性回归分析显示股骨头内坏死区的最大应力、平均应力以及骨吸收区周围1 mm区域内最大应力值与骨吸收区直径呈线性正相关。
骨吸收区可增加坏死区的最大应力和平均应力,骨吸收区越大应力增加越明显;骨吸收区周围可产生应力集中区,加速股骨头塌陷。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
股骨头坏死是股骨头血供中断或受损,引起骨细胞及骨髓成分死亡,随后的修复导致股骨头结构改变、股骨头塌陷、关节功能障碍的局部骨代谢异常性疾病,具体发病机制尚未完全阐明[1,2]。在股骨头坏死的病情进展过程中影像学上会出现骨密度降低、硬化带、骨吸收、新月征、关节面塌陷等改变[3],其中塌陷是股骨头坏死病情进展的重要标志。股骨头关节面塌陷可继发髋关节骨关节炎,导致严重的髋关节疼痛和功能障碍,最终不得不采用关节置换[4,5]。因此,在疾病早期识别诱发塌陷的高危因素,及时采取合适的干预措施对患者的预后具有重要意义。
引起股骨头坏死关节面塌陷的机制尚未完全明确。既往研究表明坏死区的大小和位置与塌陷密切相关,即坏死区累及范围越大、累及区域越靠近负重区,患髋塌陷的概率越高,预后越差[6]。而近年来有研究表明骨吸收区可通过破坏股骨头力学稳定性增加股骨头塌陷的风险,从而加速病情进展,影响患者的预后[7,8]。在国际骨循环研究会(Association Research Circulation Osseous Committee,ARCO)分期系统中,骨结构吸收消失并被囊性组织取代为ARCOⅡ期出现的典型表现,在X线片上表现为密度降低的透光区[3],病理研究提示骨吸收区的空腔主要被一些纤维肉芽样组织所填充[9]。伴有骨吸收区的股骨头坏死更容易出现微骨折、塌陷和新月征,提示股骨头结构不稳定,因此认为股骨头坏死骨吸收区在加重股骨头塌陷过程中起重要作用[7,8,10]。但既往研究仅观察了含有骨吸收区的ARCOⅢ期患者,也未进一步对骨吸收区加速股骨头塌陷的机制进行验证。
目前关于股骨头坏死的塌陷机制有两种假说:一种为破骨细胞活跃导致骨小梁强度降低,使其承载关节面的能力降低[11,12];另一种为修复区骨小梁增厚,使其与坏死区的骨小梁交界处产生应力集中[13]。骨吸收区内骨小梁被纤维肉芽组织取代[9],在股骨头内部形成空洞,且骨吸收区主要位于股骨头的负重区[7,9]。因此我们推测,骨吸收区会降低股骨头的负重能力,破坏股骨头正常的力学稳定性,从而加速股骨头的塌陷。
本研究回顾性分析含骨吸收区及不含骨吸收区的骨坏死髋关节的病因及分期,并通过有限元方法模拟有不同直径骨吸收区时坏死区与骨吸收区周围1 mm区域的应力分布。研究目的:①探讨骨吸收区对股骨头内应力分布的影响及在患者病情进展中的作用;②探讨股骨头坏死骨吸收区的形成机制及其对骨坏死治疗的指导作用。
本研究经解放军总医院伦理委员会批准(伦审第S2019-019-01号)。
纳入标准:①诊断为股骨头坏死;②ARCOⅡ期或ARCOⅢ期;③行髋部CT扫描;④观察ARCO分期进展及有限元应力分布。
排除标准:①患髋有手术治疗史;②坏死的股骨头合并原发性骨囊性变;③伴有髋关节骨关节炎、先天性畸形等其他髋关节疾病。
2014年4月至2018年9月因股骨头坏死于解放军总医院第一医学中心骨科康复病区门诊及住院治疗的患者120例,依纳入与排除标准纳入94例(155髋)。男77例,女17例;年龄(39.90±10.45)岁(范围18~64岁);体质指数(25.59±3.53)kg/m2(范围33.80~17.02 kg/m2);单侧坏死26例,双侧坏死68例;左侧85髋,右侧70髋;ARCOⅡ期75髋,ARCOⅢ期80髋。
所有患者均行双髋关节CT检查。CT扫描参数:层厚≤1 mm,层间距≤0.6 mm,像素大小≤0.8 mm。将CT图像以Dicom格式导入Mimics 21.0软件(Materialise,比利时),在三维视图下观察CT图像。骨吸收区内骨结构消失,CT图像上主要表现为低密度的透光区,依此确定患髋是否含有骨吸收区,并根据是否含有骨吸收区将纳入的坏死股骨头分为有骨吸收区组和无骨吸收区组。
(一)股骨头三维模型的构建:选取1例ARCOⅡ期不含骨吸收区的髋关节CT图像,CT扫描参数:电压120 kV,电流234 mA,层厚1.0 mm,扫描间隔0.6 mm,像素间距0.8 mm×0.8 mm。将原始的Dicom格式CT数据导入Mimics软件;依据灰度值(Hounsfield unit,HU)提取股骨头骨结构(HU:226~1 624),在每一CT层面手动完善股骨头结构细节;参考既往文献方法[14,15],依据硬化带的位置和坏死区与正常区骨密度不同,在每一个层面将坏死区分割出来;将分割完成的股骨头、坏死区进行三维重建,得到其立体结构,并对表面进行光滑处理,使其更加符合解剖学特点(图1)。
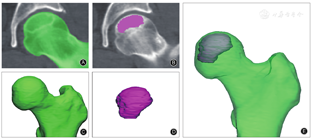

(二)模拟骨吸收区构建和装配:在三维平面视图下,于股骨头内部模拟构建骨吸收区空洞。骨吸收区的构建条件如下:①根据既往文献报道股骨头坏死骨吸收区主要位于股骨头前外侧负重区且多位于硬化带附近[7,9],设计模拟骨吸收区主体部分位于股骨头的前外侧区,且在多个CT层面均位于硬化带上;②骨吸收区与股骨头的软骨下骨板不接触;③骨吸收区周围至少存在1 mm的周围骨组织。为了使模拟骨吸收区大小符合临床特点,预先测量纳入的67髋内108个骨吸收区的大小。测量方法:在股骨头CT影像上,取骨吸收区冠状面中间位置,测量其互相垂直的长径和横径的大小,取长径和横径平均值作为骨吸收区的直径大小。测量结果显示骨吸收区直径为(9.64±4.56)mm(范围2.71~25.35 mm)。据此选择5、7、10、14、18、23 mm作为模拟骨吸收区的直径进行有限元分析,得到含有骨吸收区的股骨头三维重建模型(图2)。
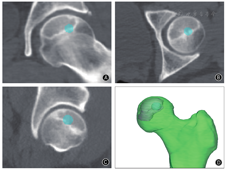

(三)网格划分和材料属性赋值:将上述建立好的模型导入3-matic 12.0(Materialise,比利时)软件进行网格划分,有限元网格采用solid 187四面体单元。所有模型平均单元数为279 516,平均节点数为382 922。在Mimics软件中对网格模型材料进行材料赋值[16,17,18,19,20]:骨组织泊松比为0.3,弹性模量依据灰度值赋值,赋值公式为:
ρ(g/cm3)=0.477+0.000 398 HU
E(MPa)=3 790 ρ3
HU为所在像素点的影像灰度值。参考既往文献,将骨吸收区组织弹性模量设为1 MPa,泊松比为0.49[21,22,23]。
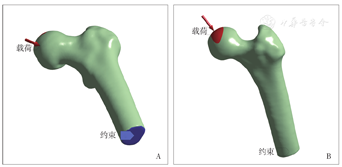
(四)约束条件和加载:在Ansys Workbench 18.0(ANSYS Inc.,美国)软件中进行有限元计算。股骨远端设置为零位移约束条件,各部件之间采用绑定接触。设置股骨头所受股骨头载荷为人体体重的2.5倍[24],股骨头与髋臼的接触面(髋关节接触力受力区)为一近似椭圆形的曲面,其范围大约与股骨头前后方向中心线成80°角、与股骨头内外方向中心线成40°角[25](图3)。通过患者体重和受力区域面积,即可根据下列公式计算股骨头表面所承受的压应力:

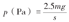
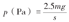
公式中m为体重,s为受力区面积,p为压应力,g=10 N/kg。该患者体重95 kg,经测量髋关节椭圆形受力区域面积为602.01 mm2,因此荷载大小设为3.945 MPa。
(一)ARCO分期:是目前临床常用的股骨头坏死分期系统。ARCOⅠ期,CT无明显异常,MRI T1像上坏死区周围出现低信号带;ARCOⅡ期,为股骨头坏死早期阶段,CT影像主要表现为硬化带形成和坏死区骨密度降低,股骨头关节面尚未塌陷;ARCOⅢ期,影像学上表现为软骨下骨折、关节面塌陷等征象,保髋治疗的成功率大幅降低[1,3];ARCOⅣ期,CT影像可见髋关节骨关节炎伴关节间隙狭窄、髋臼改变及破坏。通过比较有骨吸收区组和无骨吸收区组ARCOⅡ期、Ⅲ期是否存在差异,推测骨吸收区是否会加速疾病的进展。
(二)坏死区最大von Mises应力和平均von Mises应力:是有限元分析中评价股骨头力学性能,特别是评价股骨头塌陷风险的一个常见参量[14,26,27]。于有限元分析软件导出坏死区应力数据后,统计坏死区最大von Mises应力和平均von Mises应力,分析两者与骨吸收区直径的关系。
(三)骨吸收区周围1 mm区域最大von Mises应力:分析骨吸收区对周围区域应力分布的影响,将围绕模拟骨吸收区径向延伸1 mm的球形外壳作为测量von Mises应力的区域[22]。导出有限元应力数据后,提取有骨吸收区组和无骨吸收区组在该区域内的最大应力,比较两组之间是否存在差异,并分析该区域内最大应力与骨吸收区直径的关系。
采用Empower Stats 2.0统计学软件(X&Y Solutions,美国)进行数据分析。有骨吸收区组与无骨吸收区组患者年龄、体质指数符合正态性分布及方差齐,以 ±s表示,两组比较采用成组设计资料t检验;两组性别、单双侧、左右侧别、ARCO分期及病因的比较采用χ2检验;两组骨吸收区周围1 mm区域最大von Mises应力比较采用配对t检验;骨吸收区直径与坏死区最大von Mises应力、平均von Mises应力和骨吸收区周围1 mm区域最大von Mises应力的关系采用简单线性回归分析。检验水准α值取双侧0.05。
±s表示,两组比较采用成组设计资料t检验;两组性别、单双侧、左右侧别、ARCO分期及病因的比较采用χ2检验;两组骨吸收区周围1 mm区域最大von Mises应力比较采用配对t检验;骨吸收区直径与坏死区最大von Mises应力、平均von Mises应力和骨吸收区周围1 mm区域最大von Mises应力的关系采用简单线性回归分析。检验水准α值取双侧0.05。
纳入的94例患者中,有骨吸收区者56例(60%),无骨吸收区者38例(40%);纳入的股骨头坏死155髋中,含有骨吸收区的股骨头67髋(43%),无骨吸收区的股骨头88髋(57%)。6例9髋失访,未获取身高、体重及病因信息。
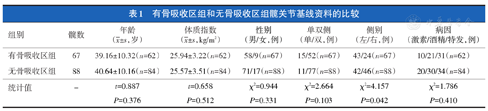
有骨吸收区组患者年龄、体质指数、性别、单双侧、病因与无骨吸收区组的差异无统计学意义(P>0.05),左右侧别的差异有统计学意义(χ2=4.157,P=0.042,表1)。
有骨吸收区组和无骨吸收区组髋关节基线资料的比较
有骨吸收区组和无骨吸收区组髋关节基线资料的比较
| 组别 | 髋数 | 年龄( ±s,岁) ±s,岁) | 体质指数( ±s,kg/m2) ±s,kg/m2) | 性别(男/女,例) | 单双侧(单/双,例) | 侧别(左/右,例) | 病因(激素/酒精/特发,例) |
|---|---|---|---|---|---|---|---|
| 有骨吸收区组 | 67 | 39.16±10.32(n=62) | 25.94±3.22(n=62) | 58/9(n=67) | 15/52(n=67) | 43/24(n=67) | 10/21/31(n=62) |
| 无骨吸收区组 | 88 | 40.64±10.16(n=84) | 25.57±3.51(n=84) | 71/17(n=88) | 11/77(n=88) | 42/46(n=88) | 20/30/34(n=84) |
| 统计值 | - | t=0.887 | t=0.658 | χ2=0.944 | χ2=2.664 | χ2=4.157 | χ2=1.786 |
| P=0.376 | P=0.512 | P=0.331 | P=0.103 | P=0.042 | P=0.410 |
有骨吸收区组ARCOⅡ期17髋、Ⅲ期50髋,无骨吸收区组ARCOⅡ期58髋、Ⅲ期30髋,两组ARCO分期的差异有统计学意义(χ2=25.03,P<0.001)。
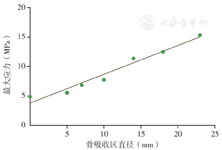
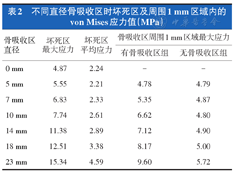
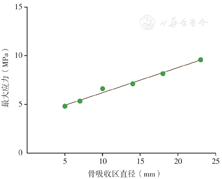
无骨吸收区及骨吸收区直径为5、7、10、14、18、23 mm时的坏死区最大von Mises应力如表2所示。采用线性回归曲线拟合骨吸收区直径与坏死区最大von Mises应力的关系,结果显示骨吸收区直径与坏死区最大von Mises应力呈线性正相关(R2=0.964,F=135.084,P=0.000,图4),拟合回归方程为:

不同直径骨吸收区时坏死区及周围1 mm区域内的von Mises应力值(MPa)
不同直径骨吸收区时坏死区及周围1 mm区域内的von Mises应力值(MPa)
| 骨吸收区直径 | 坏死区最大应力 | 坏死区平均应力 | 骨吸收区周围1 mm区域最大应力 | |
|---|---|---|---|---|
| 有骨吸收区组 | 无骨吸收区组 | |||
| 0 mm | 4.87 | 2.24 | - | - |
| 5 mm | 5.55 | 2.21 | 4.78 | 4.79 |
| 7 mm | 6.83 | 2.33 | 5.35 | 4.87 |
| 10 mm | 7.74 | 2.61 | 6.62 | 4.80 |
| 14 mm | 11.38 | 2.89 | 7.12 | 4.90 |
| 18 mm | 12.51 | 3.38 | 8.17 | 5.00 |
| 23 mm | 15.34 | 4.59 | 9.60 | 5.72 |
坏死区最大应力(MPa)=0.489×骨吸收区直径+3.794。
无骨吸收区时坏死区平均von Mises应力为2.24 MPa,骨吸收区直径为5、7、10、14、18、23 mm时坏死区平均von Mises应力分别为2.21、2.33、2.61、2.89、3.38、4.59 MPa(表2)。骨吸收区直径与坏死区平均von Mises应力呈线性正相关(R2=0.853,F=28.977,P=0.003,图5),拟合回归方程为:
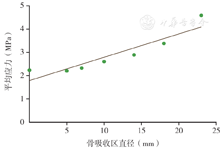

坏死区平均应力(MPa)=0.1×骨吸收区直径+1.793。
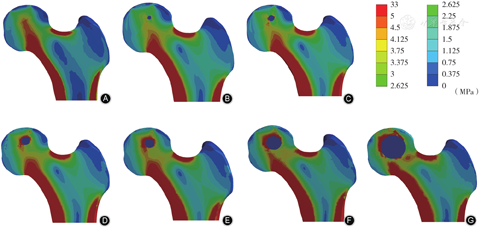
有限元应力分布云图显示,在骨吸收区上方存在应力集中区,且此区域范围随骨吸收区直径增大而逐渐增大(表2,图6)。在骨吸收区周围1 mm区域,有骨吸收区组的最大von Mises应力为(6.94±1.78)MPa,高于无骨吸收区的(5.01±0.35)MPa,差异有统计学意义(t=3.139,P=0.026);骨吸收区直径与骨吸收区周围1 mm区域最大von Mises应力呈线性正相关(R2=0.986,F=282.765,P=0.000,图7),拟合回归方程为:


骨吸收区周围1 mm区域最大应力(MPa)=0.259×骨吸收区直径+3.622。
通过本组资料我们发现,与不含骨吸收区的股骨头相比,有骨吸收区的股骨头ARCOⅢ期的比例更高,且差异有统计学意义,提示骨吸收区可能会加速股骨头坏死的病情进展。有限元结果显示,随骨吸收区直径增大,坏死区的最大应力和平均应力值均逐渐增高,且骨吸收区周围存在应力集中区,其周围最大应力也随骨吸收区直径增大而升高。在比较两组患者的基线资料时,我们发现两组在左右侧别上存在统计学差异。而既往文献研究显示股骨头塌陷的风险高低主要与坏死区的大小、位置相关[6],没有坏死侧别与塌陷有相关性的文献报道。因此我们认为,本研究中左右侧别上的统计学差异不会对结果造成影响。
股骨头坏死的预后主要取决于关节面是否塌陷[4,5]。既往研究证实坏死区内骨小梁结构强度降低及股骨头内出现应力集中区是引起塌陷的主要原因[26]。我们的有限元研究结果提示,骨吸收区的形成增加了坏死区的最大应力和平均应力,且骨吸收区周围存在应力集中区,从而增加了骨小梁骨折的风险。此外,骨吸收区内部的骨结构消失[9],可使股骨头负重能力进一步降低,增加了股骨头塌陷的风险,从而加速病情进展。
坏死区病变的位置被认为是塌陷的重要因素。Ohzono等[28]的研究结果提示,当坏死区累及负重区外侧时往往预后极差。而Kubo等[29]发现,当坏死灶累及前侧区域较多时,即使坏死灶位于内侧,股骨头坏死也有较高的塌陷率。而骨吸收区主要位于股骨头的前外侧,这可能会进一步降低股骨头的机械强度及负重能力并加速塌陷。Yu等[15]的研究表明,硬化带通过为股骨头提供机械支撑可以延迟或防止股骨头塌陷。而骨吸收区多数与硬化带相连[7],破坏了硬化边缘的完整性,从而降低对坏死组织的保护,进一步增加股骨头塌陷的风险。Gao等[7]通过分析CT图像中骨吸收区的位置特点发现,骨吸收区主要位于股骨头的中间柱和外侧柱。他们认为这破坏了股骨头内的主压应力骨小梁的完整性,损伤了股骨头内正常的应力传递途径,增加了股骨头内的平均应力,从而加速股骨头的塌陷。本研究根据既往研究结果,设计模拟骨吸收区主体部分位于股骨头的前外侧区,且在多个CT层面均位于硬化带上,符合临床上骨吸收区实际分布特点。
尽管目前对股骨头坏死的最佳治疗策略仍然存在争议,但通常认为在塌陷前积极的保髋治疗可以改善预后[30]。考虑到骨吸收区会增加塌陷的风险,因此应对含骨吸收区的患者进行仔细评估、密切随访,以便在病情出现进展时及时采取干预措施。
目前对股骨头坏死骨吸收区形成机制的研究较少。Gao等[7]基于CT断层扫描的数据得出骨吸收区主要位于股骨头的前侧、中间柱、外侧柱及硬化带附近。本课题组基于三维重建技术,观察了67髋含有骨吸收区的股骨头的三维结构,发现78%的骨吸收区位于正常区和坏死区交界处,54%位于股骨头前外侧[31],提示骨吸收区主要位于股骨头的应力集中区。因此我们推测骨吸收区的形成可能是由于应力诱导骨吸收导致的。在股骨头内部的应力集中处,骨小梁承受的应力超过其最大承受强度时会导致骨小梁微骨折[22,32];不断的应力作用或负重增加会使这一过程反复发生,随后骨折碎片被破骨细胞吸收并被纤维肉芽组织取代[33,34]。有限元分析证实,骨吸收区组织因强度降低使载荷传递受限,在其周围产生的应力集中区会进一步促进应力诱导的骨吸收,使骨吸收区不断扩大[22]。有文献报道,在骨关节炎骨吸收区的发生、发展过程中,应力增加引起的病理变化可使巨噬细胞反应增强,巨噬细胞通过巨噬细胞-破骨细胞分化促进骨关节炎骨吸收区周围软骨下骨的破骨细胞吸收,在骨吸收区增大的骨溶解过程中发挥作用[35]。由于骨关节炎与股骨头坏死骨吸收区之间存在相似的组织成分[9,36],这一生物学因素可能也有助于促进股骨头坏死内骨吸收区的维持和扩大。然而目前我们还没有进一步验证这一假设。
既往许多研究均支持骨吸收和塌陷进展具有密切关系这一结论[12,37]。在一项动物实验中,骨吸收增加是股骨头结构完整性丧失与股骨头畸形的重要原因[38]。Plenk等[39]提出股骨头坏死修复过程分为三类:有限性修复、破坏性修复和重建性修复。若修复以破坏性修复主导,则表现为破骨活动活跃,形成骨空洞,纤维组织填充,表现为骨吸收区形成及股骨头内部骨结构毁损。基于既往研究和以上发现,我们认为:骨吸收区是导致股骨头坏死塌陷的始动因素;防止骨吸收区的形成和发展是治疗早期股骨头坏死的必由之路。双膦酸盐可以促进破骨细胞凋亡从而抑制破骨细胞介导的骨吸收活动,应用双膦酸盐治疗早期股骨头坏死在动物模型中效果优异。Belfrage等[40]采用唑来膦酸钠溶液浸润异体骨,将其置入固定于大鼠胫骨的骨髓腔中,发现唑来膦酸钠处理后的异体骨骨量保留远远优于对照组,因此认为双膦酸盐能够减缓异体骨吸收,并可在异体骨小梁表面直接生成新生骨。Astrand和Aspenberg[41]将骨移植材料植入大鼠胫骨骨髓腔内,每周皮下注射唑来膦酸钠,发现经唑来膦酸盐处理的标本既保留了旧骨,也出现了新形成骨,在移植骨的小梁中排列着新生骨;而对照组几乎完全被吸收,移植物被骨髓替代。诸多临床研究结果也证实双磷酸盐可通过降低破骨细胞活动延缓或防止股骨头的塌陷[37,42,43]。然而双磷酸盐通过抗骨吸收来预防塌陷的效果有限,这可能是因为坏死区血供受损,传统的口服途径使药物很难达到坏死区发挥作用。因此我们认为,局部应用唑来膦酸钠调节成骨、破骨细胞活性,有望成为治疗早期股骨头坏死的有效途径。
我们的研究仅探讨了骨吸收高发区域对股骨头力学性能的影响,对骨吸收区形态特点的观察也仅设置了球形骨吸收区这一理想模型。实际上骨吸收区形态并不规则,还有些骨吸收区周围存在硬化区,位于前外侧的骨吸收区还可能会破坏软骨下骨板,因此需要进一步分析其他区域及不同形态特征骨吸收区对股骨头坏死病情进展的影响。此外,一部分骨吸收区分布位置并不位于我们假定的应力集中区,我们对骨吸收区形成机制的假设不能很好地解释这部分骨吸收区的形成原因,提示骨吸收区的形成是一个复杂的过程,需要对其形成机制进一步深入研究。



























