
骨质疏松症是一种较为多见的全身性代谢性骨病,其主要特征为骨量低、骨组织微结构损坏,从而导致骨脆性增加、易发生骨折。随着我国人口的老龄化,骨质疏松症和骨质疏松性骨折越来越严重威胁着人民群众的身体健康。通过对我国骨质疏松症诊疗现状、OPG-RANKL-RANK信号通路在骨质疏松症病理生理中的作用、地舒单抗在绝经后骨质疏松症治疗中的研究进展进行研究,为绝经后骨质疏松症的临床实践提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
骨质疏松症是一种较为多见的全身性代谢性骨病,其主要特征为骨量低、骨组织微结构损坏,从而导致骨脆性增加、易发生骨折[1]。随着我国人口的老龄化,骨质疏松症和骨质疏松性骨折越来越严重威胁着人民群众的身体健康。
我国骨质疏松症形势日益严峻,半数老龄女性患有骨质疏松症。2018年,国家卫生健康委员会公布了首个中国骨质疏松症流行病学调查结果,结果显示:骨质疏松症已成为我国中老年人群的重要健康问题,50岁以上人群骨质疏松症患病率为19.2%;中老年女性骨质疏松问题尤为严重,50岁以上女性患病率达32.1%,远高于同龄男性的6%;而65岁以上老年女性骨质疏松症患病率更是达到51.6%[2]。2019年,一项多中心大样本人群调查数据显示:50岁以上人群年龄标准化的骨质疏松症总患病率,男性为6.46%,女性为29.13%;而65岁及以上的老年女性骨质疏松症患病率则达到48.55%[3]。目前,我国骨质疏松症的患病率和患病人群均较高,但对骨质疏松症的认知和整体诊治率仍较低。2018年,国家卫生健康委员会调查结果显示:在骨质疏松症患者中,知晓自己患病的比例较低,40~49岁骨质疏松症患者的患病知晓率为0.9%,50岁以上患者的患病知晓率仅为7.0%[2]。一项针对亚洲地区绝经后女性的回顾性研究表明,即使发生脆性骨折后,骨密度检测率仅为20%,骨质疏松症的诊断率为36%,接受有效抗骨质疏松症药物治疗者仅为6.5%[4],均亟需提高。
骨质疏松性骨折是骨质疏松症最严重的并发症。2013年,国际骨质疏松基金会(international osteoporosis foundation,IOF)报告:全球每3秒钟就有1例骨质疏松性骨折发生[5],约1/3的女性和1/5的男性在50岁之后会遭遇第一次骨质疏松性骨折[6]。骨质疏松性骨折的危害巨大。澳大利亚一项前瞻性队列研究分析了60岁及以上的女性和男性不同类型的骨质疏松性骨折与长期死亡风险的关系,随访18年,结果表明髋部和椎体发生骨质疏松性骨折可显著降低患者的远期生存率[7]。
我国骨质疏松性骨折负担沉重。据估计,2015年我国主要骨质疏松性骨折(包括腕部、椎体和髋部)约为269万例次,2035年约为483万例次,到2050年约达599万例次,而其中女性占比高达79%。骨质疏松性骨折的医疗和护理需要投入大量的人力、物力和财力,造成沉重的家庭和社会负担。据预测,2050年用于主要骨质疏松性骨折的总体医疗费用将高达2 543亿美元[8]。


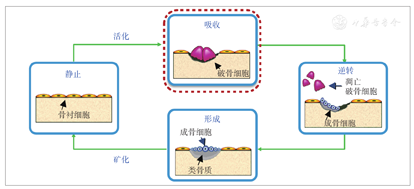
人体的骨骼需要足够的刚度和韧性以维持骨骼强度,承载外力,避免骨折。而骨骼的完整性由不断重复、时空偶联的骨吸收和骨形成过程维持,此过程称为骨重建,主要包括4个阶段[1,9](图1):①活化、吸收:破骨前体细胞在细胞因子和生长因子的作用下被激活并分化为成熟的活性破骨细胞,激活的破骨细胞吸收旧骨;②逆转:吸收结束;③形成:成骨细胞合成新的骨基质;④静止:成骨细胞在新骨表面形成静止的骨衬细胞(骨表面有骨衬细胞、成骨细胞和破骨细胞,其中骨衬细胞占94%)。

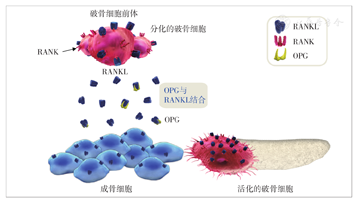
绝经前女性骨保护素(osteoprotegerin,OPG)和核因子-κB受体活化因子配体(receptor activator of NF-kappa B ligand,RANKL)处于平衡状态,成骨细胞分泌的OPG能够结合部分RANKL,从而使经RANKL与破骨细胞前体及破骨细胞表面核因子-κB受体活化因子(receptor activator of NF-kappa B,RANK)结合引起的破骨细胞分化、激活以及骨吸收可以被成骨细胞的骨形成作用所代偿。由此,骨吸收和骨形成得以平衡,骨密度和骨强度得以维持[10,11](图2)。





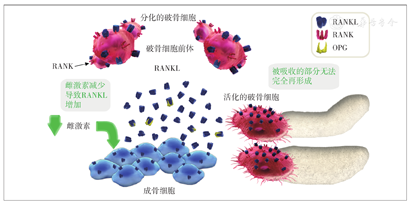
绝经后女性因雌激素水平降低而导致RANKL增加,RANKL/OPG比值升高,过多的RANKL与破骨细胞前体及破骨细胞表面的RANK结合,从而促进破骨细胞分化、激活,导致骨吸收作用增强,此时成骨细胞的骨形成作用不能完全代偿,骨吸收和骨形成呈负平衡状态,骨密度和骨强度下降[10](图3)。



1995年,OPG被确定为骨密度的重要调节剂[12,13,14];1997年,Nature和Cell杂志发布:明确RANK/RANKL通路并成功克隆OPG[15,16];1998年,确认与OPG结合的分子为OPGL,与RANKL相同,因此OPG为RANKL的竞争性受体[14,15,16];1999年,大肠杆菌源OPG克隆片段(Fc-OPG)进入临床试验,相关科学研究在Nature和Joumal of Cell Biology杂志发表[17,18,19];2000至2001年,中华仓鼠卵巢源OPG克隆片段(OPG-Fc)进入人体临床试验[12]。
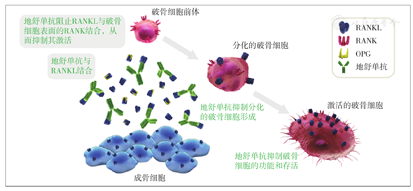
RANKL抑制剂存在多种形式。研究人员通过改变天然OPG末端二聚体结构产生了多种OPG、RANKL衍生物并改善其药代动力学特性。最终,通过一系列研究探索,OPG-RANKL-RANK信号通路相关药物——完全人源化RANKL抑制剂地舒单抗应运而生,其显著优于其他OPG及RANKL衍生物,并被证明为人体活性最强的RANKL抑制剂[12]。完全人源化RANKL抑制剂——地舒单抗与体内RANKL相结合,阻止RANKL与破骨细胞表面的RANK结合,从而抑制破骨细胞的激活、分化和存活(图4)。



自从2001年6月30日,第一支地舒单抗被注射进入人体[20],一系列地舒单抗在骨质疏松症领域的研究不断获得突破进展。2004年,第一个用于绝经后女性骨质疏松症(postmenopausal osteoporosis,PMO)的地舒单抗单剂量研究发表于The Journal of Bone and Mineral Research[20],同时地舒单抗用于PMO的Ⅲ期临床试验启动[21];2006至2009年,地舒单抗关键临床试验完成,结果发布于The New England Journal of Medicine杂志,提示地舒单抗每年皮下注射两次,持续36个月,可以显著降低绝经后骨质疏松症妇女椎体、非椎体和髋部骨折风险[22,23,24,25,26,27];2010年,地舒单抗获食品药品监督管理局(Food and Drug Administration, FDA)批准用于治疗有骨折高风险的PMO患者[28];2020年6月19日,地舒单抗获得国家药品监督管理局批准,用于骨折高风险的绝经后妇女骨质疏松症的治疗[29]。
地舒单抗的药代动力学和药效学特征也证实了其强大的治疗能力。研究显示[22,30]皮下注射60 mg剂量后,在第10天(范围2~28 d)达到最大血清地舒单抗浓度(Cmax),为6 μg/ml(范围1~17 μg/ml),达到Cmax后,血清水平在3个月(范围1.5~4.5个月)内逐渐下降,半衰期为26 d(范围6~52 d),而60 mg每6个月一次给药后,未观察到地舒单抗的累计或药代动力学特征随时间推移的变化,而且60 mg治疗可迅速降低骨转换速率,骨吸收标志物Ⅰ型胶原C-末端肽交联(C-terminal telopeptide of type 1 collagen,CTX)可在第3天下降约85%,约1个月下降至最低,并在给药期间维持在较低水平。地舒单抗的药代动力学和药效学特性支持60 mg每6个月一次皮下注射给药方案。
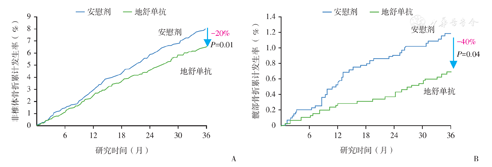
关于地舒单抗的一项国际、随机、双盲、安慰剂对照的Ⅲ期(FREEDOM)研究[27],旨评估地舒单抗长期治疗患有骨质疏松症的绝经后女性的安全性和有效性。研究共纳入7 808例绝经后骨质疏松症女性,随机接受地舒单抗或安慰剂治疗36个月,结果显示:①新发椎体骨折:与安慰剂组相比,地舒单抗组持续降低了新发椎体骨折的风险。地舒单抗组36个月的新发椎体骨折发病率为2.3%(86/3 702例受试者),安慰剂组为7.2%(264/3 691例受试者),相对风险降低68%(P< 0.001,图5)。每年的风险下降幅度相似。②非椎体和髋部骨折:与安慰剂组相比,地舒单抗组明显降低了非椎体和髋部骨折的风险(图6)。地舒单抗组非椎体骨折的累计发生率为6.5%,安慰剂组为8.0%[风险比:0.80;95%CI(0.67,0.95);P=0.01],相对降幅达20%。地舒单抗组髋部骨折的累计发生率为0.7%,安慰剂组为1.2%[风险比:0.60;95%CI(0.37,0.97);P=0.04],相对降幅达40%。
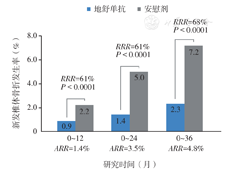

ARR=绝对危险度,RRR=相对危险度



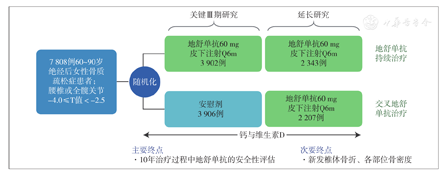
FREEDOM延长研究进一步评估地舒单抗治疗PMO患者10年的安全性和疗效[31]。研究纳入完成关键Ⅲ期研究(完成3年访视、研究期间未停用试验用药品,或未遗漏1剂以上试验用药品)的4 550例受试者,给予所有受试者继续行地舒单抗治疗,同时进一步评估地舒单抗治疗绝经后女性骨质疏松患者10年的安全性和疗效(图7)。结果显示:①不良事件:在10年的治疗过程中地舒单抗的安全性良好。在整个延长研究期间,长期组(地舒单抗继续治疗组)和交叉组(安慰剂转换为地舒单抗组)的所有不良事件的年度发生率相似。研究关注的不良事件包括低钙血症、胰腺炎、严重蜂窝织炎或丹毒、颌骨坏死和非典型股骨骨折。共观察到13例确诊为颌骨坏死的病例,长期组和交叉组中分别为7例和6例。所有患者在整个研究过程中均未产生地舒单抗中和抗体。②骨密度:地舒单抗治疗10年持续提升骨密度。骨密度在地舒单抗持续治疗的10年内持续提升,研究中的安慰剂组在延长研究中切换到地舒单抗治疗后也得到了持续的骨密度提升。延长研究第7年时的骨密度相对于Ⅲ期研究基线(长期组)以及相对于延长研究基线(交叉组)的百分比变化差异均有统计学意义(均P<0.05)。交叉组延长研究第7年时的观察数据很大程度上重现了长期组接受地舒单抗治疗7年后的观察结果。相对基线的平均百分比变化,两组任一时间点的腰椎、全髋和股骨颈部位骨密度均高于之前时间点的比较结果。③骨折:地舒单抗治疗10年将各类新发骨折风险维持在低水平。长期组新发椎体、非椎体、髋部骨折风险与研究期间结果相似,并在后续7年治疗中维持在低水平。交叉组新发椎体骨折、非椎体骨折和髋部骨折的年度受试者发生率与长期组地舒单抗治疗最初3年间的观察结果相似。

总之,OPG-RANKL-RANK信号通路与绝经后骨质疏松症的密切相关。这一信号通路相关药物地舒单抗是一种RANKL抑制剂,临床研究数据显示可显著降低绝经后妇女的椎体、非椎体和髋部骨折风险。地舒单抗在我国获批可以用于骨折高风险的绝经后妇女的骨质疏松症。





























