脊柱感染性疾病(infectious diseases of spine, IDS)是指由不同病原微生物引起的脊柱不同部位(椎体、椎间盘、附件、椎管和邻近椎旁组织)的一系列感染性疾病,约占全身骨骼肌肉系统感染的2%~7%。IDS经典分类法可分为特异性感染和非特异性感染两种类型。IDS往往起病隐匿,临床表现不典型,影像学及实验室检查缺乏特异性,对每种疾病的准确诊断及治疗造成很大困扰,常导致漏诊、误诊,甚至是误治。目前临床诊疗程序混乱、治疗方法多样、用药及疗程不规范等问题仍影响着IDS的预后。就目前IDS的诊断和治疗流程的研究进展进行探讨,以期能够进一步规范IDS的诊疗流程。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脊柱感染性疾病(infectious diseases of spine,IDS)是指由不同病原微生物引起脊柱不同部位(椎体、椎间盘、附件、椎管和邻近椎旁组织)的一系列感染性疾病,约占全身骨骼肌肉系统感染的2%~7%[1,2,3]。根据病原体类型和患者机体免疫反应情况,IDS经典分类法可分为两种类型:非特异性感染,即化脓性脊柱炎(pyogenic spondylitis,PS);特异性感染或称肉芽肿性感染,主要包括脊柱结核(spinal tuberculosis,STB)、布鲁杆菌性脊柱炎(brucellosis spondylitis,BS)、真菌性脊柱炎及寄生虫病性脊柱炎等[1,2,3]。发达国家IDS发病率为1/10万~1/25万,死亡率为2%~4%[4]。近年来,随着诊断技术的提高、脊柱手术的大量开展以及包括HIV等所致免疫缺陷病的增多,临床确诊IDS的发病率逐年增加[5]。IDS往往起病隐匿,临床表现不典型,影像学及实验室检查缺乏特异性,对每种疾病的准确诊断及治疗造成很大困扰,常导致漏诊、误诊,甚至是误治。目前临床诊疗程序混乱、治疗方法多样、用药及疗程不规范等问题仍影响着IDS的预后。因此,本文就目前IDS的诊断和治疗流程的研究进展进行探讨,以期能够进一步规范IDS的诊疗流程。
在IDS的全部诊疗流程中至关重要的是病原学诊断环节。如上文所述,IDS包括了许多种独立诊断的病种,临床最常见的是PS、STB和BS[1,2,3],其他病种较为少见。治疗时均应根据相应的病原菌采取不同的抗感染治疗。
在病原学诊断流程中,除对各种类型病原体的检测标本类型、取材方法及检测方法等进行不断创新、提高之外,近年许多研究强调血培养、组织标本培养的阳性率很大程度上取决于在标本获取前是否进行过抗感染治疗[3,6,7],即抗感染治疗后病原体培养的阳性率很低[3,8]。当一次获取的标本培养阴性时,只要患者病情允许还需再次取标本进行培养[3,6];标本应行需氧菌、厌氧菌、结核菌、真菌培养[3]。再次培养仍为阴性时可开始进行经验性的诊断性治疗[3,6,8],诊断性治疗无效时要进一步调整抗感染的治疗方案。
强调病原学诊断的重要性,是由于在IDS的诊断过程中病史、临床表现、实验室常规炎性指标检查所提供的证据往往为非特异性[3,6,7]。影像学证据通常是依据诊断者本人经验性的认知判定而来。在许多情况下上述方法提供的资料仅仅能够证明是笼统的"脊柱感染性疾病"这一诊断名称,而要确诊为"感染性疾病"这一大类型中的某个病种时则十分有限[3,6,7]。
有关IDS诊断流程的文献并不多见,Gregori等[9]、Zarghooni等[10]和Chen等[11]分别对PS和STB的诊断流程进行了描述。其诊断程序主要是针对典型IDS来制定,而典型IDS的诊断并不困难,这或许也是他们未将临床表现、影像学、组织病理学和实验室检查的顺序在诊断程序中具体化的原因。而早期及非典型IDS由于抗生素的滥用、HIV的流行以及脊柱本身特殊的结构和位置等原因易造成诊断困难,误诊、误治的情况在临床上屡见不鲜。如雷鹏蛟等[12]报告3年内23例非结核性IDS病例误诊为STB;王金河等[13]报告21例BS误诊为STB。临床表现、病史及常规炎性指标检查是基础,影像学检查包括B超、X线片、CT、MRI及增强扫描、SPECT等,CT引导下穿刺取活检样本行病理学、细菌学检查以及基因检测能为IDS早期诊断提供重要依据,只有循序检查,才能及早做出明确诊断,减少误诊或漏诊[14]。
IDS的诊疗流程存在着许多不足,影响了疾病的快速诊断与治疗效果。
1.病原学诊断重视不够,在诊疗过程中未将其置于关键环节,从疑似病例的确定,到确诊病例的检查,再到疑似病例与确诊病例的恰当治疗,在整个诊疗过程中对病原体的检测、确认与治疗流程不规范,这在许多医院是常见的问题[7,15]。例如未行病原学检查,获取病灶组织标本的时间、部位或类型不恰当,标本获取的全过程无菌操作不严格、培养方法与时间不当等[7,8,16]。仅凭病史、临床表现、常规实验室检查、影像学检查,而未行病原学检查或病原学检查阴性、未行诊断性治疗即确定诊断。
2.抗感染治疗的错误或缺陷,以下几方面较为常见:①未做病原学检查即开始抗感染治疗,仅依据影像学、临床及实验室常规检查就按照自身的临床经验进行抗感染治疗;②病原学检查阴性即开始抗感染治疗,未再次取标本送病原学检查;③病原学检查阴性时抗感染治疗方案不规范,不能选择敏感和合理的抗生素,未能及时调整抗生素治疗方案;④抗感染治疗流程混乱,缺乏统一规范的指导;⑤扩大手术适应证,手术指征不明确,手术方案多种多样,疗效不一。
IDS临床表现缺乏特异性,发病初期症状隐匿,容易被患者和医生忽视[17]。针对目前诊疗程序混乱的局面,建议将临床病例分为疑似病例与确诊病例进行检查。当符合下述条件时应考虑为疑似病例。①病史:包括流行病学史、前期感染、有创介入、疫区及有关动物接触史等;②发热:低热、高热、波浪热等;③局部疼痛:位于颈、胸、腰病变部位;④局部压痛及叩击痛。同时,实验室常规检查与影像学检查支持临床考虑时即可确定为疑似病例。IDS的最后确诊依赖于进一步的IDS某一特异性检测、病原学检测及组织病理学检查,当疑似病例的此三项同时或其中之一为阳性时即为确诊病例。
IDS多发生于男性,男女比例约为2∶1。各年龄段均可发病,好发于50岁以上成年人,症状出现至确诊的时间30 d~6个月不等[18]。
PS最常见于腰椎,其次是胸椎、颈椎及骶椎;STB最常见于胸椎或胸腰段[19];BS好发腰椎。STB主要累及2个连续节段,占比甚至可达80.6%,而BS主要累及1个节段,但在伴有神经损害的BS中绝大多数为2个连续节段受累,占比达到94.7%[20,21,22]。STB和BS均以累及胸椎、腰椎或胸腰段多见,均占60%以上,且BS在L4椎体的发病率最高[15,20,21,23,24,25,26,27,28]。
IDS的临床表现因感染累及部位、受累节段数量、致病菌不同以及病程长短而表现不同,但缺乏特异性。随着病情进展超过90%的患者常以腰部、背部或颈部疼痛就诊,其中尤以BS及PS患者局部疼痛明显。疼痛是IDS中BS和PS的典型特征之一,常是患者就诊的主要症状之一,表现为病变脊柱区的剧烈疼痛,疼痛视觉模拟评分(visual analogue scale,VAS)常在6分以上,疼痛早期常伴有寒战、高热。众多文献报道BS病变部位疼痛率为100%[26,27,29]。PS的局部疼痛率大约为85%,其发热可为高热,且可伴有畏寒、神志不清等急性或亚急性的表现,可有近50%的患者有疖、痈、扁桃体炎等感染史[15,23,24]。
IDS患者伴有发热,PS常为高热,BS可表现为波浪热,STB常为低热,也有相当多的患者体温表现正常。其他症状包括恶心、呕吐、食欲减退、体重减轻、嗜睡、乏力、神经根支配区放射痛及感觉损害、脊柱僵直等,少有因IDS而截瘫,甚至致患者死亡[30]。但老年人或身体虚弱的患者临床症状不典型。
PS常有前驱感染病史,如细菌学心内膜炎、呼吸道感染、泌尿系感染、口腔黏膜感染等;STB合并活动性或陈旧性肺结核、肺外结核病;BS有牛羊生肉、皮毛等接触史或疫区暴露史,其中70%患者有明确的牛羊接触史[25,26,29]。BS和STB的症状较为相似,STB中后凸畸形、脓肿形成较为常见,文献报道疼痛、低热、盗汗、神经损害及脓肿形成等症状在非耐药结核患者中多见[20]。
对于IDS患者局部病变部位疼痛是患者早期就诊的主要原因之一,主诊医师首先会根据患者主要临床症状选择适当的影像学检查,可以较早发现脊柱结构的改变,评估病情,为早期的临床干预提供帮助。了解不同影像学检查方法的优、缺点对规范IDS诊疗流程有很大的帮助。X线片可大体评估脊柱生理曲度以及解剖结构破坏情况。MRI及增强扫描对早期IDS病灶的累及范围、椎管内脊髓及神经根压迫情况、椎旁组织累及情况以及脓肿的显示均具有独特的诊断价值。CT能够发现骨性结构破坏的详细情况,很好地显示骨质硬化、死骨、空洞等改变,有助于临床鉴别诊断。在临床中不同影像学方法应相互补充以发挥每项检查的优势[31]。
临床医生须在体格检查中认真仔细确定疼痛部位,从而初步确定影像学检查范围,特别要重视多节段病变和跳跃性病变,以防漏诊。检查部位根据体格检查确定,必要时行全脊柱或颈、胸、腰椎的全部检查。检查顺序首先应进行全面的X线检查,然后根据X线检查结果确定MR检查范围,最后对MRI提示的病椎进行CT、B超检查,必要时还需要进行核素骨扫描等检查。
尽管早期IDS在X线检查不易观察到,但X线检查仍是临床首选的影像学检查[32]。X线改变出现较迟,其改变主要是终板模糊与缺失、椎间隙变窄、椎旁软组织影、椎体塌陷、新骨形成、椎体硬化或缺失、畸形等。脊柱过伸、过屈位X线片可观察脊柱活动过程中是否存在失稳现象[33]。
MRI是发现脊柱早期感染最敏感的影像学检查方法,MRI提示感染的结果可能为非特异性,尤其是在脊柱手术后,脓肿、血肿可能具有相似的影像学表现[34]。MRI具有良好的软组织分辨率。当临床怀疑IDS病灶累及椎管时,MRI可以发现脊髓及神经根受压情况;同时观察椎旁软组织的水肿、脓肿及肉芽病变等情况,更好地评价患者病情[35]。MRI在辨别IDS软组织炎性水肿病变改变方面有优势,主要表现为T2WI呈混杂的中高信号。增强MRI对于脓肿壁的确定、病变累及范围及骨缺血、坏死有很大帮助,STB形成的脓肿增强扫描显示脓肿壁光滑且薄,而PS的脓肿壁往往较厚且边界不清,同时弥散成像对于IDS的鉴别诊断具有一定的临床价值[34]。
MRI对于IDS中骨质破坏有较高的敏感性,应常规行MRI及增强扫描。早期IDS的各种疾病MRI表现类似:T1WI呈低信号,T2WI呈高信号或不均匀混杂偏高信号,脂肪抑制T2WI呈高信号,在各种IDS疾病之间容易混淆[36]。至中晚期PS患者MRI典型表现为单发椎体或邻近2个椎体骨髓T1WI呈低信号、T2WI呈高信号、脂肪抑制序列T2WI或STIR显示更明显,椎体前部受累为主;STB患者MRI典型表现为相邻2个或2个以上椎体骨质破坏并累及相应椎间盘,椎体破坏明显,椎间盘破坏并不明显,病变椎体信号不均匀,椎体T1WI呈低信号,T2WI呈混杂信号、高信号或低信号[37]。PS和BS增强MRI影像表现十分相似,T1WI椎体呈低信号、累及范围大,增强T2WI椎体显示近均匀高信号,椎间盘早期破坏与STB的影像表现其实还是具有一定的差异。
由于PS与BS炎性渗出组织液中富含病原微生物释放的蛋白水解酶,感染早期椎间盘组织已出现破坏,形成炎性肉芽组织,并累及终板骨质,终板骨质呈地图样破坏。这与STB形成的椎体空洞、死骨、椎间盘破坏较晚等表现不同,是重要的影像学特征之一[38,39,40,41,42,43]。STB结核分枝杆菌缺乏蛋白水解酶、病灶组织为偏酸性构成,与椎体骨质破坏相比,椎间盘组织不易被破坏,此特征为STB与PS、BS的重要区别之一[42,43,44,45]。另外,PS与BS以肉芽肿或椎旁及椎管内小脓肿形成为特征表现,而STB常形成较大的椎旁脓肿或流注脓肿,这与STB病程较长有一定关系,也是重要的鉴别诊断依据[39,42,46]。
CT具有较高的分辨率,能够发现IDS引起的细微骨性结构改变,但不能鉴别脊柱感染类型。当病灶未累及椎间盘时会出现明显的弥漫性骨质破坏,并且边缘模糊,骨破坏区边缘出现溶骨或骨质硬化。IDS累及椎间盘时会出现椎间盘的膨大,边界模糊,密度降低且不均。CT能够对骨性结构破坏及压迫引起神经症状的情况加以显示。CT三维重建能够全面评估椎体骨质破坏的程度,明确死骨和硬化骨的位置、大小和形状,区分骨病灶是硬化为主还是溶骨为主,对于病灶清除范围、骨质保留多少及螺钉长度的选择具有重要意义,是整体手术方案设计的根本依据。
核素骨扫描一般适用于肿瘤病变,临床上较少在IDS诊断中应用,但对IDS与肿瘤的鉴别诊断有重要意义。
B超检查因其价格便宜、快速方便,常用于IDS所致椎旁脓肿的检查,结合MRI对椎旁脓肿能够准确定位,对IDS有一定的诊断和疗效评估价值。
对有临床表现的IDS患者,在完善相关影像学检查的同时应进行实验室检查,即炎性指标检测,包括白细胞计数(white blood cell,WBC)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、C反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT),是诊断感染的重要依据,敏感性高,但并无特异性。
PS中WBC增高的比例明显高于STB和BS。WBC及其中性粒细胞分类比值增高程度与感染程度有一定关联[47]。理论上讲,WBC在大多PS中会明显升高,在STB、真菌性、寄生虫性脊柱炎中并不升高。但从临床实践来看,WBC正常也不能排除PS的存在,文献报道55%的IDS患者WBC显示正常,因此,WBC对IDS诊断的特异性差[48,49]。
ESR、CRP、PCT是诊断感染性疾病的常用指标,同时也是重要的炎症转归监测指标,感染、恶性肿瘤等均可导致其明显升高,ESR持续时间较长。因此,CRP升高与ESR或WBC的升高以及与IDS一致的临床症状(如病变部位疼痛和发热)更能表明为IDS[1,3]。CRP在成功治疗后能迅速恢复至正常水平,被认为是治疗反应的最特异性标记[50]。PCT用于感染性疾病的辅助诊断指标,可作为区分细菌和非细菌感染的标志物,其敏感性低于CRP,PCT的升高常提示合并有感染[1]。文献报道患者发生细菌感染时PCT变化较为明显,而病毒感染时变化不明显[51]。在PS和BS中WBC是一个敏感指标,其总数变化及中性粒细胞变化对诊断及临床转归具有重要意义。而在STB中WBC正常,具有一定的临床鉴别诊断价值,而CRP、ESR在PS中明显增高[52]。真菌性脊柱炎WBC、PTC及CRP往往不高,ESR却存在明显异常[53,54]。
由于上述临床表现与影像学检查均为诊断者的经验性诊断,常规实验室检查缺乏特异性,仅能确定为疑似IDS。对每一种IDS的确诊须有病原学或特异性检测指标、组织病理学依据的支持。除非病情危重,一般情况下在应用抗生素之前,须进行以下检测。
确定为疑似病例后的首要任务是获取组织标本,进行病原学、组织病理学及具有特异性能检测方法的检测。IDS病变部位的穿刺活检是诊断IDS的重要方法,临床常通过CT引导下、B超引导下和经皮内镜下穿刺获取组织标本,对获取的组织标本进行病原学检测、组织病理学检查。
CT引导下脊柱穿刺活检术是一种安全、快捷的检查方法,对IDS来讲具有较好的诊断价值[55,56]。入路选择:颈椎多为经颈前路,胸椎采用经肋椎关节入路,腰椎为经椎体侧方入路或经椎弓根入路[57,58]。Sahoo等[58]报告经皮椎弓根穿刺在STB中92.7%的患者获得了很好的标本。CT引导下穿刺常规应用于IDS的诊疗中,能够为无手术指征的患者提供较准确的诊断,早期进行个体化治疗。
B超引导下穿刺避免了放射线对患者的影响,操作更方便。但B超不能很好地显示解剖结构及骨性标志,与CT引导相比,B超较少用睛对骨性结构的穿刺。但对IDS引起的软组织病变及脓肿,B超引导下的穿刺更方便、更经济和易于操作。
目前也有采用经皮内镜进行IDS病灶组织标本的获取,但较上述方法繁琐。
穿刺获取的组织标本要在严格无菌条件下送检细菌涂片、各种病原体培养+药敏、抗酸染色、利福平耐药实时荧光定量核酸扩增检测技术(GeneXpert MTB/RIF,Xpert)等检查,根据检查结果临床上制定相应治疗方案。无论穿刺标本检测阳性、阴性或者检测结果未回报,手术患者术中切取的肉芽组织、脓液、骨病灶、干酪样物等均应从新分别送检,再次进行上述各项检测。
IDS诊断的金标准为检测到相应病原菌,其检查方法为细菌涂片与培养。病原菌培养的标本可来源于血液、病灶组织,病灶组织的获取来自CT或B超引导下的组织穿刺活检和开放手术切除的组织。应高度重视的是,对所有疑似IDS患者均应对感染部位的组织标本和血液标本进行培养;标本获取应在使用抗生素之前;生命体征不稳定的患者,无法获取组织标本时在经验性给予诊断性抗生素治疗之前留取血培养标本[59]。已经使用抗感染治疗的患者,情况许可时需停药数日后再获取标本。因为抗生素的使用会降低血培养结果的阳性率[59,60,61]。文献报道IDS患者在开始经验性抗生素治疗之前收集血液和尿液进行细菌培养,59%的血培养可培养出PS患者的病原微生物[62]。IDS约1/2~2/3患者病原菌培养呈阳性,可能与低毒性细菌感染或活检技术有关[15,16]。Hassoun等[63]的研究结果显示致病菌培养阳性率为52%,并提出培养前暂停抗生素应用能够提高培养阳性率。Kim等[64]和Wang等[8]的研究结果也显示培养前应用抗生素会降低致病菌培养的阳性率。Kim等[65]对IDS病变部位不同组织(骨组织、软组织)的培养结果进行分析,结果显示软组织是病原菌培养的最佳材料。崔云鹏等[66]对40例IDS患者的病变软组织标本进行55次致病菌培养的阳性率为45.45%,且取材前2周内应用抗生素的患者致病菌培养阳性率为38.24%,无抗生素使用史的患者致病菌培养阳性率为57.14%,对软组织匀浆后致病菌培养阳性率为63.16%。
通常选用血培养以缩短培养时间[67],但其阳性率不高,故需要进行多次采血培养[18],血培养的敏感度为17%~85%,与涉及的菌种、疾病进展程度及前期抗生素的使用有关[68],多数报道不超过25%。文献报道在未应用抗生素治疗前血培养阳性率可达70%[10,69]。因此,怀疑IDS时医生应尽量在抗生素治疗前取得细菌培养的标本,且应尽可能在发热或寒颤当时采集[70]。若血培养结果阴性,应对受累节段行经皮穿刺活检取得标本进行微生物培养[70]。当血培养凝固酶阴性,葡萄球菌阳性时,提示标本可能被污染,也应行经皮椎间盘穿刺取样送检[71]。
为了提高组织培养和血培养的阳性率,最好同时行需氧菌、厌氧菌、霉菌、分枝杆菌等多种方法培养[72]。同时要延长培养时间或增殖细菌数量,以进一步提高阳性率[16,72]。
当怀疑BS时应及时完善布鲁杆菌平板凝集试验(plate agglutination test,PAT)、虎红平板凝集试验(red plate agglutination test, RBPT)。王淑云等[73]对236例布鲁杆菌病患者外周血浆进行PAT、RBPT检测,结果显示PAT阳性率63.6%,RBPT阳性率67.4%,灵敏度分别为97.7%、98.5%,特异度分别为70.0%,75.0%。邵宏业和张帅清[74]对107例BS患者血清标本进行RBPT及PAT检测,结果显示RBPT敏感度更高,敏感度为91.42%,特异度为56.76%,符合率为79.44%,可用于布鲁杆菌病高发地区大面积筛查的检疫检验。
包虫病的血清学检查是诊断骨包虫病的主要方法,皮内试验、间接血凝试验和对流免疫电泳俗称包虫三项。刘大鹏等[75]研究骨包虫病患者37例,25例行皮内包囊虫液试验(Casoni试验),阳性21例(84%);4例行包虫病八项免疫试验,均为阳性。
Xpert在诊断STB中具有良好的诊断价值,检测标本主要为脓液、病变组织标本。Patel等[76]对306例STB患者病变组织标本进行Xpert检测,显示该法与组织病理学比较,敏感度95.75%,特异性96.04%,准确率95.83%。Wang等[77]报告Xpert诊断STB的敏感度85.27%,特异度100%。Yu等[45]报告Xpert诊断STB的敏感度63.3%,特异度100.0%;组织病理学的敏感度50.0%,特异度:97.8%,而两者联合诊断STB的敏感度95.0%,特异度97.58%。
文献报道Xpert检测结核分枝杆菌特异性DNA序列联合MRI,将诊断敏感性提高到97.9%[78]。由于分枝杆菌的培养需要6~8周才能完成,聚合酶链式反应(polymerase chain reaction, PCR)可快速检测,即使在非活跃期,PCR结果也是阳性,其可以检测到死亡的分枝杆菌[60]。
TSPOT.TB诊断结核病的有效性已被广泛验证,与PS相比,结核分枝杆菌引起的感染ESR、WBC和CRP有轻度升高,应用TSPOT.TB检测干扰素的释放是诊断STB分枝杆菌感染的重要生物标志物[60]。汪锴等[79]对98例疑似STB患者的外周血行TSPOT.TB检测,结果显示诊断STB的敏感度、特异度、阳性预测值和阴性预测值分别93.5%、91.7%、95.1%、89.2%,对STB的诊断具有重要意义。华裕忠等[80]对208例STB患者外周血行TB-DOT、TSPOT.TB和TB-DNA PCR检测,显示T-SPOT.TB诊断STB的敏感度86.1%,特异度88.3%,诊断价值明显优于另外两种检测方法,对STB的诊断具有重要的参考价值。
宏基因二代测序(metagenomic Next-Generation Sequencing,mNGS)是近年来已经广泛应用于临床感染的检验[81],理论上能够检测临床标本中的所有病原体,适用于感染病因比较复杂的情况。mNGS技术对IDS病原学诊断有重要的价值,mNGS是一种非培养技术,能够快速、全面地检测病原体。文献报道mNGS鉴别病原体具有较高的灵敏度,且受抗生素暴露影响小[82]。金文婷等[81]对24例疑似IDS患者的病灶组织进行mNGS检测,阳性检出率为62.5%。Sun等[83]报告mNGS似乎优于以前的所有结核病病原学检测,并且可以在48 h内识别可能的病原体。曾敬等[84]报告mNGS能够有效提高布鲁杆菌的诊断率。mNGS诊断耗时少、诊断效率较常规培养高,将mNGS应用于诊断IDS,不仅能够有效提高诊断率,而且避免一些经验性疗效不佳的治疗[85,86]。
IDS还需与多种其他类型的疾病进行鉴别诊断,最常见的是脊柱肿瘤、退变和创伤。脊柱退行性变和脊柱创伤根据病史、临床表现和影像学检查特点与IDS鉴别相对容易,而最重要的就是IDS与肿瘤的鉴别诊断。脊柱肿瘤包括原发性肿瘤和继发性肿瘤,以转移瘤多见。
恶性肿瘤多见于年龄40岁以上的患者,老年人居多,主要表现为明显的疼痛,局部有压痛、叩击痛和局部活动受限,大多数为夜间痛、近期消瘦明显及恶液质表现。X线多见附件破坏,椎间隙正常,椎旁可见软组织影。MRI对脊柱肿瘤的诊断和鉴别诊断具有重要意义,脊柱肿瘤MRI主要表现为T1WI呈低信号,T2WI呈高信号,累及多个椎体,可见附件破坏、形成椎旁软组织肿块和椎管内占位性病变,但椎间盘正常,椎间隙破坏和狭窄是鉴别肿瘤和化脓性脊柱炎的要点,椎旁脓肿、腰大肌脓肿也是排除肿瘤诊断的确凿依据。CT对IDS和肿瘤的鉴别也具有重要的意义,脊柱肿瘤CT常显示溶骨性骨质破坏,转移瘤常累及椎体和附件。周围软组织累及可形成软组织肿块影。STB常显示椎体空洞、死骨及椎旁脓肿形成是其特点;而PS和BS早期即破坏了椎间盘组织形成肉芽组织,导致椎间隙早期狭窄,当病变累及终板时可导致终板下骨质呈地图样改变;椎旁常形成肉芽肿,椎管内常形成小脓肿(表1)。另外,核素骨扫描对脊柱肿瘤的诊断具有特别的意义。
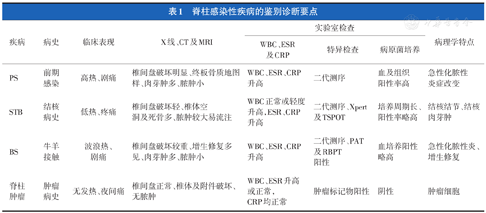
脊柱感染性疾病的鉴别诊断要点
脊柱感染性疾病的鉴别诊断要点
| 疾病 | 病史 | 临床表现 | X线、CT及MRI | 实验室检查 | 病理学特点 | ||
|---|---|---|---|---|---|---|---|
| WBC、ESR及CRP | 特异检查 | 病原菌培养 | |||||
| PS | 前期感染 | 高热、剧痛 | 椎间盘破坏明显、终板骨质地图样、肉芽肿多、脓肿小 | WBC、ESR、CRP升高 | 二代测序 | 血及组织阳性率高 | 急性化脓性炎症改变 |
| STB | 结核病史 | 低热、疼痛 | 椎间盘破坏轻、椎体空洞及死骨多、脓肿较大易流注 | WBC正常或轻度升高,ESR、CRP升高 | 二代测序、Xpert及TSPOT | 培养周期长、阳性率略高 | 结核结节、结核肉芽肿 |
| BS | 牛羊接触 | 波浪热、剧痛 | 椎间盘破坏较重、增生修复多见、肉芽肿多、脓肿小 | WBC、ESR、CRP升高 | 二代测序、PAT及RBPT阳性 | 血培养阳性略高 | 急性化脓性炎、增生修复 |
| 脊柱肿瘤 | 肿瘤病史 | 无发热、夜间痛 | 椎间盘正常、椎体及附件破坏、无脓肿 | WBC、ESR升高或正常,CRP均正常 | 肿瘤标记物阳性 | 阴性 | 肿瘤细胞 |
对疑似IDS患者应用经验性抗感染治疗可能会降低病原学诊断的敏感性[3,6]。故对于所有疑似IDS患者,在无感染性休克、无或有进展缓慢的脊髓与神经压迫症状时,只要患者全身状况允许,均要在抗感染药物治疗前获取血液及组织标本,根据病原学检测结果应用敏感抗生素。对于生命体征不平稳、脓毒血症、感染性休克、存在进行性严重神经系统症状、病原学2次以上检测阴性的患者,可以进行诊断性抗感染治疗,但要在首次静脉给予抗生素前留取血培养标本,并且要尽早进行穿刺活检获取组织标本[3,6];在患者生命体征平稳的情况下,不建议经验性应用抗生素。
如有必要经验性使用抗生素时,首先要覆盖常见的感染性微生物,即金黄色葡萄球菌,包括耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,MRSA)、链球菌和革兰氏阴性杆菌(特别是大肠杆菌),治疗方案包括万古霉素联合第三代或第四代头孢菌素。对于感染原因不明的患者,目前根据美国感染协会推荐意见,采用利福平+左氧氟沙星进行经验性抗感染治疗。在患者过敏或不耐受的情况下,替代方案可选择达托霉素联合喹诺酮类抗生素[6]。无论是疑似病例,还是确诊病例,在抗生素治疗中应强调与感染科、临床药学部门等学科的多学科协作。除抗生素的使用,同时还需应用外部支具固定以增加脊柱稳定性,以防止脊柱畸形加重神经压迫,限制脊柱活动并减轻患者疼痛,加强营养和理疗。
IDS患者保守治疗成功的关键在于抗生素的应用,已经确定病原菌的IDS患者,要及时根据药敏结果调整抗生素,大约90%的IDS患者在恰当抗生素治疗的同时应用止痛、制动、理疗后可达到保守治疗目的,实现感染病灶的吸收和疼痛缓解,同时保持脊柱的稳定性,减轻神经压迫症状[3,87]。一般要求患者持续卧床3~4周,疼痛缓解后佩戴外固定支具下地行走[88]。早期经验性使用抗生素是非常有必要的,但抗生素应用方案均须根据细菌培养和药敏结果、抗生素疗效、副作用及患者自身情况等进行个性化调整。
对于脊柱非特异性感染,目前使用抗生素治疗的时间尚无统一标准,通常需要持续6~12周。文献报道中推荐抗生素的使用时间为4~12周不等[72,89,90]。Roblot等[91]对91例IDS患者进行抗生素使用时间≤ 6周和>6周的观察性研究,两组的复发率和死亡率的差异无统计学意义。Grados等[92]建议针对慢性IDS患者,抗生素使用时间至少12周;当患者高龄、合并免疫缺陷等疾病、并发脓肿时抗生素使用时间应适当延长[93]。通常前期静脉应用抗生素2~4周后改为口服用药,但抗生素治疗4周后出现ESR>50 mm/1 h、CRP>27.5 mg/L时,应考虑为治疗效果差[94];相反,当CRP水平每周下降超过50%,前期治疗效果明显,可以改为口服用药[92]。口服用药至ESR、CRP恢复正常水平,然后停止抗生素[95]。具体使用时间取决于病原体种类、临床症状的改善程度、ESR和CRP恢复水平、脓肿的减少程度等[17],但要权衡长期使用抗生素带来的并发症,包括耐药菌的出现和艰难梭菌结肠炎等[72,89,96,97]。
对于特异性IDS,抗感染治疗方案及时间也会随着对疾病认识的不断深入而进行调整。对于STB初治患者,标准化疗方案为强化期3~6个月,巩固期6~9个月,总疗程可达12~18个月。推荐四联疗法:异烟肼(H)、利福平(R)、吡嗪酰胺(Z)和乙胺丁醇(E),用药时间为9~12个月。短程(2HRZ/6HR)及彻底病灶清除基础上的超短程方案(2HRZE/2HRE)均取得较好疗效[98,99,100]。术前抗结核药物治疗根据全身情况及治疗效果约需2~6周[100,101]。近年研究的热点为在确保疗效为前提下,尽量缩短疗程[102]。对于BS,2012年我国卫生部《布鲁氏菌病诊疗指南(试行)》建议选用多西环素200 mg/d、利福平600 mg/d、喹诺酮类及三代头孢菌素类药物[103]。文献报道链霉素2~3周联合多西环素3个月,或多西环素联合利福平口服3个月,这两种治疗方案的疗效无明显差异[104]。
其他IDS如梅毒性脊柱炎、真菌性脊柱炎、寄生虫病性脊柱炎在临床上较为罕见。梅毒性脊柱炎的疗程一般在10~28 d,晚期潜伏梅毒、三期梅毒以及糖尿病患者需要更长的治疗时间[105,106]。杜春艳等[53]对脊柱真菌感染患者给予3.5~6个月抗真菌药物治疗,均效果良好且复查无异常。对罕见的真菌感染病例推荐使用氟康唑类或两性霉素B进行长期治疗[107],考虑到抗真菌药物的副作用,根据治疗效果应采用更个体化的治疗方法[108]。脊柱寄生虫感染的治疗以手术为主,药物治疗为辅[109]。包虫感染多见,通常需要口服阿苯达唑(800 mg/d,分2次服用)1~6个月,一般服用3个月,以控制疾病、防止扩散及复发[110]。
虽然大多数IDS经保守治疗后不需要接受手术,但仍有30%~50%的IDS患者需要手术治疗[111]。在足量抗生素等保守治疗后,患者神经压迫症状、脊柱畸形和脊柱不稳进行性加重、持续或反复脓毒血症、较大的脓肿及保守治疗无效者要积极进行手术干预[6,60,112]。手术适应证包括[6,112,113]:①神经功能障碍;②后凸畸形;③脊柱不稳;④顽固性疼痛;⑤较大脓肿;⑥保守治疗无效。手术治疗的目的是彻底清除感染病灶、恢复周围组织的血供、确诊病原菌、保持或恢复脊柱稳定性及恢复椎管容积、解除神经压迫[6]。对于已给予适当、足量抗生素治疗后仍持续性或反复出现菌血症,疼痛加重不缓解,在排除身体其他部位感染病灶后,可进行手术[6];术前无法明确病原菌的患者手术可在达到治疗的同时进行诊断,指导术后抗生素的使用。经保守治疗后临床症状和炎症指标均有所好转,在4~6周后复查影像学检查提示骨质破坏加重的患者,不建议手术[6]。
手术方式包括前路手术、后路手术、前后入路联合手术,一期手术或分期手术,使用或不使用内固定等。手术方式的选择要根据患者的具体情况以及术者对手术入路的熟练程度去综合考虑。前路手术的优势在于病灶显露清晰、清除彻底、减压充分、植骨稳定、支撑可靠,同时不破坏后柱结构,避免了经后路病灶清除可能造成的对硬膜及椎管的感染[114]。后路椎弓根钉固定的优势在于不仅达到坚强固定、稳定患椎,还能矫正畸形,另外在远离感染病灶置入内固定物,减少了细菌黏附异物的概率,更有利于控制感染[115,116]。前后入路联合手术既可彻底清除病灶,又能很好地重建脊柱稳定性,恢复生理曲度[117,118,119]。颈椎进行前路减压、充分清创、椎间融合器和钢板系统固定[120],在发现有明显颈椎不稳的情况下必要时附加后路内固定[121]。胸椎采用前路或胸膜外入路,腰椎采用腹膜后入路,IDS大多数累及椎体和椎间盘,因此该入路可实现充分清除感染病灶和减压,但是椎管脓肿多需要后路手术[3]。清创会导致脊柱不稳,因此,很多时候需要额外的植骨(自体或同种异体植骨)或脊柱内固定。多节段受累的情况下[119],单纯前路融合固定不足以维持脊柱稳定性,可能还需要联合后路内固定。
内固定物存在细菌定植风险,在感染病灶中使用仍然存在争议[119,122],钛合金表面缺乏间隙,不利于细菌的定植[123],因此,常用内置物为钛网、椎弓根螺钉和钛棒等器械,但感染部位彻底清创和术后抗生素使用是应用内固定的先决条件。
内固定以短节段固定为主,内固定范围在病椎间施行的原则,应在保证彻底清除感染病灶、重建脊柱稳定性可靠的前提下,合理选择术式,尽量缩小融合、固定节段,不可无限度、无原则地扩大手术范围。已有文献报道前路病灶清除联合后路内固定治疗IDS的复发率为0[122];仅前路病灶清除、减压的再手术率高于前路病灶清除、减压联合后路固定的再手术率[124]。对于STB患者在病灶彻底清除的基础上,术后采用超短程化疗方案可达到STB的治愈[100,117,118,125]。廖烨晖等[126]对48例下腰椎结核患者采用一期后路固定联合前路病灶清除植骨融合术和单纯后路病灶清除植骨融合椎弓根钉固定术,两种术式均可获得满意疗效,单纯后路组术后2例出现窦道形成,经换药、调整抗结核药物、增强营养及休息治愈,未行翻修手术。
近年,采用微创技术治疗IDS的报道逐渐增多,主要是清创、引流、置管冲洗,适应于病灶较小的病例,但需进一步研究和完善。
对于一般情况太差的患者,建议进行分期手术治疗[127,128],先行单纯后路内固定增加脊柱稳定性;2~3个月后再进行前路清创、植骨。一部分患者在第1次手术后疼痛缓解,病灶组织可愈合,避免了第2次手术[6,128]。
规范随访行为具有重要意义。IDS患者需要长期随访,所用药物均有一些需要防范的毒副作用,应坚持长期、定期复查,观察有无毒副反应,根据治疗效果调整治疗方案。同时规范随访有利于临床统计和研究。临床上一般根据所患疾病、发病年龄、发生部位以及病情严重情况来判断复查时间,通常建议治疗顺利的患者术后1、2、3、6、9、12个月及五年内每年复查1次,病情有变化时随时复查。进行影像学检查(X线片、MRI、CT、B超)及实验室检查(血常规、ESR、CRP、肝肾功能、RBPT等相关指标),了解病情转归及药物不良反应,观察疗效,预防复发。
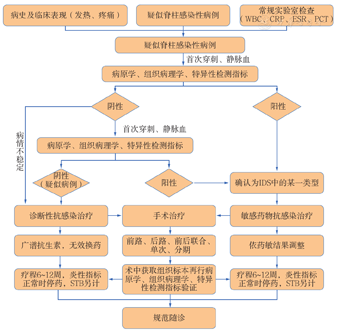
综上所述,近年来脊柱IDS的诊治取得了新的进展,但由于该类疾病早期缺乏特异性及临床诊疗的困难,需要规范诊疗流程,从而对患者的临床表现、影像学、组织病理学和实验室检查综合分析,穿刺活检明确感染类型及病原菌种类,以指导制定个体化药物及手术治疗方案。选择合理的检查程序,对于疑似病例和确诊病例选择合理的治疗方法,确定合理的疗程和规范化的随访同时需要引起重视(图1),只有这样才能做到及时诊断配合准确治疗,从而降低误诊率和漏诊率,提高脊柱IDS治疗的临床疗效。