
报告1例由贝纳柯克斯体导致的人工关节置换术后假体周围感染。患者全膝关节置换术后出现关节疼痛并窦道形成,通过病史、体格检查、影像学检查和基因检测确诊为贝纳柯克斯体全膝关节置换术后假体周围感染。采用二期翻修手术联合敏感抗生素治疗。通过文献复习,共检索出贝纳柯克斯体感染患者9例,其中髋关节6例、膝关节3例,4例有明确的病原微生物接触史,仅1例影像学上出现假体松动,贝纳柯克斯体IgG抗体阳性7例,基因检测阳性7例,8例病原学检查阴性、1例未做培养。所有患者均采用多西环素联合羟氯喹治疗。1例无Q热病症状者,治疗后血清学指标转阴;1例合并多脏器功能不全者治疗后症状缓解,血清学抗体指标和核医学结果转阴;另7例患者经二期翻修手术后治愈。贝纳柯克斯体人工关节置换术后假体周围感染病例罕见且缺乏特征性临床表现和影像学特点,诊断主要依靠基因检测和血清学检测,治疗以足量、长程使用敏感抗生素联合二期翻修手术为主要手段。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
根据文献报道,在接受人工关节置换的患者中假体周围感染(periprosthetic joint infection,PJI)的发生率约为2%[1]。PJI因诊断困难、处理复杂、花费相对较高且通常需要多次手术而成为人工关节置换术后"灾难性"并发症[2]。PJI可导致全髋关节置换(total hip arthroplasty,THA)术后15%的翻修率和全膝关节置换(total knee arthroplasty,TKA)术后25%的翻修率,且患者术后五年生存率低于乳腺癌、黑色素瘤、霍奇金淋巴瘤等常见恶性肿瘤[3]。因此,对人工关节置换术后PJI须做到准确诊断和及时治疗。
我们报告1例临床确诊为全膝关节置换术后贝纳柯克斯体感染患者的治疗过程和随访情况,并检索国内外文献中的贝纳柯克斯体PJI患者进行系统分析,以探讨贝纳柯克斯体PJI发生的原因、诊断、预防和治疗处理措施。本研究经我院医学伦理委员会审查(KY20212194-C-1),患者知情同意。
女,64岁,以右膝关节置换术后疼痛5年,加重2个月入院。5年前,患者因右膝关节骨关节炎在当地医院行全膝关节置换术。术后伤口愈合良好,但关节活动后出现间断性疼痛不适,关节屈伸功能恢复欠佳,右膝关节活动度为0°-85°。2个月前,患者右膝关节疼痛加重并出现红肿,伴乏力、头痛、咽部不适等轻微症状。于当地医院摄X线片未见假体松动或其他异常征象,行关节穿刺见少量浑浊液体,细菌培养阴性。2周前,右膝关节切口远端破溃出现窦道,每日渗出少量暗黄色有轻度异味黏稠液体,当地医院给予头孢呋辛和左氧氟沙星输液治疗10 d无好转,以右侧全膝关节置换术后PJI的诊断转入我院。患者居住于农村,邻居家有散养牛羊,发病前1个月曾饮用私人贩售的新鲜羊奶。
入院检查:跛行步态,右膝关节轻度红肿,前正中纵向15 cm手术切口愈合良好,切口远端下方可见0.5 cm×0.5 cm窦道,有少量浑浊、淡黄色液体渗出。关节皮肤温度较对侧略升高,关节屈伸活动度0°-30°。右下肢感觉、运动、反射均正常。X线片未见假体明确松动,位置良好(图1A)。实验室检查:红细胞沉降率为12 mm/1 h,C反应蛋白为1.06 mg/L,降钙素原<0.02 ng/ml;G试验、GM试验、冷凝集试验均阴性;结核感染T细胞检测:ESAT-6为14,CFP-10为4。关节穿刺获得5 ml浓稠血性关节液,细菌培养为阴性。
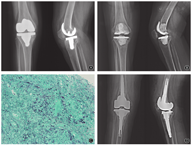

手术采用一期旷置二期翻修的方法。首先行右膝关节旷置术。沿原手术切口逐层进入膝关节腔,见少量血性关节液,留取标本。窦道与膝关节腔相通,窦道周围有少量坏死组织,未见干酪样坏死组织。彻底清除坏死失活组织和关节内粘连的瘢痕组织,检查膝关节假体固定牢靠、无松动。去除骨水泥后将假体与股骨、胫骨分离,股骨后方和胫骨下方可见少量灰色黏稠液体和质脆软组织,留取标本后彻底清除坏死失活组织和残余骨水泥。碘伏刷洗浸泡术区,用抗生素骨水泥塑形为股骨远端和胫骨近端占位器并分别置入(图1B)。术后连续3 d给予万古霉素(1 g/12 h静脉输液)及抗凝等对症处理。术中标本细菌培养阴性。病理检查结果:大量坏死组织,肉芽肿性炎,多核巨细胞结节,结核杆菌DNA检测阴性,抗酸染色、糖原染色、六胺银染色均为阴性(图1C)。术后第3天高通量测序报告病原微生物为贝纳柯克斯体,给予多西环素200 mg/d联合羟氯喹600 mg/d治疗。手术切口愈合情况良好,术后2周拆线,术后10周术侧皮肤温度恢复正常。
旷置术后4个月,患者术侧膝关节皮肤温度正常、略肿胀,手术切口愈合良好,各项炎症指标正常。再次入院行二期翻修术。沿原手术切口逐层进入膝关节腔,关节腔内有少量清亮关节液,留取标本。清除骨水泥占位器和周围瘢痕组织,未见明显坏死或感染组织。采用Vanguard®360全膝关节翻修系统(Zimmer Biomet,美国),分别于股骨远端及后髁骨缺损部加用金属垫块,股骨、胫骨侧使用髓腔延长杆(图1D)。术中标本培养结果为阴性。术后继续给予多西环素和羟氯喹治疗方案至术后2年,并嘱患者定期门诊复查。随访至术后6个月,患者右下肢股四头肌、腘绳肌肌力均5级,右膝关节伸屈活动度0°-100°。膝关节切口愈合良好,局部皮温正常。步态恢复正常,行走及上下楼梯无须辅助。
贝纳柯克斯体是一种革兰染色阴性的严格细胞内生存的病原微生物,是一种多由动物传播的罕见的地方性疾病(Q热病)的病原体[4]。60%的贝纳柯克斯体感染没有临床症状[5]。对有症状的病例,经过2~3周的潜伏期后会出现发热、头痛、肌肉痛等感冒症状,严重者甚至导致肺炎、肝炎、神经系统感染等。近年的研究还发现,贝纳柯克斯体的持续感染可以发生在心内膜、心血管系统、淋巴系统和骨关节系统[4,5,6]。骨关节系统的感染率约为2%,主要表现为骨髓炎、椎间盘炎、椎旁脓肿、腱鞘炎等[6]。关于贝纳柯克斯体导致的人工关节置换术后PJI的报道在过去的十年间才逐渐见于各类医学专业期刊[7]。事实上,贝纳柯克斯体导致的PJI或其他骨关节感染,因其感染病程较长、各项临床常规炎症指标变化轻微以及常规培养阴性等特点,可能在很长一段时间里被忽视而被当作"培养阴性的感染"处理[8]。另外,由于无法确定感染源及人工关节置换术后常规使用抗生素对贝纳柯克斯体感染治疗无效,从而拖延了治疗时间,增加了患者的痛苦和医疗花费。
人类贝纳柯克斯体感染最早于1937年在澳大利亚被报道,多种哺乳类动物、爬行动物、鸟类和蜱虫类生物体上均可以检出贝纳柯克斯体。人类通常由于吸入牛羊等家畜生产时或排泄粪尿时产生的含有病原微生物的气溶胶而感染,也可以通过饮用未经消毒或消毒不彻底的牛羊乳制品或蜱虫叮咬而感染[9]。人工关节置换术后假体周围贝纳柯克斯体感染发病率低,临床表现与其他PJI患者相比缺乏特异性。由于其在细胞内生长,所以普通细菌培养均呈阴性。这使得对贝纳柯克斯体PJI的诊断相对困难,常误诊为"培养阴性"的PJI,直至近年来宏基因组二代测序技术的发展和应用才逐渐被报道[7]。
我们以[ "coxiella burnetii" AND "periprosthetic joint infection" ]、[ "Q fever" AND "periprosthetic joint infection" ]、[ "贝纳柯克斯体" AND "假体周围关节感染" ]、[ "Q热病" AND "假体周围关节感染" ]为检索式在PubMed、Web of Science、中国知网、万方数据库、中华医学期刊全文数据库进行检索,检索时间由创刊至2022年5月。分别由两位作者按照预先设置的检索式进行独立检索,得到文献经两人分别阅读全文,排除综述、动物实验等不相关研究后筛选出贝纳柯克斯体PJI的相关临床文献,最终确定5篇文献[7, 10,11,12,13]。
5篇文献记录和我们报告的关节置换术后假体周围贝纳柯克斯体感染患者共9例,男4例、女5例,THA术后发病6例、TKA术后发病3例。2%的Q热病患者存在与骨关节相关的贝纳柯克斯体感染[14]。由贝纳柯克斯体引起的人工关节置换术后PJI发病率很低,且存在按"培养阴性"PJI处理的病例,因此其具体发病率尚不明确。9例患者的发病年龄为56岁1例、60~64岁5例、>65岁3例,与Q热病年龄趋势一致。
贝纳柯克斯体引起的人工关节置换术后PJI的症状、体征与其他病原微生物感染所致PJI的表现基本相同。7例患者出现关节周围疼痛、关节活动受限;1例因先天性髋关节发育不良行THA的患者感染确诊时无明显疼痛,在感染前曾因假体位置不良和磨损等原因接受过5次复位及3次翻修手术,髋关节周围软组织条件差;另1例既往确诊为Q热病,在随访中发现继发髋关节PJI,未出现明显疼痛。8例出现关节周围软组织肿胀,仅1例既往确诊Q热病的患者在随访时发现关节PJI而未出现肿胀。5例在关节感染确诊前或关节症状发生前曾有过低热、盗汗、乏力、头痛、咽痛等非特异性症状。1例出现切口周围与关节腔相通的窦道形成。无一例出现肢体感觉、运动或反射异常。
9例中4例有明确近期牧场访问史或牛羊及其乳汁接触史,从接触到确诊PJI时间为3周至3年;2例因类风湿关节炎而行关节置换手术,既往使用过免疫抑制剂治疗。
贝纳柯克斯体感染患者的影像学表现与其他病原微生物引起的PJI表现相同。对疑似患者最常采用X线、CT或MR检查[15]。影像学表现为骨膜下成骨、骨溶解和经骨皮质窦道形成可提示存在感染,其中1%~2%的假体松动是由PJI所致[16]。X线片对排除假体周围骨折、假体位置不良、关节失稳等原因引起的疼痛具有重要作用。9例患者中,1例X线片示关节假体松动,其余均固定牢靠。CT扫描因受到金属伪影的影响而导致感染病例骨膜反应的检出率仅为16%[17]。关节造影CT扫描用于评估关节周围积液是否与关节腔相通或存在通向皮肤的窦道等PJI征象[18]。发射型计算机断层扫描仪检查,特别是正电子断层扫描(positron emission computed tomography,PECT)对PJI的诊断具有重要意义。使用18F标记的葡萄糖示踪剂(fluorodeoxygllucose,FDG)的PECT对骨内植物周围感染诊断的敏感度为94.1%、特异度为87.3%,其结果均较白细胞标记的同位素骨扫描或骨三相扫描的准确性高[19,20]。9例中,3例行FDG-PECT检查,显示关节假体周围放射性同位素聚集。其中1例采用药物治疗,临床症状好转后复查放射性同位素骨扫描为阴性。由于FDG-PECT检查专业化程度高,其结果的判定需要经验丰富的核医学医生,以及相对花费巨大,因此仅在通过红细胞沉降率、C反应蛋白检查无法确诊且无法获得关节液的患者中考虑使用[16]。
关节周围组织或关节液的阳性培养结果可作为确诊感染的标准。9例患者中,除1例因患有严重基础疾病而未行关节穿刺检查外,其余8例均穿刺获得浑浊的关节液,且需氧、厌氧、分枝杆菌和真菌培养均为阴性。Tande和Patel[21]的研究发现7%~15%的PJI患者常规细菌培养呈阴性,这与培养前使用过抗生素和特殊病原微生物难以常规培养等因素相关。由于贝纳柯克斯体在细胞内生长的特性和可通过气溶胶传播的特点使其需要在BSL-3实验室条件下进行培养检测,而普通培养无法得到阳性结果。Singh等[22]通过改变培养体系构成,每48 h向液体培养基内加入Vero细胞提取物获得贝纳柯克斯体的细胞外生长。另外,在酸性基质和2.5%氧气浓度培养条件下,通过向酸化的半胱氨酸柠檬酸盐中添加β-甲基环糊精可实现贝纳柯克斯体在固体培养基培养[23]。以上病原培养方式不仅对实验室条件和实验操作技术要求高,在绝大多数医院检验科的实验室内很难实现。因此,当高度怀疑PJI却无法得到阳性培养结果时,不应排除贝纳柯克斯体感染的可能性。
血清学检测可作为诊断贝纳柯克斯体感染的首选方法,分别通过测定PhaseⅠ和PhaseⅡ抗体区分持续或初次感染状态[24,25]。初次感染症状出现后1~2周可检出PhaseⅡ抗体升高,在感染3~6个月后恢复正常。抗体滴度的诊断阈值在各个国家报告不一,通常以PhaseⅡIgG≥200和(或)IgM≥50作为感染诊断标准[26];当PhaseⅠIgG≥1∶800时,认为存在持续感染。PhaseⅠIgG抗体滴度值与特定部位贝纳柯克斯体的感染阳性预测值呈正相关。目前尚无人工关节置换术后假体周围贝纳柯克斯体感染发生率阳性预测值与PhaseⅠ IgG抗体滴度关系的研究,但在贝纳柯克斯体感染性心内膜炎的研究中发现,PhaseⅠIgG≥1∶800时阳性预测值为37%、PhaseⅠIgG≥1∶6 400时阳性预测值达到75%[27]。
目前,基因检测已被较广泛地应用于临床实践。16S~23S rRNA、超氧化物歧化酶、com1和IS1111等均可作为检测人或动物标本中贝纳柯克斯体感染的基因位点[28,29]。普通聚合酶链反应(polymerase chain reaction,PCR)检测的阈值通常为10~102个病原体/ml。Wielders等[30]发现qPCR不仅可以在患者血液中检测出2周内的贝纳柯克斯体感染,而且对持续感染状态也有较高的检出率,其敏感度、特异度、阳性预测值和阴性预测值分别为92.2%、98.9%、99.2%和89.8%。当联合使用冻干法处理样本提取DNA并使用qPCR时可以提高检测灵敏度100倍,达到1个病原体/ml[31]。"培养阴性"的PJI被称为关节外科医生的"临床噩梦",其治疗失败率高达73%,且目前尚无被认可的统一的治疗方法[32]。由于取样前使用过抗生素、取样不规范、病原微生物自身生物学特性和各个实验室培养条件等原因使得关节置换术后PJI病例中7%~12%的患者虽存在显著感染特征但无法获得阳性培养结果[33]。对这些病例采用高通量测序不仅可以提高检测速度,而且对普通培养难以检出的分枝杆菌、支原体、立克次体等具有很高的敏感度(95.9%)和特异度(95.2%)[34]。
9例患者中,4例出现红细胞沉降率和C反应蛋白高于正常水平;8例接受血清抗体检测显示贝纳柯克斯体IgG抗体滴度上升;7例行贝纳柯克斯体基因检测结果均阳性;8例行关节穿刺培养,均得到浑浊的关节液,且需氧培养、厌氧培养、分枝杆菌培养和真菌培养均阴性。
由于人工关节置换术后假体周围贝纳柯克斯体感染的临床症状、常规影像学表现和实验室检查等均与其他病原微生物导致的PJI没有显著性区别,因此对病原微生物的鉴别诊断尤为重要。首先,对既往有过畜牧养殖接触史或养殖场所附近居住史的患者应考虑到贝纳柯克斯体感染所致的PJI的可能性;其次,根据贝纳柯克斯体感染的特点和相应的临床表现、检查手段,可通过以下的诊断标准进行进一步判定。
确定标准:(1)关节穿刺或组织标本培养阳性;(2)PCR阳性;(3)免疫组化阳性[35]。主要标准:(1)血培养或PCR检测阳性;(2)贝纳柯克斯体血清IgGⅠ≥6 400 mg/dl;(3)任何假体受侵袭表现,即CT或MRI显示PJI(假体松动或周围炎性假瘤);(4)PET或111In标记的中性粒细胞扫描显示感染性高代谢状态[9,35]。次要标准:(1)假体存留;(2)发热≥38 ℃;(3)关节疼痛;(4)贝纳柯克斯体血清IgGⅠ>800 mg/dl且<6 400 mg/dl[6]。
人工关节置换术后贝纳柯克斯体感染PJI的确诊标准:确定标准中任一项、主要标准中任两项、主要标准任一项+次要标准任三项(包括微生物证据+假体存留)。可疑病例:主要标准中任一项+次要标准中任两项、次要标准任三项[9]。
人工关节置换术后假体周围贝纳柯克斯体感染的治疗原则与其他病原微生物所致PJI的治疗原则相同。控制感染是第一要务,在患者能耐受的情况下重建关节功能是治疗的终极目标。对早期PJI,97.6%的医疗中心选择关节清创更换可拆卸组件及敏感抗生素治疗[36],但由于贝纳柯克斯体PJI感染通常起病缓慢,前期全身症状较关节局部症状显著,且普通培养呈阴性,因此早期判定和治疗贝纳柯克斯体感染的可能性低。分期关节旷置二期翻修手术是目前处理PJI的金标准[37]。文献回顾中,除1例84岁合并多系统脏器功能不良的老年患者和1例82岁无症状筛查阳性患者仅使用敏感抗生素治疗外,其余7例均行分期旷置及翻修手术治疗。
除手术治疗外,长程、足量使用贝纳柯克斯体敏感抗生素是治疗成功的关键。现有临床经验均来源于病例报告和专家意见,尚无大规模的队列研究结果。多西环素和羟氯喹联合用药是首选,用药需持续至少18个月[38]。对多西环素不耐受者可依次考虑选用米诺环素、克拉霉素、氧氟沙星、培氟沙星、TMP、SMZ等进行治疗。在贝纳柯克斯体感染性心内膜炎的治疗中发现,治疗结束5年后仍有6%的复发概率,因此术后随访至少需要持续5年[39]。
贝纳柯克斯体通过感染家畜的排泄物和副产品进行传播。由于其对温度、渗透压、紫外线等环境因素抵抗力较强,因此可以在自然环境中存活较长时间并随风传播。美国国家疾病预防控制中心1999年将其列为必须报告统计的疾病之一,根据统计数据发现其发病有明显的季节性,每年4~6月发病率最高且随年龄增长感染率逐渐增高。Kim等[40]发现供应市场的美国东北地区牧场牛奶样本抽样显示贝纳柯克斯体的检出率为94.3%。结合我国实际,大多数人群直接接触畜牧饲养或养殖场周边居住的可能性不大。但我们的病例提示,贝纳柯克斯体对热的抵抗力大于一般的无芽孢病原微生物,需要100 ℃超过10 min才可完全杀灭,而普通民众饮用乳制品前通常不会将其长时间煮沸,这些未完全灭菌的乳制品被年老、抵抗力差且体内局部存留内植物的患者饮用时,感染贝纳柯克斯体的可能性会大幅增加[15],因此不要随意饮用未经正规消毒的乳品。
综上所述,贝纳柯克斯体所致的人工关节置换术后PJI是一类较为罕见的普通培养阴性的PJI。其临床表现和影像学特征与其他病原微生物所致的PJI无异。在关节样本培养阴性时应考虑到贝纳柯克斯体感染的可能性,基因检测、血清学抗体检测和特殊培养方法的应用有助于明确病原的存在。治疗以二期翻修手术作为金标准,正确、足量、长程使用敏感抗生素是治疗成功的关键。提高畜牧业管理水平和加强养殖场牲畜健康检查,宣传教育公共卫生观念,以及及时发现并进行处理对预防贝纳柯克斯体PJI具有重要作用。
所有作者声明无利益冲突



























