癌症是21世纪威胁人类健康的三大杀手之一,目前比较有前景的研究方向是关于癌症的早期诊断和高效低毒的治疗方案,纳米技术的兴起给此方面研究带来了新的希望。其中,磁性纳米颗粒由于可以在固定磁场中定位,且具有可在交变磁场振动发热的特性,因此在诊疗一体化方面有显著的效果。随着对磁性纳米颗粒的深入研究,磁性纳米颗粒也必然在癌症治疗方面展现出独特能力。综述了单金属、双金属以及合金纳米颗粒在癌症诊疗一体化中的主要应用及进展,并对磁性纳米技术的应用前景进行了展望。磁性纳米颗粒目前已经得到了较为广泛的应用,而且无论是理论研究还是应用研究都发展得很快,但在磁性纳米颗粒被确认为低毒有效、诊疗俱备之前,磁性纳米颗粒对细胞、组织与器官的毒性、商用及医用标准化等问题还有待继续深入研究。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,癌症已成为威胁人类健康的最大杀手之一,Chen等[1]调查报告显示,2015年中国癌症新发病为4 292 000例,死亡人数为2 814 000例。随着我国人均国内生产总值(GDP)的不断上升,癌症发病率从2012年的0.286%升至0.314%,死亡率从2012年的0.181%升至0.206%[2]。
目前,对于癌症的防治工作已经成为一个非常重要的课题,卫计委发布的《中国癌症防治三年行动计划》明确提出将推广癌症筛查、早诊早治策略和提高癌症诊疗水平作为防治癌症的主要措施。因此能否做到"早发现,早治疗" ,对于癌症的防治工作有着极其重要的意义。癌症的治疗方面,目前主要有手术切除、放射治疗和化学药物治疗3种主要手段,但每种都有各自的缺陷,因此,尽早发现癌症并且有效地治疗对于攻克癌症具有极其重大的意义。
纳米医学的兴起给了癌症诊疗新的发展契机。原有治疗方法存在的缺陷主要有两大原因,即能否进行精确的前期诊断及检测来提高治疗效果和如何进行精确的后续效果追踪而评价治疗的有效性,而这两大缺陷已能够被纳米技术很好地克服。纳米医学为癌症治疗带来了诊疗一体化的新概念,即利用纳米技术集成生物、化学及成像医学等学科,通过加载治疗基团和检测基团来达到对癌症病灶处的精确定向和准确杀伤的目的[3]。自1960年脂质体首次被用于药物载体以来,1976年发明的控制-释放聚合物;1990年发明的聚乙二醇(polyethylene glycol, PEG)脂质体;1999年发明的聚合物胶束以及2010年发明的枝状聚合物等越来越多的新型纳米颗粒被应用于癌症的治疗[4]。目前,已开发被应用于诊疗一体化的纳米颗粒主要有量子点、纳米金/银颗粒、磁性纳米颗粒、脂质体和碳纳米管等新型材料[5]。其中磁性纳米材料因为特有的超顺磁性和磁响应性,并且又具有纳米颗粒所固有的属性,如粒径小、比表面积大等特点,在诊疗一体化研究中尤其得到人们的青睐。例如磁性纳米材料既可以在恒定磁场中在特定部位发生聚集,又可以在交变磁场中高速振动而产热[6]。其优点使得磁性纳米颗粒成为一种非常值得研究和有应用前景的纳米粒子。
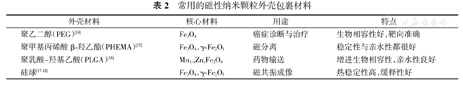
通过近年来纳米化学的不断发展,磁性纳米材料从之前最常见的铁氧化物逐渐发展为单金属、双金属以及磁性合金纳米颗粒3种主要类型。其中单金属颗粒主要包括Fe、Co等金属纳米颗粒以及Fe3O4、γ-Fe2O3等铁氧化物纳米颗粒;双金属颗粒主要包括CoFe2O4、ZnFe2O4等四氧化三铁近似取代纳米颗粒(通用晶体式为MFe2O4或MO·Fe2O3,其中M多为2价,如Mn、Co、Zn、Mg等)[7];磁性合金主要包括FePd、CoPt3等铂族金属与磁性金属单质的合金。而在这一系列磁性纳米颗粒中,由于制备简便、材料易得及方法成熟等因素,最为常用的则是Fe3O4和γ-Fe2O3等铁氧化物纳米颗粒。
早期磁性纳米材料的合成方法主要有机械研磨法、水热法、电化学法、电弧分解法等[8],但这些方法或者有不可克服的缺陷(如粒径不易控制),或者成本过高(如高能电弧),因此在纳米材料的发展过程中,其逐渐被更多的新型方法所取代。目前磁性纳米材料的合成方法主要有微乳液法、共沉淀法、热分解法及溶胶-凝胶法等。(表1)
由于磁性纳米颗粒的粒径非常小,因此其比表面积就会变得非常大,在使用过程中经常会出现诸如团聚或者变质等情况。为了能够充分发挥磁性纳米颗粒在体内的效果,在其表面包裹大分子材料现已成为非常广泛的做法。利用大分子材料自身电荷排斥作用以及在体内容易控制与释放等特点,磁性纳米颗粒被包裹后稳定性得到了增强,而且不容易再发生团聚与变质;同时由于大分子可以在表面进行一系列的修饰[13](图1),添加诸如靶向基团、药物基团等活性基团,可以使复合纳米颗粒完成多种所需的功能。
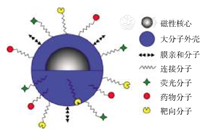

在磁性纳米颗粒的包裹方面,经常会选用一些生物相容性高、稳定性好的有机或无机大分子材料(表2),例如PEG、硅球或者聚乳酸(PLA)等材料,在良好亲水性和生物相容性前提下,磁性纳米颗粒可用于药物输送、诊断治疗等各个方面,在体内很好地发挥作用。另外,一些传统的有机或无机分子可根据不同的特定用途用作外壳材料,如葡聚糖、白蛋白等。这些特定的用途是基于磁性纳米颗粒的多功能而进行的针对性研究,并且最终能够发挥出磁性纳米颗粒的磁性功能,在诊断和治疗两方面均能有令人非常满意的结果。
所谓诊疗一体化,是指通过在纳米颗粒中集成药物和成像试剂,并对纳米颗粒进行功能性修饰或其他操作,使纳米颗粒可以有针对性地被传递到病灶组织,其既可有效提高药物的治疗效果,又可有效降低药物对其他组织尤其是正常组织的毒副作用[19]。磁性纳米颗粒在医疗诊治中由于其独有的顺磁性甚至超顺磁性,一方面可以采取人工外加磁场的方式向病灶部位聚集,另一方面又可根据其表面修饰的靶向基团直接定位到癌症病灶部位,从而达到靶向治疗与精确成像的目的。近年来,磁性纳米颗粒多应用于磁共振成像(magnetic resonance imaging, MRI)、微核磁共振技术(micro-nuclear magnetic resonance, M-NMR )、表面增强拉曼光谱(surface enhanced Raman scattering, SERS)等仪器分析技术、外磁场靶向运输及磁热效应治疗等治疗手段[13],其在癌症诊疗一体化方面表现出巨大优势。
MRI技术的原理主要是利用在外加磁场条件不同情况下,生物体不同组织因含水量和氢原子弛豫时间的不同,会产生不同的成像信号。当组织发生病变时,病变组织的氢原子弛豫时间和正常组织会有区别,因此使用此方法可以将病变组织有效地检测出来。MRI的工作过程中需要用到造影剂。而所谓造影剂是指通过内外界弛豫效应和磁化率差异,增强对比信号差异,提高成像分辨率和对比度的增强剂。现有的造影剂(如Gd-DOTA、钆特葡糖酸)存在着体内无特异性分布,体内存在半衰期过短、无法长时间保持工作浓度,对于MRI的成像并无特别显著改善等缺点,并不能够满足医务工作者的需要。针对此问题,超顺磁性氧化铁(主要是Fe3O4和γ-Fe2O3)被用作新的造影剂,其具有靶向性优良、组织特异性好、血液半衰期长及毒副作用小等优点,从而得到了越来越多的关注。Amstad等[20]使用PEG-陪酚包裹磁性纳米颗粒,并在颗粒表面加以生物素修饰等手段,使纳米颗粒可以靶向作用于含有抗生物素蛋白的肿瘤细胞上,进一步加强了磁性纳米颗粒的靶向性和实用性。
超顺磁性氧化铁作为新型造影剂经常会配合其他的成像手段,如荧光标记、放射性核素标记以及CT增强剂等结合使用而达到一剂多用的效果;而同时使用两种以上的成像手段可以极大地减少误差,从而增加检测的精确性[21]。更进一步,如果对磁性纳米颗粒进行靶向基团的表面修饰后,磁性纳米颗粒可以直接用于微波成像(microwave imaging, MWI)技术,在肿瘤病灶处聚集的磁性纳米颗粒既可以通过直接的微波反射增强成像效果,又可以在微波波段产生极化磁场(PMF )使磁性纳米颗粒附近的MWI效果发生增强性改变,在MWI仪器上的成像结果则表明了肿瘤病灶部位反射的微波信号因为磁性纳米颗粒的聚集而显著增强[22]。
微核磁共振技术(M-NMR)是基于MRI原理做出的重大创新性改进。基本原理与MRI相近,但其重点在于"微" ,也就是试图将仪器微小化、便携化、家庭化,将笨重的MRI仪器变为可以在家中常备的自检仪器。而作为增强剂,磁性纳米颗粒在对于肿瘤病灶的靶向性修饰以及顺磁性增强方面的研究使得M-NMR技术有了可行性。使用这些新型磁性纳米颗粒可以有效减少对人体的用量,并且可以显著增加检测效果的分辨率和特异性,从而可使核磁共振技术同时在仪器和造影剂两方面均得到精简,最终达到将M-NMR技术家用化推广的目的[23]。
一个非常实用的M-NMR检测手段就是检测患者血液中的循环肿瘤细胞(circulating tumor cell, CTC)水平。Ghazani等[24]将正常人血样品与已知数量的肿瘤细胞进行混合培养,使用4种肿瘤表面抗原抗体(EpCAM、MUC-1、HER-2和EGFR),通过M-NMR检测,最终检测结果表明,至少携带4种抗原中一种的细胞占已知肿瘤细胞数量的99.2%;而采取FDA已经批准的保守检测方法CellSearch[25]对于4种抗原只能平均检测出9.1%,总量≤36.4%。从而可知,M-NMR技术对于CTC的检测水平可以有极大的提升,而对磁性纳米颗粒进行肿瘤表面抗原抗体修饰后,不但可以通过抗原-抗体结合反应有效发现CTC,更可以通过磁性纳米颗粒的长弛豫性特点,进一步增强特异性和检出率。因此对癌症的早期诊断以及术后预防等工作均有极大的帮助。
拉曼散射效应是一种非常弱的散射效应,当单色光透过透明介质时,绝大部分光会反射和折射,少量光会向其他方向发生散射,而在光的散射部分中,有极少量(占总光强度的10-6~10-9)的光会发生频率的变化,这种散射效应即被称作拉曼散射效应[26]。从概念可以看出,拉曼散射效应是一种非常弱的散射,很难被检测到,而在粗糙的金属表面(如金、银等),这种散射信号却被大大加强,此增强效应称为表面增强拉曼效应,而散射光的光谱则被称为表面增强拉曼光谱(SERS)。
粗糙的金属表面可以增强拉曼效应,因此通过对磁性纳米颗粒进行金属化改造(如合成金-磁性纳米颗粒)即可通过SERP针对肿瘤细胞进行更加精确的检测。
He等[27]通过将CoFe2O4和纳米金颗粒与N-端脑钠肽前体(NT-proBNP )抗体蛋白分别进行包裹,并且通过NT-proBNP作为介质连接两种纳米颗粒使之成为一体,从而完成磁性纳米颗粒与SERS增强剂的复合纳米颗粒。在SERS检验中,这种带有纳米金颗粒的磁性纳米颗粒可以提高波长在1 420 cm-1吸收峰处的信号强度约40倍。而磁性纳米颗粒本身具有的顺磁性可以通过相互磁化吸引进一步增强SERS的信号以及抗体的浓度,随着纳米颗粒浓度从0.01 pg/ml上升到100 pg/ml,抗体浓度也成正比增加,从而可以达到SERS信号增强和疗效增强的双重目的。
靶向运输是磁性纳米颗粒的独特魅力所在。由于癌症发病部位的不确定性,有些肿瘤(如胰腺癌)深藏于脏器之内,使得一般在血液中不断循环的药物很难进入病灶部位。而目前已经应用于临床的抗癌药物大都为广谱抗癌药物,如阿霉素、氨甲喋呤、顺铂及多西紫杉醇等,特异性和靶向性均很差,很容易在体内不断循环的过程中对正常组织造成不必要的杀伤。因此方法简单、易于控制、无毒副作用的靶向给药运输成为研究者研究的主要目标。
磁性纳米颗粒的靶向运输主要分为被动靶向和主动靶向两类。被动靶向是指载体本身所带有的电荷或pH等非特异性的属性使纳米颗粒特定聚集于某个部位;而主动靶向则是根据抗原-抗体反应或者外加磁场等特异性作用完成靶向功能。由于主动靶向的可控性能更强,因此得到了更多的重视。
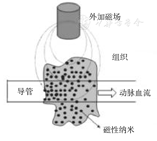
外加磁场的研究较早,目前技术已非常成熟[28],具体机理如图2所示。Wu等[29]用聚多巴胺对超顺磁性氧化铁颗粒进行包裹,得到了平均粒径为80 nm的磁性纳米颗粒,经与没有外加磁场相比较,外加磁场能够显著促进纳米颗粒中聚多巴胺对HeLa细胞的杀伤作用,证明外加磁场对于磁性纳米颗粒的集聚作用非常显著。

为了提升药效,加强药物在肿瘤病灶处的特异性,研究者们针对肿瘤患处pH值显著不同于正常组织的特点,开发出了基于pH值的缓释技术。此技术可以令装载有药物的磁性纳米颗粒在外加磁场的作用下聚集到固定位置后,在特定的pH值环境中逐渐释放药物,达到特异性杀灭肿瘤细胞的目的。Guo等[30]通过给磁螺菌属加入含纳米Fe3O4晶体、脑磷脂、磷脂酰甘油和丰富氨基酸的培养基培养的方法制造出一种细菌性的磷脂膜包裹的磁性纳米颗粒,对这种颗粒进行阿霉素修饰和肝癌特异性识别的半乳糖苷脂后,这种纳米颗粒就会在pH值较低的肝癌病灶处通过席夫碱取代的形式将阿霉素释放到肝癌组织处,最大限度地降低阿霉素对正常组织的毒副作用和提高给药效果。
然而令人遗憾的是,尽管对于外加磁场的体内实验已经取得了非常多的成果,但仍然缺乏这方面的临床数据,目前许多对人体潜在的威胁仍然没有被彻底排除掉,其主要问题有[31]:①纳米颗粒粒径与人体内半衰期的关系。②包裹外壳与人体的兼容性。③药物分子的装载。④生理学方面的潜在威胁。
磁热效应治疗是利用磁性纳米颗粒在交变磁场下会振动发热的特点,根据人体内部正常组织和肿瘤组织对温度的敏感性不同而杀伤癌细胞的方法。由于超顺磁性物质所特有的Neel磁滞效应,加上肿瘤组织内部缺乏血液供应以及与其他正常组织的物质与能量交换,在交变磁场作用下,通过靶向作用聚集在肿瘤病灶部位的磁性纳米颗粒就会产生大量的热量,而肿瘤细胞内部温度会迅速升高。研究表明,当肿瘤组织温度达到43~47 ℃时,细胞的各种坏死机制就会启动,并最终导致癌细胞组织的全部死亡。但是此方法的副作用较大,尤其是对于正常细胞也有较大的损伤效果,所以如何能够选择性杀伤癌细胞而尽可能减小对正常细胞的伤害是研究的重点方向。
由于某些原因,磁热效应方面的临床试验仍未大规模开始进行,但是体内试验结果已经表明,经过修饰的磁性纳米颗粒可以通过磁热效应有效杀灭乳腺癌、前列腺癌、结肠癌和脑瘤[13]。Sadhukha等[32]通过对磁性纳米颗粒进行表皮生长因子(EGFR)抗体修饰,制成可吸入气溶胶,在交变磁场的作用下,可以显著杀灭非小细胞肺癌组织。动物实验结果表明,经过修饰和磁热效应处理的小鼠,其肺的质量显著低于其他组的小鼠,进而表明了该实验的有效性和磁热效应的前景。
癌症在几十年前尚可以被称作不治之症,然而随着现代医学的发展,许多癌症已经可以被治愈。虽然癌症的发病机理目前尚未研究清楚,但是现在已经有了越来越多诊断和治疗癌症的手段,而磁性纳米颗粒就是其中非常有前景的一种。自磁性纳米颗粒发展至今数十年,研究人员已经开发出了诸如MRI, M-NMR, SERS等速度快、特异性好的成像处理或者检测技术,还在磁场靶向运输和磁热效应治疗的研究方面取得了各种突破性进展。对磁性纳米材料根据用途进行多种材料的包裹和修饰,并将其应用于癌症诊疗一体化的进程中,仍将有很多待研究的课题和挑战。今后一段时间的研究方向将主要侧重于复合材料的研究、临床试验数据的充实和工业化、商业化生产等方面。
复合材料的研发可以使磁性纳米颗粒具有更多、更好的功能,在诊疗一体化的进程中起到不可取代的作用。例如Liu等[33]通过对星状金纳米颗粒进行包括对巯基苯甲酸(pMBA)在内的多种类型的修饰,并且通过GD-DOTA的修饰使之带有顺磁性。实验结果表明,该纳米颗粒可以在1 066 cm-1吸收峰处显著增强SERS结果,且在MRI的成像下非常明显地提高肿瘤病灶部位的成像结果。由此可见,在复合生物材料的发展过程中,综合了多种材料优点的多功能材料必将使纳米医学更进一步得到发展。
目前实验室已经开发出了很多经过体内试验证明在癌症的诊疗一体化过程中比较有效的磁性纳米颗粒,例如郭悦等[34]开发出了新的可以示踪活体细胞的方法,使得疗效评价可以有进一步的进展,然而一些关键性的临床试验数据仍然不能够得到证明,这也使得磁性纳米颗粒在投入实践的过程中遇到了一些困难。而且因为制备纳米颗粒步骤通常较为繁琐,需要控制的步骤很多,也使得磁性纳米颗粒的工业化、商业化变得更加困难。例如MRI造影剂中,美国Advanced Magnetics公司的AMI-25在欧洲、北美已经完成了Ⅲ期临床试验并开始有商品出售,德国Shering公司的SHU555A也已经进入了Ⅲ期临床试验。而在磁性纳米颗粒应用的其他方面,临床试验和工业化生产仍没有达到令人满意的程度,但我们相信,随着磁性纳米颗粒诊疗一体化用途的不断开发和推广,磁性纳米颗粒一定会在癌症治疗的各个领域大放异彩,成为我们对抗癌症的有利武器。
无