
免疫检查点是人类进化出的控制免疫反应强度和持续时间、最大限度减少过度活跃的免疫应答导致的过度炎症反应和自身免疫性疾病的一种机制。相比于放疗、化疗等传统治疗手段,免疫疗法因其对正常细胞毒副作用小而在肿瘤治疗中日渐兴起。该疗法种类繁多,其中免疫检查点抑制疗法通过解除肿瘤免疫耐受、激活机体自身免疫系统进而清除肿瘤细胞,治疗手段极具潜力,成为肿瘤治疗中的研究热点。针对肿瘤免疫效应机制和逃逸机制进行了阐述,综述了抗细胞毒T淋巴细胞相关抗原4和程序性细胞死亡受体1两个免疫检查点抑制剂的作用机制和临床应用,对免疫检查点抑制剂的应用前景进行了展望。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2015年发布的《世界癌症报告》指出:2012年全球癌症患者新增病例1 410万,死亡病例820万,其中,中国新增癌症患者307万例,并有约220万例患者死亡,分别占全球新增病例、死亡病例总数的21.9%和26.8%。且该报告预测全球癌症病例将呈现迅猛增长态势,至2025年将递增1 900万例以上,其中非洲、亚洲和中南美洲的发展中国家癌症发病形势最为严峻[1]。目前,肿瘤治疗除手术、放射治疗(放疗)和化学药物治疗(化疗)3大常规治疗方式外,还有中医中药治疗、分子靶向治疗等新型治疗手段。尽管近年来各种治疗手段均取得了一定的进展,在一定程度上提高了肿瘤患者的总生存率,但晚期肿瘤患者的预后、远期生存率和生活质量均有待提高。上述治疗方法均为针对肿瘤细胞进行的。近年兴起的肿瘤免疫治疗与以往的治疗策略不同,该方法针对的靶标不是肿瘤细胞和组织,而是人体自身的免疫系统。该疗法旨在调节和激活人体免疫系统,依靠自身免疫机能清除机体内的所有肿瘤细胞,包括转移至远处的肿瘤细胞。目前肿瘤免疫治疗的方式多种多样,其中应用免疫检查点(immune checkpoint)抑制剂阻断免疫抑制通路,进而解除机体的免疫耐受状态,重新激活机体的免疫系统,增强对肿瘤细胞的识别与清除能力从而杀灭肿瘤细胞是一个行之有效的治疗手段。本文主要从肿瘤的发生机制、免疫检查点抑制剂的作用机制与目前的治疗现状进行综述。
肿瘤是细胞的异常增生,可由原发部位向其他部位浸润转移,侵犯重要器官引起衰竭,最终导致机体死亡。正常机体因免疫系统的不断检查,及时识别并且产生免疫应答清除肿瘤细胞才没有危害机体,因此可以通过激活免疫系统来治疗肿瘤。
抗肿瘤免疫应答主要是由细胞免疫介导的,体液免疫仅在某些情况下起协同作用。细胞免疫中发挥效应的细胞主要是T细胞、自然杀伤(natural killer cell, NK)细胞及巨噬细胞等,其中CD8+细胞毒T淋巴细胞(cytotoxic T lymphocyte,CTL)是肿瘤免疫的主要效应细胞,该类细胞直接接触肿瘤细胞,产生穿孔素和效应分子使得肿瘤细胞凋亡;CD4+ T辅助细胞(T helper cell,Th)是另一重要抗肿瘤效应T细胞,该类细胞是通过释放白细胞介素2(interleukin-2, IL-2)、肿瘤坏死因子等因子辅助肿瘤免疫;其他细胞如NK细胞、巨噬细胞等可以协同杀伤肿瘤细胞。
T细胞介导的免疫应答是最重要的肿瘤免疫应答,主要有3个阶段:首先T细胞特异性识别肿瘤抗原,然后抗原特异性的T细胞活化、增殖和分化,最后效应T细胞发挥效应清除肿瘤细胞。正常情况下,T细胞的调节对机体的免疫状态至关重要,并且其活化与否具有极其完善的调节机制。初始T细胞必须依靠"双信号"的刺激才能完全活化:第一信号来自其T细胞受体(T cell receptors, TCR)与主要组织相容性复合体(major histocompatibility complex, MHC)的特异性结合,即T细胞对抗原识别;第二信号来自协同刺激分子,即抗原提呈细胞(APC)表达的协同刺激分子与T细胞表面的相应受体或配体相互作用介导的信号。在双信号的刺激下T细胞活化,然后启动免疫反应清除体内突变的肿瘤细胞。肿瘤免疫的根本在于机体免疫细胞可识别细胞在癌变过程中出现在肿瘤细胞表面的新抗原或过度表达的抗原,从而诱发针对肿瘤抗原的免疫反应。
肿瘤在其发生发展过程中,经过与机体免疫系统复杂的相互作用,经历免疫清除、平衡和逃逸3个阶段,逐渐具有了逃避免疫系统识别和攻击的能力,并且其恶性程度也逐渐提高,此过程被称为肿瘤免疫编辑[2]。基因突变既可在没有任何诱因的作用下自发产生,又可在其他肿瘤诱发因素刺激下产生,多数情况下机体可对DNA突变自我修复,而对DNA损伤较重无法进行自我修复的突变启动凋亡程序清除突变的细胞。部分细胞突变后,其表面表达某种异常蛋白即肿瘤表面抗原,这些异性抗原多被机体免疫系统识别,从而使得突变细胞被清除。然而,有些细胞突变后通过多种机制逃避了机体免疫系统的监视,从而得以发生、发展、生存和迅速增殖形成肿瘤[3]。
肿瘤细胞可通过多种机制逃避机体免疫的识别和攻击,如肿瘤组织可分泌血管生长因子(vascular endothelial growth factor, VEGF),以此促进肿瘤局部新血管的生成,并对不同的免疫细胞具有抑制作用,如VEGF可以抑制树突状细胞(dendritic cells, DC)成熟并促进DC细胞表面程序性细胞死亡配体-1(progranmed cell death ligand-1, PD-L1)的表达、通过NRP1途径激活调节性T细胞(regulatory T cell, Treg)[4],通过降低细胞间黏附分子ICAM1和血管细胞黏附分子VCAM1的表达进而抑制CTL进入肿瘤局部[5];肿瘤细胞或其肿瘤微环境中某些糖或糖结合蛋白的差异性表达,导致特异抗原或配体覆盖,从而影响免疫系统的识别,促进肿瘤的进展[6];肿瘤的抗原加工呈递机制(antigen processing and presenting machinery, APM)缺陷或其组分蛋白表达异常或缺失,导致MHC-I分子提呈功能障碍。虽然不同肿瘤类型引起的APM缺陷类型和发生频率不同,但所有的APM缺陷均会导致肿瘤细胞免受抗原特异性CD8+ T细胞的识别和攻击,进而导致机体的免疫排斥反应沉默[7];肿瘤协同刺激分子配体表达减少从而使得相应的受体量不足以激活抗原提呈细胞[8];肿瘤抗原与肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte, TIL)结合后,还可直接引起TIL分泌γ-干扰素,然后通过激活核因子-κB和多囊蛋白2途径上调PD-L1的表达,PD-L1与程序性细胞死亡受体-1(programmed cell death-1, PD-1)结合后抑制了T细胞的功能[9];此外,肿瘤患者还直接分泌IL-10、转化生长因子-β(transforming growth factor-β, TGF-β)、前列腺素E2(PGE2)等细胞因子,直接抑制宿主免疫应答。
除肿瘤细胞本身的因素外,机体抗肿瘤免疫机制的失常可能是肿瘤发生的更重要因素。因为正常情况下,机体免疫系统具有监视功能,效应T细胞包括CTL、CD4+ Th1、CD4+ Th2和CD4+ Th17等细胞可以介导机体产生保护性免疫反应,清除外源性细菌、病毒及寄生虫等,并能够及时识别和清除染色体畸变或基因突变的细胞,可有效地防止肿瘤的发生。然而,这些效应免疫细胞也会引起机体的急性或慢性炎症反应,产生自身免疫性疾病,因此效应细胞的活性也需要受到免疫调节细胞、调节分子和免疫检查点的调节。免疫调节细胞主要包括Treg细胞、髓源性抑制细胞(myeloid derived suppressor cells, MDSCs)和M2型巨噬细胞;免疫调节细胞因子主要包括IL-10和TGF-β[10]。早期研究结果发现,肿瘤细胞周围的淋巴细胞即TIL被招募至肿瘤局部后呈不活化状态[11]。研究结果证实,肿瘤患者外周血及肿瘤组织中的Treg细胞所占比例及活性均明显增加,Treg细胞被肿瘤细胞或TIL分泌的化学趋化因子如CC趋化因子配体17(chemokine(C-C motif)ligand 17, CCL17)、CCL22,CCL28和CXC趋化因子配体12趋化至肿瘤局部,并在IL-2、TGF-β等因子的作用下增殖,趋化至肿瘤局部的Treg细胞抑制自体同源的T细胞增生和活化,并与MDSCs和肿瘤相关巨噬细胞形成免疫抑制网络,进一步促进Treg细胞在肿瘤局部的浸润,参与肿瘤免疫耐受的形成[10,12,13,14],尤其活化型Treg细胞在抑制CD8+ T细胞抗肿瘤免疫反应中起着举足轻重的作用。同时发现,Treg细胞的这种抑制作用具有肿瘤抗原特异性,并且Treg细胞的数量、比例及活性与肿瘤患者的预后密切相关[15,16,17]。另外,肿瘤微环境中的T细胞存在T细胞耗竭现象,即T细胞产生IL-2功能缺失、细胞增殖活性减弱和杀伤活性降低等现象。耗竭T细胞的主要特征是细胞表面多种检查点过度表达,包括PD-1、CTL相关抗原4(cytotoxic T lymphocyte antigen 4, CTLA-4)、淋巴细胞活化基因-3(lymphocyte activation gene-3, LAG-3)和细胞免疫球蛋白黏蛋白分子-3(T-cell immunoglobulin-3,TIM-3)等[18]。
应用针对Treg细胞表面某些分子的抗体或抑制剂,如抗CD25抗体、免疫检查点抑制剂抗CTLA-4的单抗——伊匹莫单抗(Ipilimamab)进行肿瘤治疗,均可显著减弱机体抗肿瘤免疫反应的抑制作用[19,20]。同时研究结果证实,在肿瘤免疫耐受存在的条件下,肿瘤免疫治疗包括肿瘤疫苗及TIL细胞过继免疫治疗的抗瘤效应均是有限的[21,22,23],去除机体的Treg细胞抑制作用后可大大提高其抗肿瘤效应[24,25,26,27]。
应用免疫检查点抑制剂阻断免疫抑制通路,进而解除机体的免疫耐受状态是近几年肿瘤免疫治疗的热点。目前两个研究较成熟的免疫检查点是CTLA-4和PD-1。(图1)
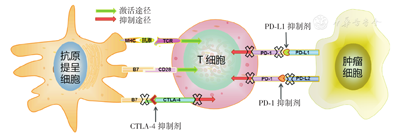

MHC—主要组织相容性复合体;TCR—T细胞受体;CTLA-4—细胞毒T淋巴细胞相关抗原4;PD-L1—程序性细胞死亡配体-1;PD-1—程序性细胞死亡受体-1
APC通过抗原-MHC分子复合物特异性识别、结合TCR-CD3分子,向T细胞传递第一活化信号,APC表面的B7与静止T细胞表面的CD28结合,为T细胞活化提供第二信号。CTLA-4和T细胞表面的协同刺激分子受体CD28分子高度同源,二者均可与相同抗原提呈细胞表面的配体CD86(B7-2)/CD80(B7-1)结合,并且CTLA-4对B7的亲和力大大高于CD28,而CTLA-4与配体结合后可向T细胞传导抑制信号,阻止CD28对T细胞的协同刺激作用,抑制T细胞活化。CTLA-4在Treg细胞表面持续高表达,对Treg细胞发挥免疫抑制作用至关重要[28],CTLA-4在活化的T细胞也有表达,但CTLA-4主要分布于活化的T细胞内部,而不在细胞表面,其作用可能主要是避免T细胞过度激活[29,30]。此外,CTLA-4还可抑制CD25的表达发挥其免疫抑制功能。应用抗CTLA-4单抗伊匹莫单抗可阻断CTLA-4共抑制信号,上调T细胞的活化增殖,诱导CTL恢复其攻击肿瘤细胞的功能。
除CTLA-4外,表达于活化T细胞上的PD-1也是一个重要的免疫检查点,PD-1通过与肿瘤细胞上的配体(PD-L1(B7-H1/CD274)或PD-L2(B7-DC/CD273))结合后抑制T细胞的活化并诱导其凋亡,是肿瘤细胞逃避免疫攻击的重要途径之一。研究结果发现,PD-1对CTL和Th1的免疫抑制作用主要是由PD-L1介导的,肿瘤细胞及肿瘤微环境通过上调PD-L1表达并与肿瘤特异的CD8+ T细胞表面的PD-1结合,来抑制机体的免疫反应。PD-L1与PD-1在激活的T细胞结合后,促使PD-1的ITSM结构域中的酪氨酸发生磷酸化,进而引起下游蛋白激酶Syk和PI3K的去磷酸化,从而抑制下游AKT、ERK等通路的活化,最终抑制T细胞活化所需基因及细胞因子的转录和翻译,发挥负向调控T细胞活性的作用[31]。PD-1/PD-L1除了抑制效应T细胞的功能,还诱导Treg细胞的免疫抑制功能。炎性细胞因子如I型和II型干扰素、肿瘤坏死因子-α和VEGF等均可诱导PD-L1的表达。PD-L2同PD-L1、PD-1结合有一定的竞争作用,结合后二者诱导的效应不同[32],但是PD-1究竟与PD-L1还是与PD-L2结合是否受细胞类型的限制目前还没有确凿的证据。
最初,肿瘤免疫治疗主要采用干扰素和白介素,副作用较大,临床疗效相对有限[33]。近年来,随着对免疫调节分子机制的研究,应用免疫检查点抗体介导的细胞免疫进行肿瘤治疗成为研究的热点。目前,针对免疫检查点的研究主要集中在抗CTLA-4和PD-1的单克隆抗体,也有相应的siRNA基因疗法。至今已获得批准上市的免疫检查点抑制药物有4个,其中CTLA-4(CD152)是第一个被鉴定的共抑制分子,也是第一个获得美国FDA批准的可用于转移性黑色素瘤治疗的免疫检查点受体,即百时美施贵宝生产的抗CTLA-4单克隆抗体伊匹莫单抗(Ipilimumab, Yervoy),于2011年被FDA批准上市;2014年获批的是PD-1特异性单克隆抗体帕母单抗(Pembrolizumab, Keytruda,默沙东)和纳武单抗(Nivolumab, Opdivo,百时美施贵宝/小野药品);2016年FDA批准PD-L1抗体阿特朱单抗(Atezolizumab, Tecentriq,基因泰克)作为二线药物治疗膀胱癌[34]。Ipilimumab已广泛用于治疗晚期黑色素瘤、肾癌、前列腺癌和肺癌等,能将晚期黑色素瘤患者生存期从6.4个月延长至10个月[35], Pembrolizumab对非小细胞肺癌患者的客观缓解率为19.4%[36],Nivolumab对黑色素瘤、肺癌、霍奇金氏淋巴瘤患者的治疗皆有疗效[37,38,39]。最新临床研究证实,采用肿瘤免疫治疗能将晚期黑色素瘤患者生存期从大约9个月延长至2年以上,对具有BRAF突变的黑色素瘤患者生存期可延长更长时间[40]。目前,免疫检查点抑制剂单抗之间、免疫检查点抗体与肿瘤疫苗、抗体与化疗药物联合应用的研究也在不断进行,优化治疗方案、扩大适应症范围,获得最优的肿瘤治疗效果。
除CTLA-4、PD-1两大主要免疫检查点外,还有TIM-3、LAG3、KIR、GITR、VISTA、IDO1、4-1BB、TDO2等新靶点药物也在进行探索与药物研发[41],有不少相关药物已进入到临床试验阶段。
免疫检查点抑制剂药物的成功上市,改变了实体瘤治疗行业的竞争格局,与其他药物联合应用的成果展现出了巨大的应用前景。但免疫检查点抗体依然存在一些不足,值得关注。免疫检查点抑制剂重新激活免疫系统的同时,会导致免疫相关副作用的发生,如有研究发现,应用PD-L1阻断后会引起有独特表观遗传学特征的疲劳T细胞无法变成效应T细胞或记忆T细胞[42],因此大多数癌症患者在开始治疗时对阻断PD-1应答良好,但效果不能长时间维持。
总之,免疫检查点阻断治疗已经让许多传统方法治疗无效的肿瘤患者大受裨益,相信联合用药、高效标志物的寻找及治疗方案个性化能将肿瘤免疫治疗优势发挥到极致,为人类健康事业做出更大贡献。
无































