关节是人体重要的运动器官,其组织结构特殊,成熟关节软骨组织没有血供,一旦损伤难以自愈。临床上常用的关节软骨损伤修复手段有微骨裂术、关节软骨移植、关节置换术、软骨组织工程等,但这些方法的修复效果都不理想。生长因子是体内组织分泌的一种具有生物活性的物质,可促进细胞生长、增殖、迁移和分化。软骨发育过程中有许多生长因子参与,如成纤维细胞生长因子(FGF)、骨形态发生蛋白(BMP)、胰岛素样生长因子(IGF)等。研究显示,在关节软骨修复过程中加入外源性生长因子可有效促进关节软骨损伤的修复。对目前应用于关节软骨损伤修复研究中的生长因子进行综述,讨论这些生长因子在关节软骨发育及其在关节软骨修复中的作用,分析生长因子在关节软骨修复应用中存在的问题。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
关节软骨在关节正常运动中起着重要作用。因为关节软骨缺少血管、淋巴管及神经纤维的营养作用,发生损伤后,难于自我修复[1]。
目前,临床上对关节软骨损伤的治疗策略包括微骨裂术、自体软骨细胞移植、软骨膜和软骨移植等。但因其长期修复效果不理想,供体来源有限,对供体组织有损害等问题,导致在实际应用中受到限制[2]。近年来,软骨组织工程发展迅速,但在支架材料的选择和制备、细胞来源、生长因子作用机制等方面仍有许多问题亟待解决[3,4,5]。其中,对生长因子作用机制的研究有助于揭示关节软骨的修复过程,完善关节软骨修复的理论基础,为建立合理的生长因子递送方式提供依据。本文中,主要就关节软骨修复研究中,生长因子应用的新进展进行综述。
关节软骨损伤可根据损伤程度分为3种,即浅层关节软骨损伤、全层关节软骨损伤、骨软骨损伤。浅层关节软骨损伤的损伤深度未突破潮线;此种损伤由于缺少修复相关的细胞和生长因子而难以自愈[9]。全层关节软骨损伤的损伤深度突破潮线但未突破软骨下骨板;这种损伤由于突破潮线,骨髓中与关节软骨形成相关的细胞和生长因子可以参与到修复过程中,因此自愈能力相对较好[9]。骨软骨损伤的深度突破软骨下骨板,损伤结构更为复杂,包括软骨、软骨下骨板、松质骨等;虽然骨软骨损伤会有大量与关节软骨损伤修复相关的细胞和生长因子参与,但是由于涉及的组织结构多且复杂,自愈效果反而不理想[9]。
关节软骨自身的生理特性导致关节软骨损伤的修复一直是一个重大医学难题。目前,临床治疗中主要根据关节软骨损伤程度,采取不同的治疗手段。骨微裂术用于小面积损伤的修复,因其操作简便、创伤小并且能刺激自身干细胞向软骨分化及刺激自身生长因子参与修复过程而被寄予厚望[10]。但后续研究表明,该方法很难控制软骨分化过程,且受缺损部位结构的影响较大,在应用中受到限制[2]。关节软骨移植用于大面积损伤的修复,其优点是使用成熟的关节软骨细胞,而不需要诱导分化干细胞,因此具较高安全性和有效性。但这种方法存在操作复杂、需要体外扩增软骨细胞、软骨细胞扩增过程中易发生去分以及细胞的种植时间与用量难以控制等问题[2]。关节置换术用于治疗严重的骨性关节炎、先天性发育畸形导致的关节炎或关节疼痛、活动功能障碍等[11]。其易受材料磨损的影响,且有使用年限限制及翻修的风险。软骨组织工程是正处在研究阶段的一种治疗方案,主要通过支架材料、种子细胞、生长因子这3个核心技术诱导关节软骨损伤部位的组织再生,从而有效治疗关节软骨损伤。该方法可克服传统修复手段的不足,是一种较理想的治疗手段[12]。研究生长因子的作用机制有助于理解软骨损伤修复的过程,并为各种生长因子的应用提供最佳的递送方式。
机体的稳态以及关节软骨修复的过程都受到生长因子的调节。在关节软骨损伤修复过程中,生长因子自身的特性对关节软骨损伤的修复效果至关重要,因此关节软骨损伤修复中的关键因素就是选择适合的生长因子。
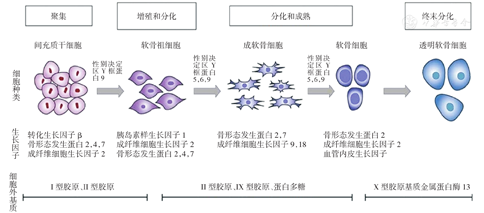
间充质干细胞(mesenchymal stem cell, MSC)向成熟软骨细胞的分化、成熟的过程中有多种生长因子参与(图1)。大量研究表明,在关节软骨修复过程中引入外源性生长因子,可有效促进关节软骨损伤修复。用于关节软骨损伤修复研究的外源性生长因子有成纤维细胞生长因子(fibroblast growth factor,FGF)、骨形态发生蛋白(bone morphogenetic protein,BMP)、转化生长因子β(transforming growth factor β,TGFβ)、胰岛素样生长因子1(insulin-like growth factor 1,IGF1)等[13,14]。
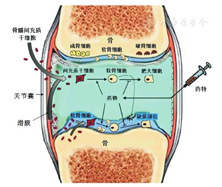
现有的研究一般采用直接添加外源性生长因子或植入载生长因子的生物材料等方法来增加软骨细胞的增殖分化能力,以促进浅层关节软骨损伤修复[9, 15]。关节软骨损伤发生后,自愈能力差,而植入载生长因子的生物材料会明显促进骨软骨损伤的修复。Taniyama等[16]将载BMP2的生物材料植入到损伤部位,获得了显著的修复效果。外源性生长因子可以诱导MSCs分化成软骨细胞,促进关节软骨损伤的修复。其中,骨髓来源的间充质干细胞(bone mesenchymal stem cells, BMSC)是关节软骨损伤修复中的主要细胞来源[17](图2)。在全层关节软骨损伤中,由于其自身修复的方向不可控,常导致纤维软骨的产生而使关节软骨层失去其原有的生理功能。为了解决这一问题,研究中常通过添加外源性生长因子诱导BMSC分化成正常软骨细胞,引导全层关节软骨损伤的修复,该方法能显著改善修复效果[18]。后文着重介绍目前已经应用在关节软骨损伤修复中的生长因子,并就这些生长因子的作用机制和作用效果进行阐述。
人类体内已被证实的FGF有22种。其中,FGF2与FGF18已被证实与关节软骨的稳态维持密切相关[20],在软骨损伤修复领域有广泛应用。
FGF2也称碱性成纤维细胞生长因子(basic-FGF, bFGF),最早被发现于软骨细胞和成骨细胞的细胞外基质。体内软骨细胞可以产生内源性FGF2,并储存在细胞外基质中[21]。研究表明,FGF2可以同时促进体内细胞合成及分解代谢,是其与不同成纤维细胞生长因子受体(fibroblast growth factor receptor, FGFR)结合造成的。FGFR2在骨和软骨的发育中有重要作用,可以促进MSCs的发育以及软骨细胞富集[22]。FGF2激活的PI3K-Akt、ERK1/2通路可促进BMSCs增殖,调节其SOX9基因表达,促进其向软骨分化[23]。但也有研究表明,体内注射FGF2会有负作用,如引起炎症反应、形成骨赘等[24]。
在关节软骨损伤动物模型中,内源性FGF2并不能很好的促进关节软骨损伤的修复,但通过添加外源性FGF2则可以对损伤关节软骨的修复起到明显的促进作用。Li等[25]基于不同结构的双层胶原膜支架材料开发出了能够靶向控释生长因子的关节软骨损伤修复方法。该双层支架由致密的胶原层和疏松的胶原层组成,2层胶原膜之间夹有负载生长因子的肝素-壳聚糖纳米颗粒。bFGF会优先向疏松胶原膜一侧释放,从而达到定向释放bFGF的目的。应用于动物实验的疏松胶原膜,其材质具有利于细胞吸附、增殖等特性。通过对关节滑液的检测发现,当该材料应用于软骨损伤修复时,bFGF靶向软骨下骨板释放并且刺激了内源性的TGFβs、BMPs和VEGFs的上调,进而促进了关节软骨的损伤修复[26]。
BMP是一类能够诱导MSCs分化成骨、软骨、韧带等组织的蛋白,在骨发育的过程中具有很重要的作用,其中BMP2、BMP4、BMP7在软骨修复中已经有比较深入的研究[29]。
BMP2在骨和软骨修复领域中已有较多研究,且已被允许用于脊椎融合术和胫骨的急性开放性创伤治疗[30]。BMP2被认为在骨发育和骨折治疗中具重要作用,而且还可以通过旁分泌来调节其他BMP的表达。BMP2本身既能促进合成代谢,又能促进分解代谢。特别在长骨缺损修复过程中,BMP2首先诱导骨的重吸收,然后再诱导骨重建[31]。目前,BMP2在骨软骨损伤中的应用较多[32]。Taniyama等[16]将载BMP2的多孔胶原基羟基磷灰石材料植入到兔骨软骨损伤模型中,结果显示BMP2对兔骨软骨损伤修复具有明显的改善。
近年来,BMP4在关舀软骨损伤修复领域中的关注度¥剧上升。BMP4属于TGFβ超家族,通过Smad(small mother against decapentaplegic)蛋白入核或通过丝裂原活化蛋白激酪信号通路调节软骨形成[33]。BMP4在维持软骨表型、增加细胞外基质产生、抑制细胞肥大、促进干细胞向软骨分化等方面具有重要作用[34,35]。BMP4在体内和体外作用于MSCs时,均可促进MSCs向软骨细胞方向分化,使其能分泌II型胶原和蛋白聚糖;同时又可促进软骨细胞成熟并且抑制软骨细胞肥大。目前,BMP4多与MSCs联合应用于关节软骨损伤的修复研究[36]。将BMP4基因转染进脂肪来源的间充质干细胞中,在体内和体外实验中均可促进其向软骨分化,提示了其在临床应用上的前景。
BMP7亦称为成骨蛋白1(osteogenic protein 1),临床前研究结果已经证实其可显著地促进II型胶原、蛋白聚糖和透明质酸合成,同时又可抑制蛋白聚糖酶以及人基质金属蛋白酶13(matrix metallopeptidase 13, MMP13)的合成。BMP7还可以延缓骨关节炎病程,正作为骨关节炎缓解药物进行I期临床研究[37]。
TGFβs家族在软骨内成骨、关节软骨形成及其稳态维持中有重要作用。特别在软骨内成骨过程中,TGFβs具有促进细胞增殖和分化的作用,在软骨修复领域中受到广泛关注。在软骨发育过程中的软骨内成骨阶段,TGFβs可以促进MSCs的聚集并合成大量II型胶原以及蛋白聚糖,从而使MSCs分化成为软骨细胞并且维持其表型;此后,TGFβs会抑制软骨细胞的分化和增殖,且抑制肥大软骨细胞增殖。TGFβs家庭中TGFβ1、TGFβ2、TGFβ3被看作软骨形成的诱导因子,可以促进BMSCs的SOX9基因表达以及软骨样基质的合成,并且促进软骨细胞合成代谢,在软骨修复领域中的应用较为广泛[38]。
尽管应用生长因子治疗简便,但将其用于临床关节软骨修复还有问题亟待解决。组织工程技术已经解决了传统临床方法的主要缺点,生长因子控释材料已经在体内和体外实验中取得了显著成就。生长因子应用的发展迅速,已经由最初的关节腔注射发展到了复杂的多功能、多分子递送系统。目前,生长因子领域的研究热点包括:①生长因子与抗炎、抗血管生成以及软骨保护剂的联用。②多因子同时递送。③生长因子的时空控释。④双层膜材料或者更新颖材料的开发。⑤生长因子浓度梯度的筛查。新研究结果显示,在关节软骨损伤修复过程中使用多种因子共同作用,并不会产生累加或者协同效应;生长因子负载于不同材料会对生长因子本身特性产生影响。因此,未来的研究热点应着重解决生长因子之间以及生长因子与递送材料之间的相互作用问题,充分发挥生长因子在关节软骨损伤修复领域的作用。
无