
OPT101型光电传感器具有光电响应特性好、内置跨阻放大器、芯片尺寸小等优点,可实现医疗近红外光谱波长范围内的准确测量。笔者研究团队使用OPT101开发了一系列便携式近红外光谱(NIRS)仪器,用于重症监护室的NIRS监测。对OPT101在临床NIRS仪器开发中的特点和优势进行介绍,对笔者团队使用OPT101进行的NIRS监测仪器研发的研究进展进行综述,对OPT101在临床无创监测方面的前景进行了讨论。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
光电传感器已广泛应用于各个领域,如农作物果实或茎的生长监测[1]、高灵敏度一氧化氮监测[2]、脉搏与血氧饱和度测量[3]、基于唾液的胃癌诊断[4]等。OPT101是美国Texas Instruments公司生产的一种单片光电二极管和单电源互阻抗放大器,即光电传感器。OPT101可将光信号转换成电子信号并放大,而不添加额外的噪声[5],这些特点促进了其在非侵入性诊断中的应用。
重症监护室(intensive care unit,ICU)对于非侵入性智能监测技术有重大需求,如新生儿监控和急症病人护理。临床中,休克通常会引起急性血流量减少、无氧代谢等,如果该情况持续,可能造成不可挽回的损伤甚至死亡。手术和创伤性损伤不可避免的会产生出血,严重的会导致失血性休克,其死亡率高达50%[6]。另外,深静脉血栓是一种常发生于手术后的危险并发症,被称为"沉默杀手",特别是对于老年患者,可能引起大范围的心脑血管疾病[7]。临床上评价失血性休克程度的常规方法是测量颈内中心性静脉血氧饱和度(systemic central venous oxygen saturation,ScvO2)[8],该方法属于侵入式、间歇性测量。此外,在失血性休克患者治疗中,持续监测血氧指标对医生判断最佳治疗时间窗至关重要。因此,临床上需要一种无创、连续、智能的血氧指标监测技术,以实现失血性休克与深静脉血栓的早期发现并观察其发展,以便更好地指导治疗和评估疗效。此外,临床医护人员在患者监护工作中往往存在工作时间长、劳累过度、疲劳累积的情况,容易造成不良事故[9,10]。而医院中现有技术无法提供连续、灵敏的测量方式来降低医护人员的劳动强度[7,11,12]。因此,同样需要无创、智能的监测技术提高工作效率。
近红外光谱(near-infrared spectroscopy,NIRS)的波长范围为700~900 nm,与有机分子中含氢基团(O—H、N—H、C—H)振动的合频和各级倍频的吸收区一致。作为一种有效,无损,非电离的测量技术,近红外光谱监测技术受到越来越多的关注,已在农业监测[13]、食品检测[14]、药物分析[15]、医学诊断[16]等领域得到广泛应用。作为一种非侵入性实时监测技术,近红外光谱监测能够连续测量生物组织中的血流动力学变化[10,17]。通过NIRS原理与光电传感器相结合,已发展出一系列基于近红外光谱的仪器。目前,已有多种光电传感器应用于NIRS仪器中[18],如连续波NIRS采用的OPT101光电二极管(美国Texas Instruments公司)[6],频域NIRS采用的光电倍增管(photomultiplier tubes,PMTs)(德国PicoQuant公司)[19],NIRS弥散相关光谱采用的单光子计数雪崩光电二极管(avalanche photodiodes,APDs)(美国Pacer公司)[20],及时域NIRS采用的条纹/时间门控增强电荷耦合器件相机[21]。尽管OPT101的灵敏度并不是上述传感器中最高的,但它具有高灵敏度、高增益和低噪声的特点;并且OPT101在750、805和850 nm NIRS波长下具有更高的响应度,且体积较其他传感器更小,价格更便宜。此外,应用OPT101可以将发光二级光(light emitting diode,LED)光源一并嵌入到探头的柔性电路板上,使得整个NIRS仪器更加紧凑和耐用。另外,在临床NIRS仪器应用中,OPT101比APDs和硅光电倍增管(silicon photomultiplier modules, SiPMs)所需的围电子元件更少。因此在现阶段,采用OPT101光电二极管的连续波NIRS设备比其他类型NIRS仪器更接近于临床。
与普通诊室相比,ICU更需要便携式技术,以便在床边实现实时、准确的监测和无创监测,从而为患者提供有效的重症监护和及时治疗。基于光电传感器的连续波NIRS技术具有无创监测、便携性好、体积紧凑等优点,在ICU应用中具有巨大潜力。对集成OPT101的便携式NIRS仪器(特别是ICU用设备)的研究进展做一综述,对笔者研究团队以及合作单位开展的,基于OPT101的ICU-NIRS仪器研发工作进行回顾分析。其中,对OPT101在近红外波段(700~900 nm),特别是在735、805和850 nm下的光电响应特性进行了介绍。利用真实光传播模型,定量分析了OPT101在人体组织中传感信号的可行性。介绍了ICU-NIRS仪器测量的血液动力学参数,以及相关的测量算法。此外,对3种成功研发的基于OPT101的ICU-NIRS仪器进行了介绍,其分别用于血栓的早期诊断和治疗效果跟踪、休克的无创监测、医务人员的疲劳评估[6,9,17,22]。采用人体实验对这些仪器的可靠性进行了验证。结果显示,OPT101非常适用于ICU-NIRS仪器对血液动力学相关参数的测量,在临床和家庭医疗健康方面具有巨大的应用前景。
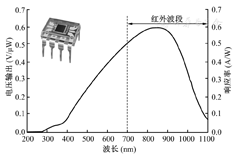
OPT101是一种集成型光电二极管,在其芯片上集成了光电二极管和跨阻放大器。该放大器可使用单电源或双电源运行,并可使用电池驱动。这种集成化设计可以有效地降低电流泄漏与噪声,并减少杂散电容引起的增益峰化。在光电导模式下,OPT101集成的8.1×10-3平方英寸的光电二极管可提供相当高的线性度和非常低的暗电流。OPT101的工作电压范围为2.7~36 V,静态电流仅为120 μA。在外部反馈电阻为5 MΩ、电容为10 pF时,OPT101的带宽为2.5 kHz,直流增益和实际工作电压分别为6×106 V/A和5 V。根据OPT101的特殊响应曲线,其在735、805和850 nm波长处的响应峰值接近86%,高于SiPMs传感器(~5%)和APDs传感器(~80%),保证了在这些波长下的高灵敏度监测。(图1、表1)
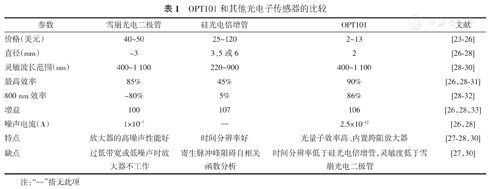
OPT101和其他光电子传感器的比较
OPT101和其他光电子传感器的比较
| 参数 | 雪崩光电二极管 | 硅光电倍增管 | OPT101 | 文献 |
|---|---|---|---|---|
| 价格(美元) | 40~50 | 25~120 | 2~13 | [23,24,25,26] |
| 直径(mm) | ~3 | 3、5或6 | 2 | [26,27,28] |
| 灵敏波长范围(nm) | 400~1 100 | 220~900 | 400~1 100 | [28,29,30] |
| 最高效率 | 85% | 45% | 90% | [26,28,29,30,31] |
| 800 nm效率 | ~80% | 5% | 86% | [28,29,30,31,32] |
| 增益 | 100 | 107 | 106 | [26,28,33] |
| 噪声电流(A) | 1×10-7 | — | 2.5×10-12 | [26,28] |
| 特点 | 放大器的高噪声性能好 | 时间分辨率好 | 光量子效率高、内置跨阻放大器 | [27,28,30] |
| 缺点 | 过低带宽或低噪声时放大器不工作 | 寄生脉冲峰阻碍自相关函数分析 | 时间分辨率低于硅光电倍增管,灵敏度低于雪崩光电二极管 | [27,30] |
注:"—"指无此项

如表1所示,在各种用于NIRS仪器的光电传感器中,OPT101具有高增益和低成本的特点,其灵敏度虽不突出但可以满足非侵入、高灵敏测量的需求。此外,与APDs和SiPMs不同,OPT101内置跨阻放大器,外围元件少,可与LED光源一同嵌入柔性电子电路板,使得NIRS仪器更便携,甚至可穿戴。综上,OPT101具有灵敏度高、体积小、电气性能好、成本低等优点,非常适合嵌入床边监测设备与护理仪器,用于监测选定波长的光强变化。
在NIRS应用中,OPT101可被用来采集人体某个测量部位的光强信号,并将采集到的光信号转换为电信号(如电压),通过记录输出电压响应并转换成生理变化信号,最后在定制的NIRS软件中进行显示。在这些基于OPT101的NIRS仪器中,对于单个OPT101或OPT101传感器阵列的校准并不是必须的。因为,根据线性光电响应和线性放大器响应特性,OPT101传感器的电压输出是随光强线性增加的。而且在生理变化监测中,监测目标是光密度的变化,是被测光强度变化序列与被测初始光强度基线的比值,这种测量属于相对测量。而在绝对测量中,对传感器的校准则是必须的。
在使用OPT101进行NIRS仪器的探头设计时,需要根据被测感兴趣区(region of interest,ROI)形状、表面几何构型与数据处理算法,确定传感器的数量、光源与传感器的间距、光源和传感器的布置方式等。图2显示了几种使用OPT101的近红外监测探头,包括手持式健康监测器,血栓监护仪、休克监护仪和疲劳监测器。其中,手持式健康监测器用于测量腿部,上肢和乳房等部位,因此探头表面被设计成曲面;内部电路采用刚性电路板设计,硬封装,手持式外观;采用两个OPT101在光源两侧放置,用以实现相对双边比较测量;光源和传感器的间距为2.5 cm,该值是测量身体组织的最佳平均值(图2A)。用于血栓、疲劳和休克的监测探头被设计在柔性印刷电路板上;除传感器和光源部位,探头表面贴有黑色皮革,以使探头表面和监测表面紧密贴合,从而有效减少背景噪音和信号泄漏(图2B,图2C,图2D)。


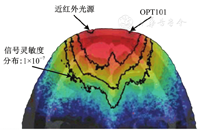
近红外监测仪器的探头设计中,光电传感器的信噪比是关键因素。通过使用体素化组织介质内蒙特卡罗光传播模型[34]和中国可视化人体(Chinese visible human,CVH)头部模型,计算出头部信号的灵敏度分布(signal sensitivity distribution,SSD)图,以分析信噪比对探头设计的影响(图3)。因为,人体头部具有最复杂的组织结构[35,36,37]。如图3,当信噪比超过OPT101传感器的探测极限时(1×10-7),近红外光源和传感器的间隔允许的组织检测深度大于3 cm;而深度超过3 cm的组织区域的累积光信号高于入射光的1.27×10-6。SSD的数据表明,OPT101可实现组织光信号的灵敏、可靠检测。

根据组织光学原理,血红蛋白是近红外光的主要吸收体,氧合血红蛋白(HbO2)和脱氧血红蛋白(Hb)的吸收光谱均在近红外光范围内,而人体的主要发色体——水对近红外光几乎不起作用。因此,NIRS监测技术能够无创地测量人体组织的血流动力学变化。如图3所示,近红外光源向组织发光,OPT101在距光源一定距离(r0)的位置接收从组织传出的光。通过改变r0,使用OPT101的ICU-NIRS仪器可以提取不同深度组织的生理参数。其原理是,通过被测组织的光强(I)被OPT101监测到,其光信号可由下式转换为光密度(OD)。
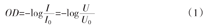
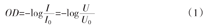
式中:I0为初始光强,I为被测光强,U0和U分别是初始转换电压和转换电压信号,分别与I0和I对应。通过使用最小二乘拟合法,以光密度为纵坐标,以光源与传感器之间的距离为横坐标,可以计算波长λi的光散射系数(D(λi))与斜率(S(λi))之间的关系[9]
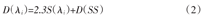
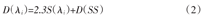
式中:D(SS)为标准样品的光扩散系数。而HbO2和Hb的含量,可由公式(3)和(4)表示[6,9]
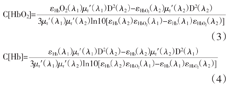
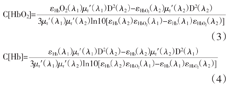
式中:εHbO2(λi)和εHb(λi)分别为HbO2和Hb在波长λi处的消光系数,C[HbO2]为氧合血红蛋白含量,C[Hb]为脱氧血红蛋白含量。波长λi处的光衰减因子(μt′(λi))可由公式(5)计算得出[9]
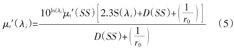
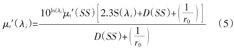
式中:μt′(λi)是标准样品的光衰减因子。相对于初始值,HbO2与Hb的变化量(Δ[HbO2]和Δ[Hb])可分别由公式(6)和(7)得出[9,38]
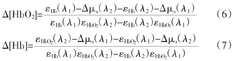
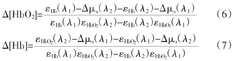
式中:Δμa(λ)是在波长λ处的介质吸收系数的相对变化量。
本节通过3种NIRS监测仪器的研发,阐述OPT101作为光电探测器在ICU-NIRS仪器开发中的创新应用。这3种仪器分别用于血栓诊断与监测、患者休克状态监测以及疲劳评估。这些仪器均由3部分组成,分别是光学探头、控制电路模块和数据分析软件;近红外光源均用采用三波长LED(735、805和850 nm)。实验中所有数据收集工作均经过伦理委员会批准(批准文号:XHECD-2014-005)。
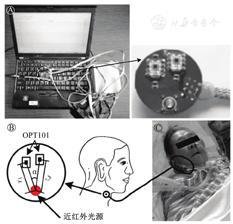
深静脉血栓是一种严重的并发症,可导致严重的后遗症甚至死亡,通常发生于术后人群。大多数深静脉血栓患者有功能障碍的风险,可导致长期发病、诱发溃疡、慢性肿胀、皮肤损伤等。然而,传统的诊断依赖于复杂的成像方法,并可能涉及有创性的造影剂注射和电离辐射[11,12]。因此,笔者团队开发了一种便携式血栓诊断NIRS仪器,可在患者静息状态实现血栓的监测和治疗效果评估[17,22](图4)。
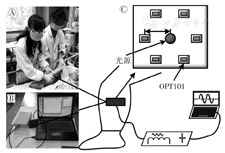

Ⓐ血栓患者数据采集;Ⓑ便携式血栓监护仪;Ⓒ仪器连接示意图
如图4所示,该装置的监测探头包括1个近红外光源和6个围绕光源的OPT101传感器;光源和传感器由控制电路模块驱动并发出735、850 nm的近红外光;控制模块按一定时序从OPT101收集信号。光源与OPT101之间的距离设置为2.8 cm,以便有效接收来自早期血栓组织附近肌肉层的信号,如腿和手臂。通过对血红蛋白变化量(Δ[HbO2]和Δ[Hb])的分析,来反映血栓的发生或状态改变。
创伤和出血导致的失血性休克的致死风险很高,其死亡率可达50%[39,40]。然而,目前临床上用于患者失血性休克诊断和监测技术均为间歇性和侵入性,难以辅助临床医生准确判断救治的最佳时间。因此,笔者团队开发了一种便携式空间分辨NIRS休克监护仪,用于实现休克病人的床边监测(图5)。将颈内中央静脉周围组织的组织血氧饱和度(tissue oxygen saturation,StO2)作为休克严重程度的指标,通过对StO2的监测实现了休克的实时监测,StO2的计算公式为
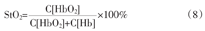
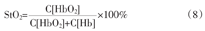
与血栓诊断仪器相比,该仪器可对侧颈部生理参数进行测量,且监测探头具有空间分辨特性,可以测量HbO2和Hb的绝对值。

Ⓐ休克监护仪;Ⓑ监测探头;Ⓒ休克患者数据采集
r1—传感器1与光源的距离;r2—传感器2与光源的距离;α—2个传感器间的夹角
如图5所示,休克监护仪的探头上有1个近红外光源和2个OPT101传感器;光源和2个OPT101之间的距离分别为r1和r2;2个OPT101之间的夹角是α,角度范围为0°~13.5°。α的设定受到2个因素限制,即OPT101间的安全距离以及r1和r2间的细小差别,α的典型值范围为4.5°~9.5°之间。利用r1和r2的差分集和绝对测量算法,可以获得休克状态敏感区(颈内中央静脉周围组织)的StO2值。使用该装置,成功获得了12名休克患者治疗1 d后的StO2数据,并通过线性分析和Bland-Altman图与中心静脉血样饱和度(systemic central venous oxygen saturation,ScvO2)(休克预测的金标准)结果进行了对比验证[6]。
通常,医生和护士会在ICU工作很长时间,产生严重的疲劳问题,需要量化管理和适当的干预。因此,笔者团队开发了一种便携式NIRS疲劳评估装置,用来评估长时间工作或手术引起的疲劳(图6)。采用人体实验对该装置进行了验证,招募了10名健康受试者,采用在驾驶模拟平台上进行赛车游戏的方式模拟ICU临床医生的疲劳状态,游戏时间7 h;实验中,每小时对受试者进行视觉选择性注意力测试。便携式NIRS成像仪探头贴于受试者前额,每隔1 h采集其血液动力学数据并进行视觉选择性注意力测试。基于神经血管耦合理论,使用血液动力学数据([HbO2]和[Hb])分析大脑活动反应,并用注意力测试中的数据(Δ[HbO2]和Δ[Hb])进行验证,以确定NIRS监测方法是否可用于疲劳的评估。
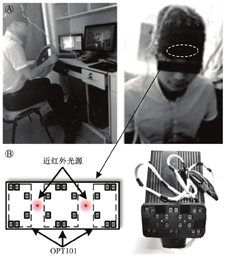

Ⓐ受试者数据采集;Ⓑ监测探头
如图6所示,便携式NIRS疲劳评估装置的探头包含1个近红外光源和20个OPT101传感器,可实现8个通道的监测,其中离光源最近的传感器负责减少来自皮肤的伪影。在选择性注意力测试中,分别记录10名受试者对注意力刺激信号的反应时间(RT);将受试者精神疲劳程度量化为操作准确度与RT的比值,即行为表现因子(准确度/RT);分析由电脑游戏引起的精神疲劳导致的血液动力学参数变化与行为表现因子之间的关系;最后计算出疲劳程度增加后的前额激活图,以便直观地显示前额活动的变化。
采用便携式血栓诊断NIRS仪器对正常受试者和血栓患者的血液动力学参数进行了比较(图7)。结果显示,正常受试者的Δ[HbO2]/Δ[Hb]值范围为11.0±0.95,而血栓患者的Δ[HbO2]/Δ[Hb]值范围为9.6±1.10。Studentt检验结果显示,两者差异存在统计学意义(P<0.001)(图7A)。如图7B所示,在患者治疗期间,其患有血栓的腿Δ[HbO2]值不断下降,而Δ[HbO2]在治疗结束后的恢复期逐渐升高,并在治疗后2 d达到最高值;而未患血栓的腿Δ[HbO2]值在治疗1 d内恢复到初始状态,并在治疗后保持稳定。结果表明,使用便携式NIRS血栓监护仪可以监测血液动力学变化,并根据液动力学参数Δ[HbO2]/Δ[Hb]或更灵敏的Δ[HbO2]确定血栓区域,可从人体健康区域辨识出血栓区域,并评估治疗效果。
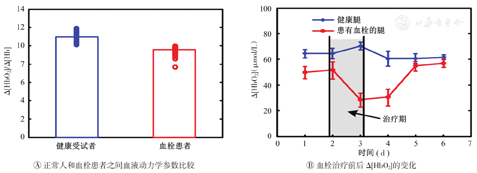

Δ[HbO2]—氧合血红蛋白变化量;Δ[Hb] —脱氧血红蛋白变化量
ScvO2是预测休克严重程度的金标准,因此在实验期间通过常规血滴采样和血液-气体分析对患者ScvO2数据进行了采集。将ScvO2数据作为对照,对便携式空间分辨NIRS休克监护仪的可靠性和灵敏度进行分析。结果表明,休克监护仪监测到的StO2数据与ScvO2数据之间存在明显的相关性(R=0.843,P<0.001)(图8)。如图8B所示,总共12个数据中,只有3个数据点落在ScvO2的95%置信区间外;但这3个数据点与95%置信区间非常接近。Bland-Altman图表明,StO2和ScvO2之间存在相当好的一致性(平均差为4.16%)。以上结果表明,在ScvO2测试的原位监测的StO2数据具有代替当前金标准参数(ScvO2)的潜力。
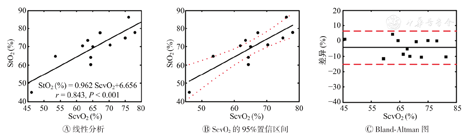

ScvO2—中心静脉血样饱和度;StO2—组织血氧饱和度
疲劳评估结果显示,随着游戏时间的延长,受试者前额血液动力学参数(Δ[HbO2])和行为表现因子(操作准确度/RT)呈非线性变化(图9)。前额激活伪彩图显示,受试者的前额叶是逐渐被激活的,尤其是前额的中下部(黑框部位,图9A)。此外,对受试者前额Δ[HbO2]和行为表现因子进行了统计学分析并绘制了其随时间变化的曲线(图9B)。结果表明,疲劳会导致Δ[HbO2]升高并导致行为表现降低,两者的变化趋势是相反的,Δ[HbO2]和行为表现因子的统计平均值显示出显著的负相关性(R=-0.896,P=0.002)。
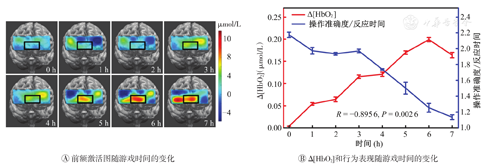

Δ[HbO2]—氧合血红蛋白变化
基于OPT101光电传感器,笔者团队开发了一系列ICU-NIRS监测仪器,包括健康扫描仪、血栓监测仪、休克患者监护仪和疲劳评估成像仪。这些仪器均具备无创、便携、紧凑、实时的特点,且在非侵入、非电离化监测和连续测量等方面优于目前常规使用的方法或技术。实验表明,基于OPT101的NIRS监测仪器具有良好的可靠性和灵敏度,证明了基于OPT101的NIRS监测在医学与生命科学多个领域中的应用可行性,如嵌入式与便携式近红外光谱仪、ICU和家庭健康用近红外光谱监测仪器等,显示了OPT101的巨大应用潜力。
对血栓监护仪的研究表明,其具有较好的Δ[HbO2]/Δ[Hb]监测灵敏度,适用于血栓的诊断,以及相关治疗效果追踪与评估。此外,血栓监护仪可以监测早期形成的血栓组织,表明这种装置可用于家庭护理中血栓的早期发现及病情监测。对休克监护仪的研究表明,在颈内静脉周围组织中测得的StO2与通过血滴采样和血气分析测得的ScvO2(金标准)具有很好的一致性。但ScvO2不能实现实时、连续地测量,难以监测休克的发生与预测救援时间窗口;而通过NIRS测量StO2可实现休克发作与病情发展的实时监测。对疲劳评估仪器的研究表明,人体Δ[HbO2]随着工作时间的延长而升高,且与行为表现因子高度负相关(R=-0.899,P=0.002 6),证明NIRS能以无创、实时的方式对疲劳进行定量评估。
下一步工作中,笔者团队将扩大OPT101嵌入式近红外光谱系统在生命科学领域的应用范围。随着研究深入,OPT101的监测灵敏度将进一步接近其他类型NIRS仪器中使用的昂贵且复杂的传感器,从而使NIRS仪器体积更小、成本更低以及更易商业化。另外,SiPM传感器体积越来越小、性能越来越好,尤其是高时间分辨率的特点使其在紧凑时间分辨或相关的近红外光谱监测中显示巨大潜力。此外,OPT101在未来有望采用贴片式设计,从而进一步减小其体积,可使前文所述NIRS监测仪器发展为柔性可穿戴智能医疗健康设备。
无



























